TDM antibiotik v klinické praxi
TDM of antibiotics in clinical practice
A key strategy in optimizing aminoglycosides and vancomycin therapy is therapeutic drug monitoring. It is a specific method of clinical pharmacology used to monitor the therapy using measurement of drug serum concentrations followed by interpretation by a clinical pharmacologist/ pharmacist and good cooperation with the clinician. Therapeutic drug monitoring helps clinicians to quickly optimize aminoglycosides and vancomycin dosing regimens to maximize the clinical effect, minimize the toxicity of the drugs, decrease mortality and morbidity and reduce costs. Aminoglycosides (amikacin and gentamicin) constitute one of the oldest classes of antimicrobials. Despite their relative toxicity, mainly nephrotoxicity and ototoxicity, aminoglycosides are valuable in current clinical practice. They are bactericidal agents used against aerobic gram ‑ negative infections, and in combination with a cell wall active antimicrobial‑based regimen (e. g. b ‑ lactams), also against gram ‑ positive cocci. Aminoglycosides have a concentration ‑ dependent bactericidal effect and a long post‑antibiotic effect. There is accumulating evidence to show that large, single, daily doses (or more correctly, extended interval dosing) of aminoglycosides are associated with lower nephro ‑ and ototoxicity and comparable, if not superior, clinical outcomes than the same total dose administered in small, multiple doses. A general therapeutic range of aminoglycosides does not exist. Every patient has his/ her own optimal target concentration based on the microorganism susceptibility, co ‑ administered antibacterials, immune status and co ‑ administration of other nephro‑or ototoxic drugs. Minimum serum vancomycin trough concentrations should always be maintained above 10 mg/ L to avoid development of resistance, nevertheless, trough concentrations > 20 mg/ L are not recommended because of the risk of nephrotoxicity. For serious gram ‑ positive infections vancomycin trough concentrations of 15 – 20 mg/ L are recommended. In non‑complicated infections (urinary tract infections or mild ‑ to ‑ moderate skin and soft tissue infections) trough concentrations of 10 – 15 mg/ L should be sufficient. For continuous infusions of vancomycin target steady ‑ state concentration values of 15 – 25 mg/ L is optimal. We demonstrate some case reports of therapeutic monitoring of aminoglycoside antibiotics and vancomycine from our routine practice.
Keywords:
therapeutic monitoring – amikacin – gentamicin – vancomycin
Autoři:
I. Kacířová 1,2; M. Grundmann 1
Působiště autorů:
Ústav klinické farmakologie, LF OU, Ostrava
1; Oddělení klinické farmakologie, Ústav laboratorní diagnostiky, FN Ostrava
2
Vyšlo v časopise:
Kardiol Rev Int Med 2015, 17(1): 57-64
Kategorie:
Interní medicína
Souhrn
Klíčovou úlohu v optimalizaci dávkování aminoglykosidových antibiotik a vankomycinu má terapeutické monitorování hladin, což je specifická metoda oboru klinické farmakologie pro monitorování terapie využívající analýzu hladin léčiv v séru s následnou erudovanou interpretací klinickým farmakologem/ farmaceutem a akceptací ošetřujícím klinikem. Použití terapeutického monitorování vede k individualizaci dávkování uvedených antibiotik u jednotlivých pacientů, a tím k maximalizaci klinického efektu, minimalizaci toxicity, snížení mortality a morbidity, a tím ke snížení nákladů na zdravotní péči. Aminoglykosidy amikacin a gentamicin patří k nejstarším antibiotikům, nicméně i dnes jsou cennou léčebnou skupinou i přes své relativně toxické účinky (nefro ‑ a ototoxicita). Používají se zejména proti aerobním gramnegativním patogenům a v kombinaci s antibiotiky poškozujícími buněčnou stěnu (např. betalaktamy) také proti grampozitivním kokům. Jsou typické svým koncentračně‑závislým baktericidním účinkem a dlouhým postantibiotickým efektem. Již bylo publikováno mnoho důkazů o tom, že jedna velká denní dávka (resp. prodloužený dávkovací interval) aminoglykosidů je spojena s nižším rizikem nefro ‑ a ototoxicity a srovnatelnou, ne‑li lepší klinickou účinností v porovnání se stejnou celkovou denní dávkou rozdělenou na několik dílčích dávek aplikovaných během dne. U aminoglykosidů neexistuje obecné terapeutické rozmezí, každý pacient má svou vlastní optimální cílovou hladinu, která vyplývá z citlivosti bakterií, současně podávaných antibiotik, imunitního stavu a užívaných nefro ‑ a ototoxických léčiv. U vankomycinu by měla být údolní hladina udržována nad 10 mg/ l k zabránění rozvoje rezistence, neměla by však přesáhnout 20 mg/ l vzhledem k riziku nefrotoxicity. U závažných infekcí je doporučováno rozmezí 15 – 20 mg/ l, k léčbě méně závažných stavů (infekce močového ústrojí, mírné až středně těžké infekce kůže nebo měkkých tkání) by měla postačovat údolní hladina nižší (10 – 15 mg/ l). Při aplikaci vankomycinu v kontinuální infuzi je doporučováno dosažení hladiny v ustáleném stavu v rozmezí 15 – 25 mg/ l. V této práci demonstrujeme několik případů terapeutického monitorování hladin aminoglykosidových antibiotik a vankomycinu z naší rutinní praxe.
Klíčová slova:
terapeutické monitorování – amikacin – gentamicin – vankomycin
Úvod
Terapeutické monitorování léčiv (TDM) je specifická metoda oboru klinické farmakologie využívaná k monitorování farmakoterapie pomocí měření hladin léčiv v séru s následnou erudovanou interpretací klinickým farmakologem/ farmaceutem a akceptací indikujícím klinikem. Je významnou součástí personalizované medicíny při individualizaci dávkování, poněvadž umožňuje racionalizaci terapie s minimalizací výskytu nežádoucích účinků, snížení morbidity a mortality, snížení nákladů na léčebnou péči a zlepšení kvality života pacientů. Základním předpokladem TDM je existence mnohem bližšího vztahu mezi farmakologickým efektem léčiva a jeho hladinou v séru než jeho dávkou. V současné době je pro kontrolu terapie využíváno TDM mimo jiné i u antibiotik (ATB), a to zejména u aminoglykosidů (gentamicin, amikacin) a glykopeptidů (vankomycin) [1].
Aminoglykosidy jsou stále cennou léčebnou skupinou i přes své relativně toxické účinky. Používají se zejména proti aerobním gramnegativním infekcím a v kombinaci s antibiotiky poškozujícími buněčnou stěnu (např. betalaktamy) také proti grampozitivním kokům. Jsou minimálně vázány na plazmatické proteiny a jejich eliminace probíhá zejména glomerulární filtrací nezměněného léčiva do moči. K nežádoucím účinkům patří hlavně nefro ‑ a ototoxicita, vzácně neuromuskulární blokáda. Nefrotoxicita je většinou po vysazení aminoglykosidů reverzibilní, pouze u léčby kriticky nemocných může být fatální, a její vyšší výskyt se objevuje v kombinaci s dalšími nefrotoxickými léčivy (např. vankomycinem). Snížení rizika nefrotoxicity umožňuje zejména monitorování hladin aminoglykosidů s pravidelnou kontrolou sérového kreatininu. Ototoxicita může způsobit poškození sluchu a vestibulárních funkcí, které je ireverzibilní. Neuromuskulární blokáda je sice vzácným, nicméně potenciálně nebezpečným nežádoucím účinkem zejména u pacientů, kterým jsou současně aplikována léčiva blokující neuromuskulární přenos, nebo u pacientů s neuromuskulárním onemocněním (myasthenia gravis, parkinsonizmus) [2 – 4]. Amikacin a gentamicin jsou aminoglykosidová antibiotika se širokým spektrem účinku určená k léčbě těžkých infekcí vyvolaných citlivými bakteriemi tam, kde jsou méně toxická antibiotika neúčinná. Vyznačují se úzkým terapeutickým indexem a jejich účinnost i toxicita úzce souvisí s dosaženou hladinou v séru. Subterapeutické hladiny zvyšují riziko vzniku rezistence bakterií i mortality, supraterapeutické hladiny jsou spojeny s výskytem nežádoucích účinků. Kritické minimální inhibiční koncentrace (MIC) dle EUCAST (European Committee on Antimicrobial Susceptibility Testing) jsou jako senzitivní uváděny u amikacinu ≤ 8 mg/ l, u gentamicinu ≤ 1 mg/ l (stafylokoky) až ≤ 4 mg/ l (Pseudomonas spp., Acinetobacter spp.) [2].
Vankomycin jako hlavní představitel glykopeptidových antibiotik je používán především k léčbě stafylokokových infekcí rezistentních na methicilin (MRSA). Stejně jako aminoglykosidy je z organizmu vylučován zejména glomerulární filtrací. Jeho příliš vysoká dávka může vést k nefro ‑ a ototoxicitě, a to hlavně při použití s další nefrotoxickou medikací (např. aminoglykosidy), naopak příliš nízká dávka je nejen neúčinná, ale významně zvyšuje riziko vzniku rezistence mikroorganizmů vůči vankomycinu [5].
Přestože jsou uváděna různá doporučení a nomogramy k úpravě dávkování obou skupin antibiotik, široká intra ‑ a interindividuální variabilita jejich farmakokinetiky (dosažení rozdílných hladin při aplikaci stejné dávky) dokazuje potřebu terapeutického monitorování hladin u každého jednotlivého pacienta. Pokud je použita pouze empirická úprava dávkování, dochází k „období pokusu a omylu“ s různými dávkovacími režimy do dosažení optimální sérové hladiny, což může vést k chybné úpravě dávkování, prodloužení doby k dosažení cílové hladiny a ke zbytečnému navyšování nákladů na zdravotní péči. Již bylo prokázáno, že při dosažení cílové terapeutické sérové hladiny aminoglykosidů v dřívějším období léčby jsou dosahovány lepší klinické výsledky [6]. Také ve skupině pacientů léčených vankomycinem za pomoci TDM byl zdokumentován vyšší podíl terapeutické úspěšnosti a nižší podíl nefrotoxicity v porovnání se skupinou léčenou bez použití TDM [7].
Aminoglykosidy se vyznačují koncentračně závislým baktericidním účinkem a dlouhým postantibiotickým efektem, který vyjadřuje dlouhodobější kontinuální supresi bakteriálního růstu, i když koncentrace léčiva dosáhne hodnoty pod MIC bakterií. Je uváděno stále více důkazů, že jedna velká denní (tzv. once ‑ daily) dávka (resp. prodloužený dávkovací interval) aminoglykosidů je spojena s menším rizikem nefro ‑ a ototoxicity a se srovnatelnými, ne‑li lepšími klinickými výsledky v porovnání se stejnou celkovou dávkou podávanou v menších, vícenásobných dávkách. Základní farmakodynamické indikátory účinnosti aminoglykosidů jsou:
- poměr plochy pod křivkou za 24 hod a minimální inhibiční koncentrace (AUC0‑ 24/ MIC),
- poměr maximální sérové koncentrace a minimální inhibiční koncentrace (Cmax/ MIC).
Poměr Cmax/ MIC souvisí výhradně s distribučním objemem, zatímco poměr AUC0‑ 24/ MIC je ovlivněn jak distribučním objemem, tak clearance léčiva [6]. V rutinní zdravotnické péči není stanovení AUC doporučováno, jako náhrada se používá stanovení minimální neboli údolní (trough = Cmin) a maximální (peak = Cmax) koncentrace, přičemž cílová maximální koncentrace by měla být založena na citlivosti přítomného patogenu. Zvyšující se údolní koncentrace aminoglykosidů při aplikaci stejné dávky může být dřívějším a poměrně silným znamením snížené renální filtrační kapacity [4]. Významné je také místo infekce, vysoká once ‑ daily dávka je žádoucí zejména v případě pulmonární nebo meningeální infekce, kam je průnik aminoglykosidů snížený. U aminoglykosidů neexistuje obecné terapeutické rozmezí, každý pacient má vlastní optimální cílovou koncentraci, která vyplývá z citlivosti bakterií, současně podávaných antibiotik, imunitního stavu a užívaných nefro ‑ nebo ototoxických léčiv. Na rozdíl od vankomycinu zatím pro TDM aminoglykosidů jednotné guidelines nebylo publikováno. Tradiční dávkování zahrnovalo malé dávky aminoglykosidů aplikované každých 8 – 12 hod. U gentamicinu byla stanovena Cmax 8 – 10 mg/ l a Cmin < 2 mg/ l, u amikacinu Cmax 20 – 40 mg/ l a Cmin < 10 mg/ l [4,8]. V současnosti panuje na hodnoty Cmax sporný názor, většinou se pohybují v rozmezí od 10 – 25 mg/ l do 30 – 40 mg/ l u gentamicinu a mezi 15 a 60 mg/ l u amikacinu. Přesně definován zatím nebyl ani čas Cmax, nejčastěji se uvádí, že je dosažen za 30 – 60 min po aplikaci 30 – 60minutové infuze. Aplikovaná dávka by měla také být upravena dle co nejdříve stanovené MIC, což bohužel často trvá déle než samotná terapie aminoglykosidy. Monitorování Cmin je doporučováno mnohem více, jelikož prokazatelně souvisí s nefrotoxicitou, je uváděno od 0,5 do 1 mg/ l nebo 2 mg/ l pro gentamicin a od 2,5 do 5 mg/ l pro amikacin [9,10].
Co se týká léčby infekčních endokarditid, využívá se synergického účinku aminoglykosidů s inhibitory buněčné stěny (betalaktamy, glykopeptidy) jak k dosažení baktericidní aktivity, tak ke zkrácení trvání terapie (např. u orálních streptokoků) a eradikaci problematických organizmů (např. Enterococcus spp.). Na základě Guidelines on the prevention, diagnosis, and treatment of infective endocarditis, new version 2009 je doporučeno u streptokokové endokarditidy aplikovat gentamicin v jedné denní dávce s monitorací renálních funkcí a sérových hladin gentamicinu 1× týdně, Cmin by měla být < 1 mg/ l a hladina za 1 hod po aplikaci 10 – 12 mg/ l. U endokarditidy stafylokokové, enterokokové a při počáteční empirické léčbě je doporučováno aplikovat gentamicin ve dvou nebo třech denních dávkách s monitorací renální funkce a sérové hladiny gentamicinu 1× týdně (2× týdně v případě renálního selhávání), s Cmin < 1 mg/ l a za 1 hod po aplikaci by měla hladina dosahovat 3 – 4 mg/ l [11]. Doporučení k léčbě infekční endokarditidy byla dále aktualizována v roce 2012 ve Švédsku, kdy se dávkování v jedné denní dávce doporučuje u většiny případů, s výjimkou aplikace ve dvou denních dávkách u obtížně léčitelných endokarditid, jako je enterokoková endokarditida a endokarditida chlopenní náhrady. Pak by při dávkování gentamicinu 2× denně neměla Cmin přesáhnout 1 mg/ l a Cmax by měla dosahovat minimálně 3 – 5 mg/ l [4]. Potřeba terapeutického monitorování hladin amikacinu a gentamicinu je uváděna také v Souhrn údajů o přípravku (SOP) Státního ústavu pro kontrolu léčiv (SÚKL) České republiky, uvedená doporučení se však u přípravků různých výrobců liší [2].
Na našem pracovišti používáme v současnosti tato rozmezí [3]:
Gentamicin
- před podáním (Cmin): < 2 mg/ l (aplikace 2 – 3× denně), < 1 mg/ l (aplikace 1× denně a infekční endokarditida),
- po podání (Cmax): 3 – 5 mg/ l (infekční endokarditida), 5 – 10 mg/ l (aplikace 2 – 3× denně), 10 – 30 mg/ l (aplikace 1× denně); nebo optimálně 8 – 10× MIC.
Amikacin
- před podáním (Cmin): < 10 mg/ l (aplikace 2 – 3× denně), < 5 mg/ l (aplikace 1× denně),
- po podání (Cmax): 20 – 30 mg/ l (aplikace 2 – 3× denně), 30 – 80 mg/ l (aplikace 1× denně); nebo optimálně 8 – 10× MIC.
U vankomycinu je jako nejvhodnější ukazatel účinnosti v léčbě MRSA infekce u dospělých uváděn poměr AUC0‑ 24 a MIC, přičemž jako farmakokineticko‑farmakodynamický cíl je doporučována hodnota AUC0‑ 24/ MIC ≥ 400. Stejně jako u aminoglykosidů není v běžné klinické praxi stanovení AUC prováděno, jako náhrada se používá měření údolní koncentrace (Cmin), která by měla být vždy udržována ≥≥ 10 mg/ l ke zlepšení klinického výsledku léčby MRSA infekce a k zabránění vývoje rezistence. Současně by však neměla přesahovat 20 mg/ l vzhledem k riziku nefrotoxicity [12 – 15]. Pro léčbu méně závažných infekčních stavů (infekce močového ústrojí, mírné až středně závažné infekce kůže nebo měkkých tkání) je dostatečná Cmin 10 – 15 mg/ l s menším rizikem nefrotoxicity. K potenciálnímu zlepšení penetrace vankomycinu do cílových tkání, ke zvýšení pravděpodobnosti dosažení optimální cílové sérové hladiny a ke zlepšení klinického výsledku léčby komplikovaných infekcí je doporučována vyšší Cmin 15 – 20 mg/ l, a to v případě závažných infekcí, jako je sepse, infekční endokarditida, osteomyelitida, meningitida, nozokomiální pneumonie způsobená S. aureus a závažné MRSA infekce kůže a měkkých tkání [13,16]. Údolní koncentrace v tomto rozmezí by také měly u většiny pacientů zajistit AUC0‑ 24/ MIC ≥ 400 při MIC ≤ 1 mg/ l. Při MIC ≤ 2 mg/ l určuje pokračování terapie vankomycinem klinický stav pacienta, v případě kladné klinické a mikrobiologické odpovědi se může v terapii vankomycinem pokračovat s pečlivou monitorací klinického stavu. Jestliže klinická nebo mikrobiologická odpověď není uspokojivá i přes adekvátní vyčištění rány a odstranění jiného zdroje infekce, pak je doporučena změna terapie. V případě MIC > 2 mg/ l (např. vancomycin‑intermediate S. aureus „VISA“ nebo vancomycin‑resistant S. aureus „VRSA“) by mělo být rovnou nasazeno jiné antibiotikum, jelikož cílový poměr AUC0‑ 24/ MIC ≥ 400 nemůže být s konvenčním dávkováním vankomycinu u pacientů s normální renální funkcí dosažen [16]. Stanovení maximální sérové koncentrace Cmax má na rozdíl od aminoglykosidů mnohem menší význam vzhledem k farmakodynamickým (časová závislost) a farmakokinetickým (multiexponenciální pokles) vlastnostem vankomycinu. Cmax jen vzácně dosahuje hodnot vedoucích k toxicitě [13], její stanovení je však doporučováno při provádění farmakokinetického modelování [17]. V případě aplikace vankomycinu v kontinuální infuzi by cílové průměrné koncentrace v ustáleném stavu měly dosahovat 15 – 25 mg/ l [18]. Stejně jako u aminoglykosidů je i u vankomycinu potřeba terapeutického monitorování uváděna v Souhrn údajů o přípravku na webových stránkách SÚKL ČR, zde publikovaná doporučení však opět nejsou u přípravků různých výrobců zcela jednotná [2].
Na našem pracovišti jsme terapeutické rozmezí vankomycinu upravili na základě doporučovaných vyšších hodnot [5]:
Vankomycin
- před podáním (Cmin): 10 – 15 mg/ l (15 – 20 mg/ l v případě závažné infekce),
- po podání (Cmax): ≤ 50 mg/ l,
- při aplikaci v kontinuální infuzi: 15 – 20 mg/ l (20 – 25 mg/ l v případě závažné infekce).
Správná interpretace naměřených hladin uvedených antibiotik vyžaduje dodání vyplněné žádanky a znalost práce s počítačovým programem pro farmakokinetickou analýzu využívajícího Bayesianský algoritmus, který zahrnuje jak populační farmakokinetické parametry, tak vlastní pacientská data k individualizaci dávkového doporučení (v ČR je používán zejména software MW ‑ Pharm verze 3.30 a vyšší). Bayesianský algoritmus také umožňuje zjistit optimální dávku antibiotika pouze na základě jedné naměřené hladiny a je i schopen vypočítat vhodnou startovací dávku na základě pacientských údajů vložených do programu. Aplikace této metody vyžaduje znalost farmakokinetických principů a dostatečné zkušenosti, a je proto vyhrazena pouze pro erudované zdravotnické pracovníky (klinické farmakology/ farmaceuty) [6,19]. Specializovaná žádanka obsahuje dávkovou anamnézu, délku trvání terapie, přesný čas aplikace antibiotika a odběrové časy, klinický stav (pohlaví, věk, alespoň přibližná hmotnost a výška, aktuální sérový kreatinin) a celkovou lékovou anamnézu. Jelikož se hladina antibiotik v krvi po aplikaci rychle mění v souvislosti s časem, který uplyne od jeho podání, je velice důležité na žádanku uvést skutečné časy odběrů k provedení správné interpretace. Nicméně, i když je odběr proveden mimo doporučované odběrové časy a na žádance je správně zaznamenán, software provede farmakokinetickou analýzu a umožní nalézt optimální dávkování. Odběry by však neměly být brány z místa aplikace antibiotika (zejména z centrálního žilního katetru), u takto provedeného odběru hrozí naměření falešně vysokých hladin, které nejsou interpretovatelné [3,5]. Dříve doporučované provedení prvního odběru po nasazení antibiotické terapie až po dosažení ustáleného stavu je již překonáno, navíc dosažení ustáleného stavu je možné pouze při stabilním klinickém stavu, což často není případ pacientů na pracovištích intenzivní péče. Zejména u vankomycinu se ke zvýšení účinnosti farmakoterapie vyžaduje dosažení terapeutických hladin v co nejkratší době po nasazení, zvláště u kriticky nemocných. Proto je navrhováno použití vyšší úvodní dávky [20] a provedení odběru hladiny vankomycinu již krátce po této první dávce, což je výhodné zejména u kriticky nemocných nebo akutně dialyzovaných pacientů [21 – 23]. U pacientů mladého a středního věku se stabilními renálními funkcemi a bez podezření na zvýšený distribuční objem, s hladinami v požadovaném terapeutickém rozmezí a uspokojivou klinickou odpovědí není třeba monitorování opakovat častěji než 1 – 2× týdně [4]. Častější nebo i každodenní monitorace je vhodná u pacientů hemodynamicky nestabilních, s velkými výkyvy tělních tekutin, s dynamickými změnami renálních funkcí, dialyzovaných nebo s nedostatečnou klinickou odpovědí [15,21 – 23].
Kazuistiky
Na obr. 1 – 7 prezentujeme některé případy z naší rutinní praxe. Amikacin je stanovován metodou kapalinové chromatografie s tandemovou hmotností spektrometrií (LC ‑ MS/ MS), gentamicin a vankomycin fluorescenční polarizační imunoanalýzou (FPIA). Dávku upravujeme pomocí farmakokinetického programu MW ‑ Pharm, verze 3.30 (obr. 1 – 7).
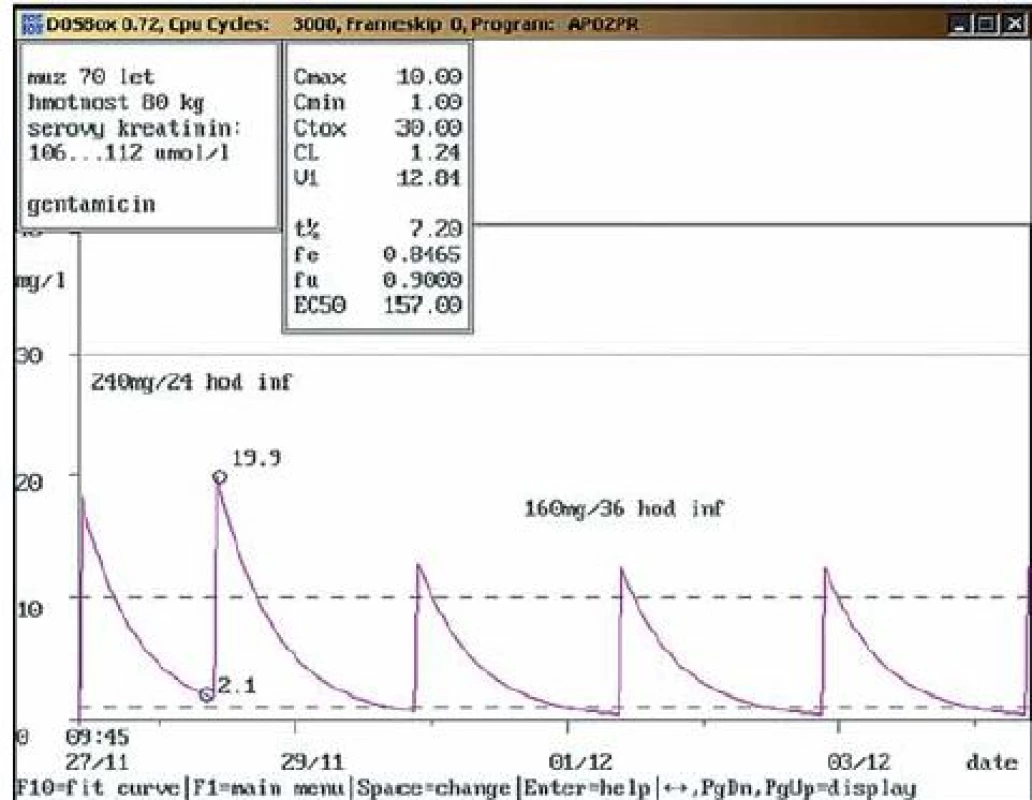

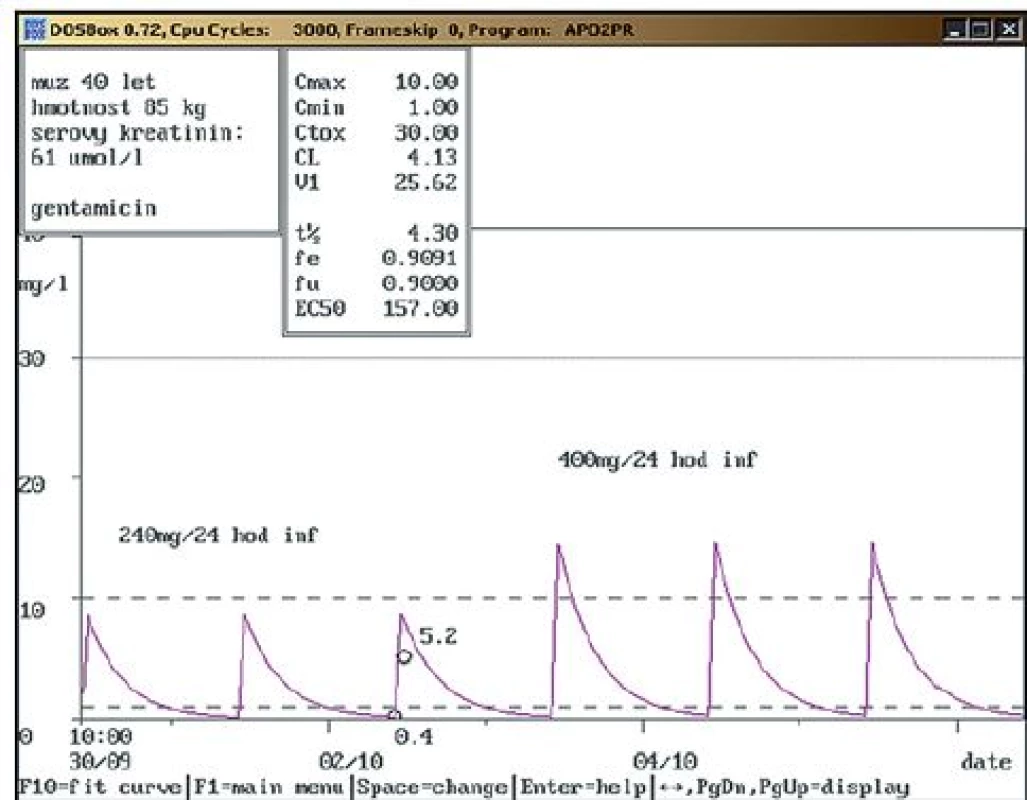

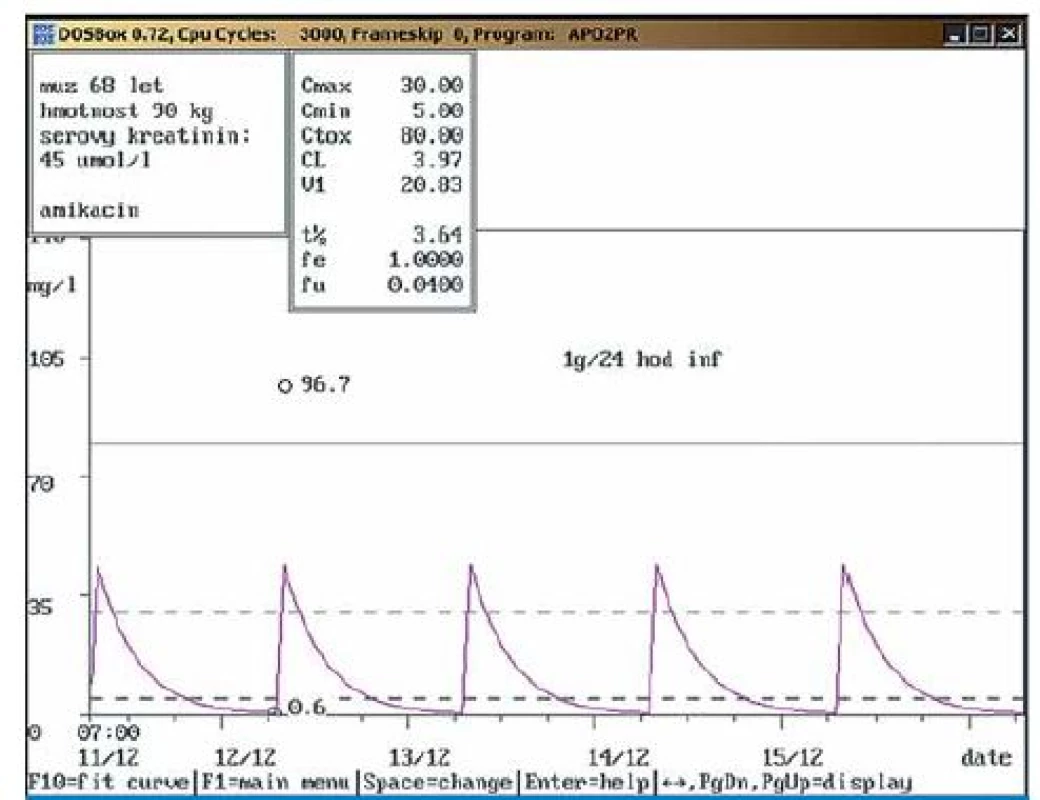

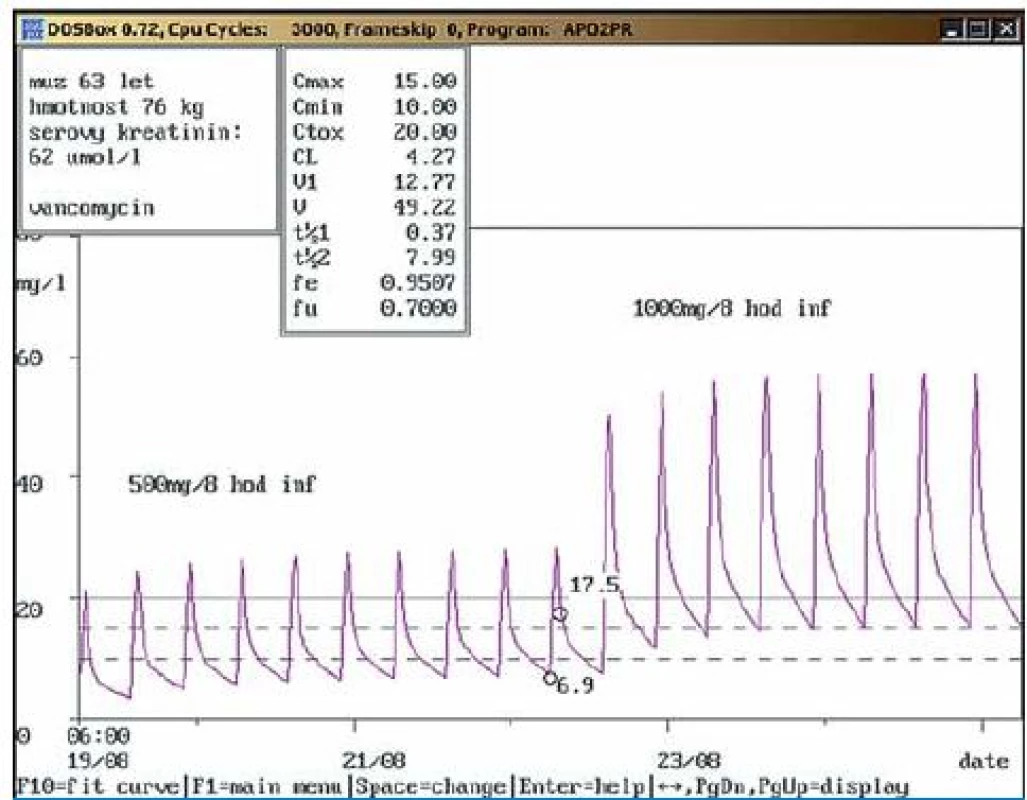

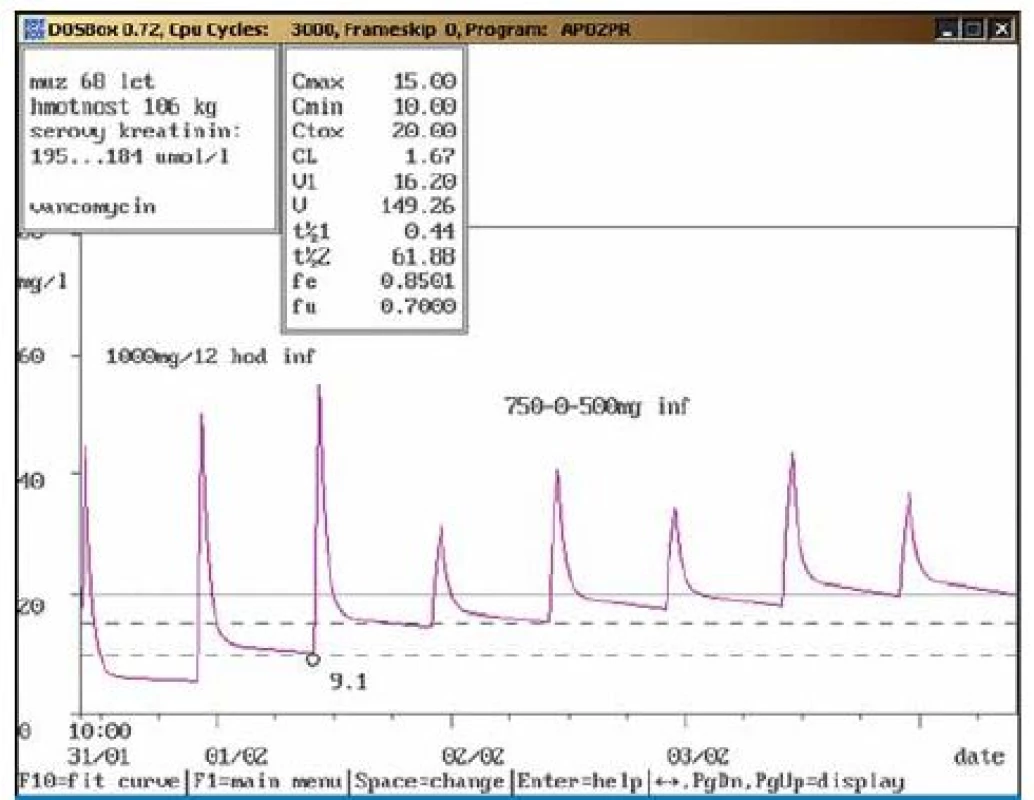

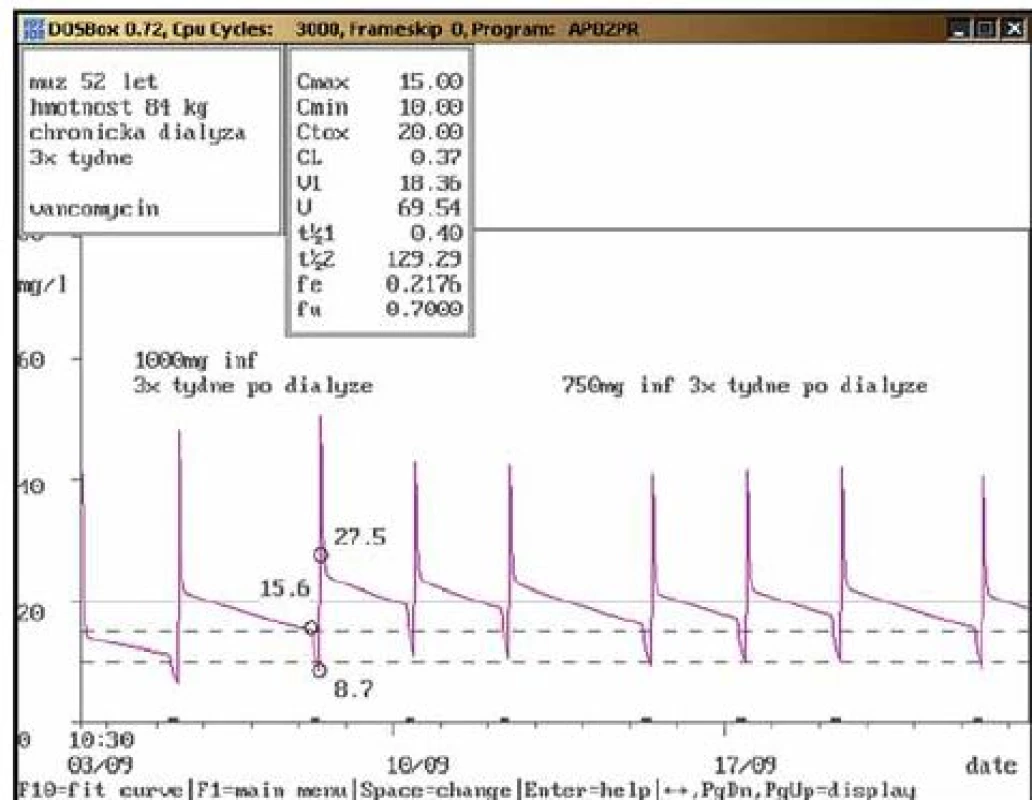

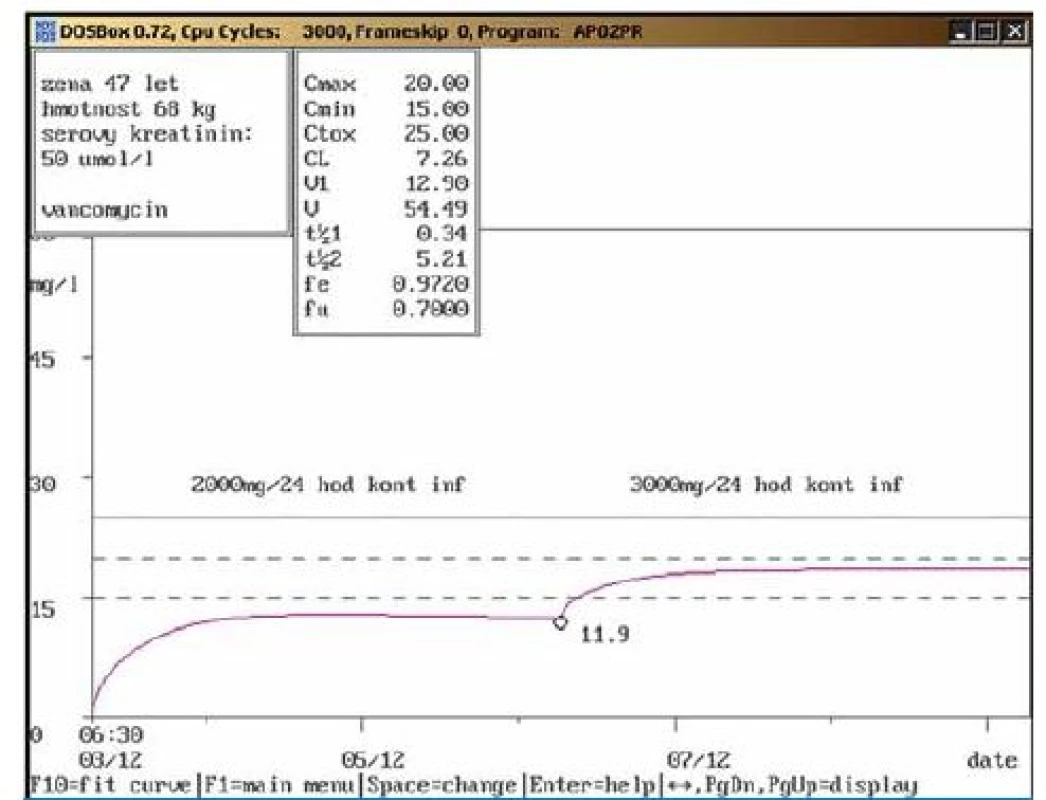

Závěr
U vankomycinu je v léčbě závažných grampozitivních infekcí doporučováno dosažení údolní hladiny v rozmezí 15 – 20 mg/ l, v případě méně závažných stavů (infekce močového ústrojí, mírné až středně závažné infekce kůže nebo měkkých tkání) jsou postačující nižší hodnoty (10 – 15 mg/ l) s menším rizikem nefrotoxicity, která je na dosažené údolní hladině závislá. Při aplikaci v kontinuální infuzi se za optimální považuje hladina v rozmezí 15 – 25 mg/ l. U aminoglykosidů je v současnosti doporučována aplikace tzv. once ‑ daily (v jedné denní dávce) s výjimkou podávání gentamicinu ve dvou denních dávkách u obtížně léčitelných případů endokarditidy. U této skupiny antibiotik na rozdíl od vankomycinu zatím nebyla publikována jednotná guidelines pro terapeutické monitorování. Naopak, neexistuje zde obecné terapeutické rozmezí, každý pacient má svou vlastní optimální cílovou hladinu, která vyplývá z citlivosti bakterií, současně podávaných antibiotik, imunitního stavu a užívaných nefro ‑ nebo ototoxických léčiv. Zásadní roli v optimalizaci terapie obou skupin antibiotik představuje terapeutické monitorování. Rychlá a spolehlivá analýza sérových hladin následovaná erudovanou interpretací s využitím vhodného softwaru, který umožní adekvátní úpravu dávkování již po první dávce, zajišťuje rychlou a adekvátní úpravu dávkování k maximalizaci klinického efektu a minimalizaci toxicity zejména u kriticky nemocných.
Doručeno do redakce: 15. 1. 2015
Přijato po recenzi: 25. 1. 2015
MU Dr. Ivana Kacířová, Ph.D.
www.fno.cz
ivana.kacirova@fno.cz
Zdroje
1. Grundmann M, Kacířová I. Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv. Čas Lék čes 2010; 149 : 482 – 487.
2. Státní ústav pro kontrolu léčiv. [online] Dostupné z: http:/ / www.sukl.cz/.
3. Kacířová I, Grundmann M. Terapeutické monitorování amikacinu a gentamicinu v rutinní klinické praxi. Vnitř Lék 2015; 61. [In press].
4. Hanberger H, Edlund C, Furebring M et al. Rational use of aminoglycosides ‑ review and recommendations by the Swedish Reference Group for Antibiotics (SRGA). Scand J Infect Dis 2013; 45 : 161 – 175. doi: 10.3109/ 00365548.2012.747694.
5. Kacířová I, Grundmann M. Terapeutické monitorování vankomycinu v rutinní klinické praxi. Vnitř Lék 2014; 60 : 846 – 851.
6. Avent ML, Rogers BA, Cheng AC et al. Current use of aminoglycosides: indications, pharmacokinetics and monitoring for toxicity. Intern Med J 2011; 41 : 441 – 449. doi: 10.1111/ j.1445 – 5994.2011.02452.x.
7. Ye ZK, Tang HL, Zhai SD. Benefits of therapeutic drug monitoring of vancomycin: a systematic review and meta‑analysis. PLoS One 2013; 8: e77169. doi: 10.1371/ journal.pone.0077169.
8. Radigan EA, Gilchrist NA, Miller MA. Management of aminoglycosides in the intensive care unit. J Intensive Care Med 2010; 25 : 327 – 342. doi: 10.1177/ 0885066610377968.
9. Boyer A, Gruson D, Bouchet S et al. Aminoglycosides in septic shock: an overview, with specific consideration given to their nephrotoxic risk. Drug Saf 2013; 36 : 217 – 230. doi: 10.1007/ s40264 ‑ 013 ‑ 0031 ‑ 0.
10. Roberts JA, Field J, Visser A et al. Using population pharmacokinetics to determine gentamicin dosing during extended daily diafiltration in critically ill patients with acute kidney injury. Antimicrob Agents Chemother 2010; 54 : 3635 – 3640. doi: 10.1128/ AAC.00222 ‑ 10.
11. Habib G, Hoen B, Tornos P et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer. Eur Heart J 2009; 30 : 2369 – 2413. doi: 10.1093/ eurheartj/ ehp285.
12. Moise ‑ Broder PA, Forrest A, Birmingham MC et al. Pharmacodynamics of vancomycin and other antimicrobials in patients with Staphylococcus aureus lower respiratory tract infections. Clin Pharmacokinet 2004; 43 : 925 – 942.
13. Rybak MJ, Lomaestro BM, Rotschafer JC et al. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the infectious diseases Society of America, the American Society of Health ‑ System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis 2009; 49 : 325 – 327. doi: 10.1086/ 600877.
14. Matsumoto K, Takesue Y, Ohmagari N et al. Practice guidelines for therapeutic drug monitoring of vancomycin: a consensus review of the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring. J Infect Chemother 2013; 19 : 365 – 380. doi: 10.1007/ s10156 ‑ 013 ‑ 0599 ‑ 4.
15. Martin JH, Norris R, Barras M et al. Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health ‑ System Pharmacists, the Infectious Diseases Society of America, and the Society Of Infectious Diseases Pharmacists. Clin Biochem Rev 2010; 31 : 21 – 24.
16. Liu C, Bayer A, Cosgrove SE et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin‑resistant Staphylococcus aureus infections in adults and child-ren: Executive summary. Clin Infect Dis 2011; 52 : 285 – 292. doi: 10.1093/ cid/ cir034.
17. Begg EJ, Barclay ML, Kirkpatrick CM. The therapeutic monitoring of antimicrobial agents. Br J Clin Pharmacol 2001; 52 (Suppl 1): 35S – 43S.
18. Helgason KO, Thomson AH, Ferguson C. A review of vancomycin therapeutic drug monitoring recommendations in Scotland. J Antimicrob Chemother 2008; 61 : 1398 – 1399. doi: 10.1093/ jac/ dkn114.
19. Nunn MO, Corallo CE, Aubron C et al. Vancomycin dosing: assessment of time to therapeutic concentration and predictive accuracy of pharmacokinetic modeling software. Ann Pharmacother 2011; 45 : 757 – 763. doi: 10.1345/ aph.1P634.
20. Li J, Udy AA, Kirkpatrick CM et al. Improving vancomycin prescription in critical illness through a drug use evaluation process: a weight‑based dosing intervention study. Int J Antimicrob Agents 2012; 39 : 69 – 72. doi: 10.1016/ j.ijantimicag.2011.08.017.
21. Petejova N, Martinek A, Zahalkova J et al. Vancomycin pharmacokinetics during high‑volume continuous venovenous hemofiltration in critically ill septic patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2014; 158 : 65 – 72. doi: 10.5507/ bp.2012.092.
22. Petejova N, Martinek A, Zahalkova J et al. Vancomycin removal during low ‑ flux and high‑flux extended daily hemodialysis in critically ill septic patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2012; 156 : 342 – 347. doi: 10.5507/ bp.2012.002.
23. Petejová N, Martínek A, Zahálková J et al. Vliv kontinuální a intermitentní náhrady renálních funkcí na antibiotickou léčbu u kriticky nemocných v sepsi – praktický pohled na léčbu vankomycinem a gentamicinem. Vnitř Lék 2012; 58 : 448 – 454.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2015 Číslo 1
-
Všechny články tohoto čísla
- Vyšetření cerebrovaskulární rezervy u asymptomatických pacientů s významnou stenózou vnitřní karotické tepny
- Genetika kardiomyopatií
- Katetrizační léčba chronické stabilní ischemické choroby srdeční v současnosti
- Katetrizační uzávěr foramen ovale patens u potápěčů
- Katetrizační léčba fibrilace síní
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- Není perikarditida jako perikarditida – kazuistika
- Studie Pegasus – duální antiagregace (ASA + ticagrelor) dlouhodobě po infarktu myokardu
- Nové studie dávají naději na zlepšení terapie aterosklerózy
-
Hlavolamy 2015
Propojení kardiologie a diabetologie - Vyhlášení výsledků autorské soutěže O nejlepší kazuistiku v roce 2014
- Vývoj a úkoly klinické farmakologie ve zdravotnické péči v ČR
- TDM antibiotik v klinické praxi
- prof. MUDr. Josef Veselka, CSc., FESC, FSCAI, FICA (*23. 3. 1965)
- TDM digoxinu v klinické praxi
- Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie
- Lékové interakce a současná klinická praxe
- Přímá perorální antikoagulancia – perspektivy terapeutického monitorování
- Klinická farmakologie antirevmatik
- Specifika klinických hodnocení léčiv časných fází I a II
- Význam TDM metotrexátu při terapii psoriázy
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- TDM antibiotik v klinické praxi
