Farmakoterapie při chronickém onemocnění ledvin
Drug therapy in chronic kidney disease
Chronic kidney disease belongs among the most frequent clinical problems, but often remains underdiagnosed. Decreased renal function affects all pharmacokinetic properties of drugs. Thus, patients with chronic kidney disease are at increased risk of adverse drug effects – especially overdoses of drugs that are primarily eliminated by the kidneys. Other frequent problems in patients with kidney disease are polymorbidity and polypharmacy. Before using any new medication, determination of the glomerular filtration rate is obligatory, since the value of serum creatinine alone is not a reliable indicator of kidney function. The dosing of drugs eliminated mainly or solely by the kidneys can be adjusted by reducing the dose, prolonging the interval between doses, or combining both these methods.
Keywords:
pharmacotherapy – pharmacokinetics – renal function – chronic kidney disease – dialysis – glomerular filtration
Autoři:
O. Zakiyanov 1,2; J. Vachek 1,3; V. Tesař 1
Působiště autorů:
Klinika nefrologie VFN a 1. LF UK v Praze
1; Ústav lékařské biochemie a laboratorní diagnostiky VFN a 1. LF UK v Praze
2; Farmakologický ústav 1. LF UK v Praze
3
Vyšlo v časopise:
Kardiol Rev Int Med 2014, 16(1): 53-56
Kategorie:
Interní medicína
Souhrn
Chronické onemocnění ledvin patří k nejběžnějším klinickým problémům, často však poddiagnostikovaným. Snížení renální funkce vede k ovlivnění všech farmakokinetických vlastností léčiv, nemocní s chronickým onemocněním ledvin jsou proto ve zvýšené míře ohroženi nežádoucími účinky farmakoterapie – především předávkováním léky, které jsou primárně vylučovány ledvinami. Dalšími zásadními problémy u pacientů s onemocněním ledvin jsou polymorbidita a léková polypragmazie. Před nasazením každého nového léčiva je nutné především určit glomerulární filtraci, přičemž samotné stanovení hladiny sérového kreatininu není spolehlivým indikátorem očišťovací funkce ledvin. U léků eliminovaných převážně nebo výhradně ledvinami se dávkovací schéma upravuje snížením dávky léku, prodloužením intervalu mezi podáním jednotlivých dávek nebo kombinací obou metod.
Klíčová slova:
farmakoterapie – farmakokinetika – funkce ledvin – chronické onemocnění ledvin – hemodialýza – glomerulární filtrace
Úvod
Onemocnění ledvin patří k nejčastějším problémům v denní klinické praxi. U obecné populace je prevalence chronického onemocnění ledvin na 10 – 15 % [1,2], u preselektované populace hospitalizovaných pacientů je toto procento výrazně vyšší.
U pacientů s onemocněním ledvin je nutné před každým nasazením nového léčiva zohlednit renální funkci, jinak může dojít k předávkování a vzniku nežádoucího účinku. U léků eliminovaných převážně nebo výhradně ledvinami je třeba dávkování léčiva upravit – buď snížením dávky léku, prodloužením intervalu mezi podáním jednotlivých dávek nebo kombinací obou metod. Rovněž je zapotřebí vzít v úvahu, že některá léčiva jsou sice primárně metabolizována v játrech, jejich metabolity jsou však vylučovány ledvinami (např. morfin, pethidin, allopurinol nebo spironolakton). Zhoršená funkce ledvin může také ovlivňovat hepatální a intestinální first ‑ pass metabolizmus [3]. Např. při snížené biotransformační kapacitě jater dochází ke zvýšení aktivní formy léčiva v oběhu, a tím ke zvýšení jeho biologické dostupnosti. Při onemocnění ledvin či při lékové polypragmazii (oba stavy jsou přítomny velmi často souběžně) bývá ovlivněna i eliminace zprostředkovaná glykoproteinem P.
Dalším významným faktorem v rozhodování o úpravě dávkování je i terapeutické rozmezí léčiva. Beta‑laktamová antibiotika, jako např. penicilin, amoxicilin nebo cefuroxim, jsou bezpečná i při relativně vysokých plazmatických koncentracích, zatímco u aminoglykosidů či glykopeptidů je nutné udržovat plazmatickou hladinu v úzkém rozmezí. Na druhou stranu nesmí být obava z nežádoucích účinků léčiv důvodem k volbě bezpečnějších, avšak neúčinných léčiv v situaci, kdy užitek terapie převažuje nad riziky toxicity (např. podání aminopenicilinů v monoterapii u život ohrožující infekce), případně k jejich poddávkování (např. podávání nízkých dávek furosemidu v konečném stadiu selhání ledvin) [4].
Zvláštní pozornost vyžaduje volba a dávkování léčiv u nemocných s náhradou funkce ledvin, nejobtížnější je farmakoterapie u nemocných léčených kontinuálními očišťovacími metodami, především pak v případě antibiotik [5]. Významná je i problematika interakcí: zejména u transplantovaných pacientů je nutné každý nově nasazený lék posoudit z pohledu možného rizika interakce s imunosupresivy.
Farmakokinetické změny u pacientů s chronickým onemocněním ledvin
Při onemocnění ledvin jsou kromě eliminace léčiv ovlivněny i další farmakokinetické parametry – těmi rozumíme absorpci, distribuci do tělesných kompartmentů, metabolizmus léčiva a jeho exkreci. Výsledkem je akumulace vlastního léčiva nebo jeho aktivních metabolitů, odlišná distribuce léčiva nebo pokles v renálním metabolizmu [5].
Absorpce je u pacientů s onemocněním ledvin ovlivněna jednak lokálními faktory, jakými jsou např. otok sliznic při hyperhydrataci, změny pH, zpomalení peristaltiky při autonomní neuropatii, a jednak interakcí s jinými současně užitými léčivy. To si může vynutit alespoň přechodné podávání léčiv parenterálně, současně by měla vyvstat i otázka, zda je možné medikaci racionalizovat.
Distribuce může být změněna více faktory, nejvýznamnějším z nich je metabolická acidóza a snížená kapacita plazmatických bílkovin, na něž jsou navázány uremické toxiny, dále i změněná hemodynamika [5,6].
Eliminace léčiv je u pacientů s onemocněním ledvin ovlivněna mimořádně komplexním vlivem uremických toxinů na enzymatické systémy v játrech. Výsledkem může být akumulace metabolitů, které se na rozdíl od mateřské látky vylučují renálně. Příkladem může být již zmíněný farmakologicky aktivní metabolit pethidinu normeperidin, který se při onemocnění ledvin kumuluje a způsobuje křeče. Morfin‑6 - glukuronid, metabolit morfinu, může vést k útlumu dechového centra a hydroxymetabolity některých perorálních antidiabetik ze skupiny derivátů sulfonylurey mohou vést k těžkým protrahovaným hypoglykemiím. Kanreonát, metabolit spironolaktonu, je vylučován renálně a při snížené funkci ledvin působí hyperkalemii.
Exkrece je při onemocnění ledvin narušena snížením filtrace přes glomerulární membránu, tubulární reabsorpce a tubulární sekrece.
Algoritmus stanovení dávky léčiva při onemocnění ledvin
Před nasazením nového léčiva u nemocného s onemocněním ledvin je nejvhodnější dodržet následující schéma: 1. zjistit glomerulární filtraci, 2. ověřit způsob eliminace léčiva, 3. určit iniciální a udržovací dávku léčiva, 4. provést kontrolu plazmatické hladiny a případně na základě toho upravit dávkování. U léků eliminovaných převážně nebo výhradně ledvinami se dávkovací schéma upravuje snížením dávky léku, prodloužením intervalu mezi podáním jednotlivých dávek nebo kombinací obou metod [5,6].
Vyšetření glomerulární filtrace
V praxi se často odhaduje renální funkce pouze na základě znalosti hladiny sérového kreatininu, bez zohlednění hmotnosti, věku nebo pohlaví [7]. Tento údaj však postačuje jen pro hrubou orientaci. Například u zdravého muže věku 18 let s hmotností 70 kg a obvyklou výškou lze očekávat při hladině sérového kreatininu 100 µmol/ l normální glomerulární filtraci (okolo 100 ml/ min). Totožná hodnota u 70leté ženy s hmotností 50 kg svědčí pro již těžce sníženou glomerulární filtraci okolo 35 ml/ min [8,9]. Jako zlatý standard stanovení očišťovací schopnosti ledvin je dosud často uváděno vyšetření clearance kreatininu pomocí 24hodinového sběru moči. Od této metody se však postupně upouští, protože výsledek bývá zatížen chybou v preanalytické fázi – ať už na straně pacienta nebo ošetřujícího personálu – a dále nelze toto vyšetření užít, je‑li třeba výsledek znát ihned [8,9]. V současnosti se doporučuje odhad glomerulární filtrace (eGFR – estimated Glomerular Filtration Rate) s užitím některého ze vzorců, např. MDRD, CKD ‑ EPI nebo Lund ‑ Malmö, starší vzorec dle Cockrofta a Gaulta se dnes již nedoporučuje [6,8]. Jako nejvhodnější u pacientů s již předpokládaným snížením funkce ledvin se jeví vzorec Lund ‑ Malmö se zohledněním antropometrických parametrů pacienta, který je dostupný v několika jazycích např. na internetové adrese www.egfr.se [8,10]. Další on‑line nástroje jsou dostupné na adrese www.kidney.org/ professionals. Jinou možností je stanovení sérového cystatinu C, endogenního markeru glomerulární filtrace. Pro praxi je významné snížení odhadované glomerulární filtrace pod 60 ml/ min.
Zjištění způsobu eliminace léčiva
Údaje o eliminaci léčiv jsou k dispozici v Souhrnu údajů o přípravku (SPC). Měla by se kriticky zvážit nutnost podávání léčiv vylučovaných ledvinami a podle možnosti zvolit alternativa v podobě medikamentu eliminovaného extrarenálně nebo s možností zástupné eliminace, což však vždy není možné [5 – 7].
Výpočet iniciální a udržovací dávky
Nasycovací dávku obvykle není nutné snižovat, není‑li výrazněji snížen distribuční objem. Totéž platí pro jednorázovou aplikaci léčiv. Udržovací dávku lze upravit buď snížením dávky při zachovaném dávkovacím intervalu, nebo prodloužením intervalu mezi dvěma dávkami, případně lze oba způsoby kombinovat [5,6]. První varianta (snížení dávky) umožňuje dosažení stabilnější koncentrace léčiva, je však spojena s rizikem předávkování, pokud dávkovací interval neumožňuje dostatečnou eliminaci léčiva. Druhá varianta (prodloužení intervalu) je výhodná u preparátů s dlouhým poločasem eliminace, např. u některých antibiotik (chinolony, glykopeptidy, aminoglykosidy), u nichž je významný tzv. postantibiotický efekt. Je též bezpečnější z hlediska potenciální toxicity, ale zvláště v případě chronické medikace u ní existuje vyšší riziko poddávkování, a to zvláště ke konci dávkovacího intervalu, což je problematické např. u klasických antiepileptik, litia nebo digoxinu.
Údaje o dávkování léčiv při renální insuficienci jsou uvedeny v SPC – bohužel jsou často jen obecné. Jinou možností je vyhledávání v různých databázích a příručkách. Další možností je výpočet adjustované dávky (Dadj) nebo adjustovaného intervalu (Tadj) dle glomerulární filtrace, přičemž za normální hodnotu GFR se pro účely tohoto výpočtu považuje 100 ml/ min.
Dadj = (aktuální glomerulární filtrace × normální dávka) / normální glomerulární filtrace
Tadj = (normální glomerulární filtrace × normální interval) / aktuální glomerulární filtrace
Detailní výčet a demonstrace dalších metod užívaných k určení dávky léčiva u onemocnění ledvin přesahuje rozsah tohoto textu, zde odkazujeme na specializovanou literaturu [3,5 – 7] a v další stati uvádíme jen některé časté praktické problémy.
Posledním bodem je kontrola plazmatické hladiny a úprava dávkování léčiva (TDM – Therapeutic Drug Monitoring).
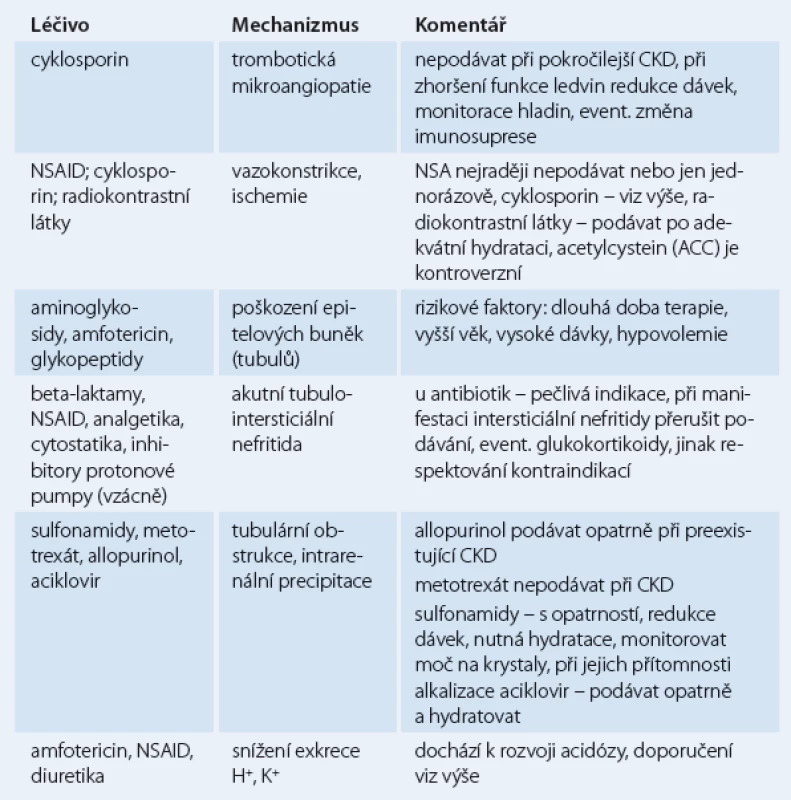
Mechanizmy nefrotoxicity některých léčiv
Mechanizmy nefrotoxicity některých léčiv uvádí tab. 1. Je patrné, že některá léčiva, např. cyklosporin, vedou k poškození ledvin více mechanizmy.
Některé praktické problémy ve volbě léčiv
Mezi léčiva vylučovaná ledvinami patří především antibiotika (většina beta‑laktamů, aminoglykosidy, glykopeptidy), virostatika (acyklovir, ganciklovir, další nukleosidová analoga), antimykotika (flukonazol, amfotericin) cytostatika (deriváty platiny, metotrexát), antikonvulziva (gabapentin, pregabalin, levetiracetam, vigabatrin), anodyna (morfin, pethidin), z dalších pak digoxin, litium, metformin a dabigatran.
Analgetika
Častým klinickým problémem je analgetická terapie u pacientů se sníženou funkcí ledvin. Riziková jsou nesteroidní antiflogistika, která mohou vlivem poklesu produkce prostaglandinů vést až k rozvoji hemodynamicky podmíněné akutní tubulointersticiální nekrózy. NSA by neměly být podávány u nikoho v riziku akutního poškození ledvin, hlavními rizikovými faktory jsou kromě CKD dehydratace, současná terapie diuretiky, ACE ‑ I či srdeční selhání. Pro novější inhibitory COX‑2 platí z hlediska renální hemodynamiky totéž. Při terapii morfinem, petidinem a codeinem dochází ke kumulaci renálně vylučovaných metabolitů a k riziku křečí a útlumu dechového centra. Naopak bezpečné jsou fentanyl, hydromorphon a buprenorfin, které se metabolizují v játrech.
Inhibitory angiotenzin konvertujícího enzymu (ACE ‑ I)
Po jejich nasazení dochází k přechodnému vzestupu renálních parametrů cca o 30 %, mechanizmem tohoto účinku je dilatace aferentní arterioly. V minulosti byly z tohoto důvodu uváděny jako kontraindikované při onemocnění ledvin. Jejich vysazení u onemocnění ledvin je však chybou, protože zpomalují proteinurii, a tím i progresi renální insuficience. Chronické onemocnění ledvin tedy není kontraindikací, ale naopak důležitou indikací ACE ‑ I. Především u pacientů v seniorském věku je třeba opatrnosti při kombinaci s diuretiky, vůbec nelze doporučit současné podávání NSA (nesteroidních antiflogistik) [11].
Antikoagulancia
Warfarin je metabolizován játry a jeho dávku není třeba při chronickém onemocnění upravovat. Preferovaným parenterálním antikoagulanciem u pacientů s chronickým onemocněním ledvin je dosud nefrakcionovaný heparin (UFH), který je však postupně vytlačován nízkomolekulárními hepariny (LMWH). Obecně platí, že profylaktické dávky enoxaparinu, dalteparinu a tinzaparinu není nutné redukovat. Při terapeutickém podávání je nutné dávky LMWH upravit. K dispozici je více dávkovacích schémat, nejvíce pro enoxaparin [12], naopak pro některá LMWH (dalteparin, tinzaparin) výrobce neuvádí žádné konkrétní doporučení. Pokud je to možné, měla by se kontrolovat hladina anti Xa. S novými perorálními antikoagulancii (NPA) je ještě méně zkušeností, do studií s nimi nebyli zahrnuti pacienti s významným snížením funkce ledvin, u nichž lze předpokládat riziko kumulace NPA a krvácení. Dabigatran je stejně jako aktivní metabolit eliminován z 80 % ledvinami, dávkování je proto nutné při renální insuficienci upravit, při GFR pod 30 ml/ min je podávání dabigatranu zcela kontraindikováno. Rivaroxaban je eliminován z 33 % renálně, nelze jej podávat při GFR pod 15 ml/ min. Apixaban je vylučován z 27 % ledvinami, z praktického hlediska pro něj platí přibližně totéž jako pro rivaroxaban [13].
Antibiotika
Stejně jako u pacientů s intaktní renální funkcí se řídí výběr antibiotika předpokládanou nebo zjištěnou citlivostí vůči infekčnímu agens. Při preskripci antibiotika je nutné mít na zřeteli jejich možné mechanizmy nefrotoxicity. K nejbezpečnějším antibiotikům se řadí cefalosporiny, není nutné obvykle vůbec nebo významně redukovat jejich dávkování stejně jako u jiných beta‑laktamů, tetracyklinů nebo linkosamidů. U septických pacientů v renálním selhání se užívají často aminoglykosidy a glykopeptidy, jejichž dávkování je nutno zásadně redukovat [14].
Farmakoterapie hemodialyzovaných pacientů
U dialyzovaných pacientů je nutné vzít v úvahu vliv očišťovací metody na kinetiku léčiv. Hemodialýzou se odstraňují především hydrofilní léčiva; lipofilní farmaka jsou navázaná na plazmatické bílkoviny a nemohou procházet dialyzační membránou. U některých léčiv by však samotné měření koncentrace farmaka v dialyzátu mohlo vést k podcenění efektu hemodialýzy na eliminaci léčiva, např. u meropenemu, který se váže na filtrační membránu.
Obecně platí, že u dialyzovatelných léků je třeba k dávce pro anurické pacienty (Danur) po očišťovací proceduře přidat doplňkovou dávku (Dsuppl).
Dhd (dávka v den hemodialýzy) = Danur + Dsuppl
U léčiv, která nejsou odstraňovaná hemodialýzou, po dialýze není nutné podávat doplňkovou dávku.
Tato problematika však svým rozsahem přesahuje záměr a rozsah tohoto textu. Vzhledem k zaměření tohoto sdělení odkazujeme při nejistotě na konzultaci s ošetřujícím nefrologem. Starší literární údaje nemusí být vždy zcela spolehlivé, protože především starší data byla získána před nástupem high‑flux dialyzačních membrán.
Závěr
U pacienta s CKD je nutné nejprve zjistit úroveň renální funkce. Je‑li léčivo, které zamýšlíme podávat, vylučováno převážně ledvinami a je‑li u něj současně riziko nefrotoxicity, je nutné jeho dávku redukovat – buď snížením dávky léku, prodloužením intervalu mezi podáním jednotlivých dávek, nebo kombinací obou metod. Zvýšenou pozornost je třeba věnovat některým problematickým léčivům, jejichž příklady jsou uvedeny v předkládaném textu.
Doručeno do redakce: 13.2.2014
Přijato po recenzi 17.2. 2014
MUDr. PhDr. Oskar Zakiyanov
www.vfn.cz
zoskar@post.cz
Zdroje
1. Coresh J, Selvin E, Stevens LA et al. Prevalence of chronic kidney disease in the United States. JAMA 2007; 298 : 2038 – 2047.
2. Kiberd B. The chronic kidney disease epidemic: stepping back and looking forward. J Am Soc Nephrol 2006; 17 : 2967 – 2973.
3. Stemer G, Lemmens ‑ Gruber R. Clinical pharmacy activities in chronic kidney disease and end‑stage renal disease patients: a systematic literature review. BMC Nephrol 2011; 12 : 35. doi: 10.1186/ 1471 - 2369 - 12 - 35.
4. Boyer A, Gruson D, Bouchet S et al. Aminoglycosides in septic shock: an overview, with specific consideration given to their nephrotoxic risk. Drug Saf 2013; 36 : 217 – 230. doi: 10.1007/ s40264 - 013 - 0031 - 0.
5. Kielstein JT, Burkhardt O. Dosing of antibiotics in critically ill patients undergoing renal replacement therapy. Curr Pharm Biotechnol 2011; 12 : 2015 – 2019.
6. Verbeeck RK, Musuamba FT. Pharmacokinetics and dosage adjustment in patients with renal dysfunction. Eur J Clin Pharmacol 2009; 65 : 757 – 773. doi: 10.1007/ s00228 - 009 - 0678 - 8.
7. Corsonello A, Onder G, Bustacchini S et al. Estimating renal function to reduce the risk of adverse drug reactions. Drug Saf 2012; 35 (Suppl 1): 47 – 54. doi: 10.1007/ BF03319102.
8. Björk J, Jones I, Nyman U et al. Validation of the Lund ‑ Malmö, Chronic Kidney Disease Epidemiology (CKD ‑ EPI) and Modification of Diet in Renal Disease (MDRD) equations to estimate glomerular filtration rate in a large Swedish clinical population. Scand J Urol Nephrol 2012; 46 : 212 – 222. doi: 10.3109/ 00365599.2011.644859.
9. Risch L, Hess B. Pitfalls bei Laborwerten – Elektrolyte, Harnstoff und Kreatinin. Ther Umsch 2013; 70 : 457 – 464. doi: 10.1024/ 0040 – 5930/ a000432.
10. Jabor A, Straka L, Franeková J. Několik poznámek k současnému pohledu na určování eGFR. FONS 2009; 19 : 27 – 28.
11. Thomas MC. Diuretics, ACE inhibitors and NSAIDs – the triple whammy. Medical J Aust 2000; 172 : 184 – 185.
12. Grand'Maison A, Charest AF, Geerts WH. Anticoagulant use in patients with chronic renal impairment. Am J Cardiovasc Drugs 2005; 5 : 291 – 305.
13. Hart RG, Eikelboom JW, Brimble KS et al. Stroke prevention in atrial fibrillation patients with chronic kidney disease. Can J Cardiol 2013; 29 (7 Suppl): S71 – S78. doi: 10.1016/ j.cjca.2013.04.005.
14. Farag A, Garg AX, Li L et al. Dosing Errors in Prescribed Antibiotics for Older Persons With CKD: A Retrospective Time Series Analysis. Am J Kidney Dis 2013. doi: 10.1053/ j.ajkd.2013.09.009.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2014 Číslo 1
-
Všechny články tohoto čísla
- Invazivní léčba karotických stenóz a možnosti její optimalizace transkraniální dopplerovskou ultrasonografií
- Trvalá kardiostimulace z pohledu nových evropských doporučení roku 2013
- Kardiohepatální syndrom u chronického srdečního selhání
- Prognostický význam elevace funkčních jaterních testů u akutních koronárních syndromů s manifestním srdečním selháním
- Vývoj renálních parametrů u pacientů s pokročilým srdečním selháním léčených levosimendanem – retrospektivní analýza
- Renální denervace – budoucnost nebo zklamání
- Hluboká žilní trombóza a plicní embolie při užívání hormonální antikoncepce
- Argumenty pro konzervativní léčbu chronické formy ischemické choroby srdeční přibývají
- Komplexní ošetřovatelská dokumentace při krátkodobé hospitalizaci pacientů indikovaných k trvalé kardiostimulaci
- XXVII. ročník „Šamánkových“ Poděbrad
- XVII. Kardiovaskulární dny v Lázních Teplice nad Bečvou
- Interní medicína
- Chronické onemocnění ledvin – novinky v klasifikaci a terapii
- Farmakoterapie při chronickém onemocnění ledvin
- Akutní poškození ledvin
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Vybrané choroby ledvin v těhotenství
- Infekce dolních a horních močových cest
- Editorial 2014
- Hluboká žilní trombóza a plicní embolie při užívání hormonální antikoncepce. Kardiol Rev Int Med 2014; 16(1): 36–38
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Akutní poškození ledvin
- Vybrané choroby ledvin v těhotenství
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Farmakoterapie při chronickém onemocnění ledvin
