Akutní poškození ledvin
Acute kidney injury
Acute kidney injury is generally defined as a condition characterised by the rapid loss of the kidney's excretory function with a decline of the glomerular filtration rate and is typically diagnosed by the accumulation of the end products of nitrogen metabolism or decreased urine output, or both. It is the clinical manifestation of a number of disorders that can affect the kidney acutely. Acute kidney injury is common in hospital patients and very common in critically ill patients, and is often secondary to extrarenal causes. New diagnostic techniques including renal biomarkers may help with early diagnosis. No specific therapies have emerged that can attenuate acute kidney injury or expedite recovery; thus, treatment is supportive. Patients are given renal replacement therapy if acute kidney injury is severe and biochemical or volume‑related, or if uraemic ‑ toxaemia‑related complications are of concern. Patients typically recover to dialysis independence. However, evidence suggests that patients who have had acute kidney injury are at increased risk of subsequent chronic kidney disease. In general, acute kidney injury is associated with serious and far ‑ reaching consequences not only for the patient (dialysis dependence, increased morbidity and mortality), but it also has significant economic implications for the health system.
Keywords:
acute kidney injury – creatinine – diuresis – haemodialysis – treatment
Autoři:
J. Vachek 1,2; O. Zakiyanov 1,3; Š. Bandúr 4; V. Tesař 1
Působiště autorů:
Klinika nefrologie VFN a 1. LF UK v Praze
1; Farmakologický ústav 1. LF UK v Praze
2; Ústav lékařské biochemie a laboratorní diagnostiky VFN a 1. LF UK v Praze
3; 1. Interní klinika FN Královské Vinohrady a 3. LF UK v Praze
4
Vyšlo v časopise:
Kardiol Rev Int Med 2014, 16(1): 57-61
Kategorie:
Interní medicína
Souhrn
Akutní poškození ledvin je obecně definováno jako náhlé zhoršení funkce ledvin podmíněné poklesem glomerulární filtrace a je diagnostikováno hromaděním konečných produktů metabolizmu dusíku, sníženým výdejem moči nebo obojím. Akutní poškození ledvin je důsledkem řady onemocnění, které mohou akutně poškodit funkce ledvin. Jde o častou komplikaci hospitalizace a je velmi časté i u kriticky nemocných pacientů jako důsledek jiných závažných onemocnění. S včasnou diagnózou mohou pomoci nové diagnostické možnosti včetně renálních biomarkerů. Žádná specifická terapie akutního poškození, která by zmírnila tíži poškození anebo urychlila reparaci funkce ledvin, dosud neexistuje. Léčba nadále zůstává symptomatická. K náhradě funkce ledvin pomocí dialýzy přistupujeme v případě těžkého renálního poškození spojeného s nárůstem cirkulujícího volumu, biochemickými změnami a uremickými komplikacemi. Obvykle dojde k reparaci renálních funkcí a pacient není závislý na dialyzační léčbě. Pacienti po prodělaném akutním poškození ledvin mají zvýšené riziko chronického onemocnění ledvin. Obecně je akutní poškození ledvin spojeno se závažnými a dalekosáhlými důsledky nejen pro nemocného (nutnost dialýzy, zvýšení morbidity a mortality), ale i s významnými ekonomickými dopady pro zdravotní systém.
Klíčová slova:
akutní poškození ledvin – kreatinin – diuréza – hemodialýza – terapie
Úvod
Akutní poškození ledvin (Acute Kidney Injury, AKI) je obecně definováno jako náhlé zhoršení funkce ledvin podmíněné poklesem glomerulární filtrace. Jde o častou komplikaci hospitalizace, která je spojena se závažnými a dalekosáhlými důsledky nejen pro nemocného (nutnost dialýzy a celkové zvýšení morbidity a mortality), ale i s významnými ekonomickými dopady pro zdravotnický systém. Termín AKI nahradil počátkem 21. století dříve používaný pojem „akutní selhání ledvin“ (Acute Renal Failure, ARF) [1]. Změnu názvosloví v roce 2007 iniciovala pracovní skupina AKIN (Acute Kidney Injury Network) sdružující nefrology, internisty, anesteziology a specialisty dalších odborností v reakci na skutečnost, že do té doby neexistovala přesná definice ani standardy pro léčbu nemocných s akutním poškozením ledvin [2]. Dalším důvodem byla absence epidemiologických dat o incidenci AKI lehčího stupně bez nutnosti dialýzy. V současnosti může být akutní poškození ledvin definováno čtyřmi klasifikačními schématy (KDIGO, AKIN, RIFLE a CK) [3 – 5], přičemž dle v klinické praxi nyní asi nejvíce používaných kritérií AKIN [2] se jím rozumí zhoršení renální funkce během 48 hodin spojené se vzestupem hladiny sérového kreatininu o 26,5 µmol/ l nebo o více než 50 % výchozích hodnot nebo s dokumentovaným poklesem diurézy pod 0,5 ml/ kg/ h po dobu více než šesti hodin. K určení tíže akutního poškození ledvin se užívá trojstupňová klasifikace AKIN, která rozlišuje lehké, středně těžké a těžké poškození (tab. 1). Při diskrepanci kritérií (např. normální diuréza a zvýšené azotemické parametry) je aplikováno to kritérium, které vede k vyšší klasifikaci.

Souběžně se lze setkat i s klasifikací RIFLE (tab. 2), pojmenované podle počátečních písmen různých stádií poškození ledvin (R – risk, I – injury, F – failure, L – loss, E – end stage) [5]. Stadium L (loss) označuje v této klasifikaci ztrátu ledvinné funkce trvající déle než čtyři týdny a stadium E (end stage) selhání ledvin trvající déle než tři měsíce.
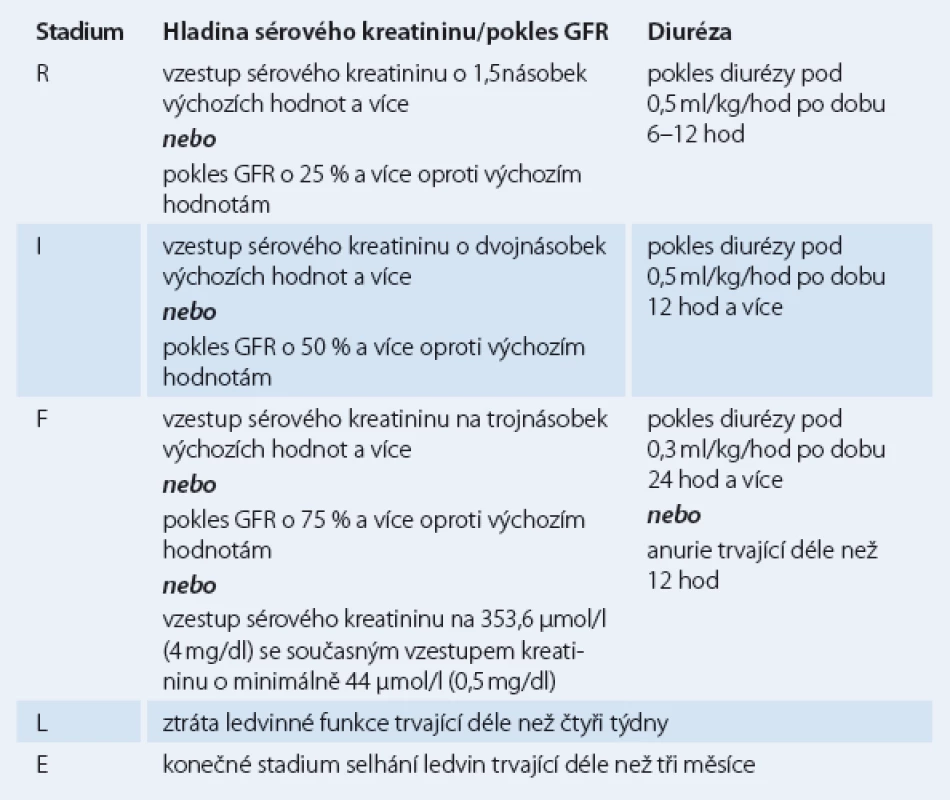
Lze se setkat s oběma klasifikacemi. Hodnocení tíže AKI dle stupnice RIFLE vyjadřuje zároveň stupeň i následky AKI, zatímco AKIN hodnotí jen stupeň poškození [6].
Z výše uvedeného vyplývá, že část případů AKI 1. i 2. stupně může proběhnout subklinicky a uniknout tak pozornosti. O epidemiologii AKI nevyžadujícího dialyzační léčbu proto není dostatek spolehlivých údajů. Podle aktuálních údajů z databáze USRDS (United States Renal Data System – 2013 Annual Data Report), kde byla analyzována data statisticky reprezentativní kohorty 5 % pacientů zdravotnického systému Medicare, byla v roce 2011 incidence AKI 2,67 %, tedy 32 211 pacientů s AKI na 1 207 737 pacientů. Z těchto 32 211 pacientů vyžadovalo 437, tedy 1,36 % dialyzační léčení [7]. Dále bylo prokázáno, že incidence AKI v poslední dekádě významně neroste, ale ani se podstatně nesnižuje, a že více ohroženi jsou pacienti vyšších věkových kategorií s preexistujícím renálním poškozením – chronickým onemocněním ledvin. Podle jiných statistik představují další rizikovou skupinu nemocní léčení na jednotkách intenzivní péče, u kterých je incidence AKI odhadována na 5 – 7 % [8]. Jde jak o pacienty, kteří jsou pro akutní poškození ledvin přijati, tak o ty, u nichž k němu dojde během pobytu na JIP (např. při sepsi či vlivem nefrotoxické léčby).
V minulosti bylo AKI považováno pro svou reverzibilitu za relativně benigní doprovodný jev provázející jiná těžší onemocnění a bylo spíše na okraji zájmu nefrologů vzhledem k výborné dostupnosti dialyzačních metod, jimiž se AKI dá překlenout. Dnes je však známo, že při AKI dochází k retenci nefrotoxinů a k zánětlivé reakci, která se dále šíří a zvýšením aktivity zánětlivých mediátorů negativně ovlivňuje funkci CNS, srdce, plic, některé metabolické děje a imunitní reakce. Byly prokázány i tzv. nonrenální „vzdálené“ efekty AKI jako např. zvýšená krvácivost, inzulinorezistence, snížená antioxidační kapacita či zvýšená permeabilita kapilár. Infekce u pacientů s AKI mají těžší průběh než u nemocných s intaktní renální funkcí, což je zřejmě vysvětlením, proč představuje sepse jednu z hlavních příčin úmrtí pacientů s AKI [9,10]. Z těchto důvodů je nyní AKI předmětem intenzivního mezioborového výzkumu.
AKI lze didakticky rozdělit podle etiologie a patogeneze na prerenální, intrarenální a postrenální poškození. Při prerenální lézi, která je nejčastější (60 % případů), jsou původně intaktní ledvinné tubuly a glomeruly poškozeny hypoperfuzí ledvin. Ta nevzniká jen prostým snížením přítoku krve do dřeně ledvin, ale i dalšími mechanizmy jako např. vznikem funkčních zkratů mezi paralelně probíhajícími, arteriálními a venózními vasa recta tvořícími tzv. protiproudový systém, čímž se stává arteriální krev přivádějící krev do ledvin relativně chudou na kyslík. Příčinou prerenálního AKI je nejčastěji prostá dehydratace (např. při zvracení, průjmech), dále hypovolemie z jiných příčin (šokové stavy obecně s hypotenzí při krvácení, operačních zákrocích, popáleninách), systémová vazodilatace při sepsi nebo hepatorenálním syndromu. Ledviny reagují na pokles efektivního cirkulujícího volumu aktivací osy renin‑angiotenzin‑aldosteron, současně vyplavením katecholaminů a vazopresinu s následným poklesem natriurézy, snížením objemu moči a zvýšením její osmolality. Substancí ovlivňujících mikrocirkulaci v ledvinách je však více (např. atriální natriuretický faktor, mozkový natriuretický faktor, dopamin, endotelin, oxid dusný, prostaglandiny PgI2, PgE2, cytokiny atd.). U prerenálního poškození ledvin jsou obvykle přítomny klinické známky dehydratace. Nemocní s nefrotickým syndromem a jaterním a srdečním selháním, u nichž došlo k prerenálnímu poškození ledvin, jsou však i přes klinický obraz převodnění ve skutečnosti intravaskulárně dehydratováni a podávání diuretik u nich vede jen k prohloubení prerenálního poškození a posléze rozvoji intrarenálního selhání ledvin. Intrarenální typ akutního poškození ledvin (30 – 35 % případů) vzniká z nejrůznějších příčin, jež lze rozdělit do čtyř základních okruhů:
- akutní tubulární nekróza (ischemie – protrahované prerenální AKI, léková toxicita, kontrastem indukovaná neuropatie, hemolýza, myoglobinurie při rabdmyolýze – léky (statiny) či traumatem indukované, urátová nefropatie, „cast nephropathy“ u monoklonálních gamapatií, oxalátová nefropatie a další),
- makrovaskulární onemocnění (vaskulitida, ateroembolie, tromboembolie),
- poruchy mikrocirkulace (rychle progredující glomerulonefritidy, akutní glomerulonefritida, IgA nefropatie, hemolyticko‑uremický syndrom),
- akutní tubulointersticiální nefritida (nejčastěji poléková).
Postrenální poškození ledvin je nejméně časté (5 – 10 % případů) a vzniká následkem expanzivních procesů v pánvi (gynekologické nádory), vlivem komplikací po operacích, při nefrolitiáze či vrozených anomáliích horních a dolních močových cest, při subvezikální obstrukci zvětšenou prostatou (benigní i maligní etiologie) nebo při zvýšeném nitrobřišním tlaku atd.
Všechny typy lézí se však mohou vzájemně kombinovat nebo se i vyskytovat společně. Např. při syndromu zvýšeného nitrobřišního tlaku (intraabdominal pressure), který se často vyskytuje u kriticky nemocných, dochází k poškození ledvin jednak venostázou krve v ledvinách mechanizmem kongesce v renálních žilách, útlakem kortexu ledvin a současně zvýšeným tlakem na uretery [10].
Obtížné je často odlišení AKI od chronického renálního onemocnění (CKD) dle definice K/ DOQI procesu trvajícího déle než tři měsíce [11]. Pro chronické onemocnění ledvin může svědčit přítomnost nemoci ledvin v osobní i rodinné anamnéze, případně přítomnost dalších chronických onemocnění (arteriální hypertenze, diabetes mellitus, klinická manifestace aterosklerózy – např. ICHS, ICHDK apod., abúzus rizikových léčiv), nález normocytární normochromní anemie, sonografických známek poškození struktury ledvin, případně dalších laboratorních a klinických nálezů indikativních pro CKD (hyperfosfatemie, hypokalcemie, hyperparatyreoidizmus, uremický syndrom). Někdy se však tyto stavy odlišit nepodaří, zvláště pokud k akutnímu poškození ledvin došlo v terénu CKD, a k objasnění pomůže až další vývoj nemoci [12].
Na tomto místě je potřeba také zmínit i AKI při nefropatii indukované kontrastní látkou. Nefropatie indukovaná kontrastní látkou (CIN – Contrast ‑ Induced Nephropathy) je definována jako akutní zhoršení ledvin po podání kontrastní látky při vyloučení jiné příčiny tohoto stavu. V riziku CIN jsou pacienti s CKD, míru rizika pak ovlivňují další faktory jako stav hydratace, věk, užívání nefrotoxických léků (ACE ‑ I, NSA), diabetes mellitus s obezitou a přítomnost srdečního selhání. Ačkoli se CIN obecně omezuje na přechodné snížení funkce ledvin, nejedná se o benigní komplikaci. Určitý stupeň zbytkového poškození ledvin byl zaznamenán u 30 % osob postižených CIN [13]. Ve většině klinických studii je CIN definována jako relativní vzestup sérového kreatininu o 25 % nebo jako její absolutní vzestup o 44 µmol/ l oproti výchozí hodnotě do 2 – 7 dnů po expozici kontrastní látky. V jedné studii z celkového počtu 1 826 pacientů, kteří podstoupili perkutánní koronární intervenci, byla dialýza zahájena u 0,8 %. Selhání ledvin vyžadující trvalou dialyzační léčbu přetrvávala u 13 % těchto pacientů [14]. Pokud je nutné pacientovi s chronickým onemocněním ledvin podat kontrastní látku, např. při vyšetření výpočetní tomografií (CT) nebo při angiografii, je nutné ke snížení rizika CIN provést následující opatření:
- informovat rentgenologické pracoviště o aktuálním stavu renálních funkcí nemocného,
- 24 hod před výkonem vysadit riziková léčiva (ACE ‑ I, NSA, diuretika, metformin),
- před výkonem zajistit vydatnou hydrataci parenterálně s přihlédnutím k srdeční funkci nemocného,
- tradičně se doporučuje acetylcystein (p.o. nebo i.v., v případě nemožnosti p.o. podání), který snižuje hladinu sérového kreatininu i u zdravých osob, poslední výzkumy efekt tohoto postupu zpochybňují [15], na druhou stranu jde o bezrizikový postup,
- při samotném vyšetření je nutné preferovat nízkoosmolární či izoosmolární látky před vysoce hyperosmolárními látkami (ionickými monomery) 1. generace [16], po vyšetření je nutná kontrola diurézy a sérového kreatininu 48 a 72 hod po aplikaci látky,
- u pacientů již zařazených do hemodialyzačního programu není nutné provádět po vyšetření dialýzu k odstranění kontrastní látky, u pacientů v predialýze je vhodné dialýzu provést k prevenci poškození reziduální funkce ledvin [17].
Klinický obraz AKI je nespecifický, přičemž zpravidla dominuje symptomatologie základního onemocnění. Nejdůležitější je myslet na možnost vzniku akutního poškození ledvin (to bylo i motto Světového dne ledvin 14. 3. 2013), a tak mu předcházet – především identifikací rizikových pacientů a cílenými preventivními opatřeními. Jako příklad lze uvést profylaktickou hydrataci nemocných, kteří mají podstoupit vyšetření s podáním rentgen kontrastní látkou. Nepřítomnost oligurie neznamená, že nemohlo dojít k akutnímu poškození ledvin. U nemocných v riziku AKI je nutná denní kontrola parametrů renální funkce i iontogramu. Časově totiž probíhá akutní poškození ledvin ve třech fázích: 1. iniciální fáze je asymptomatická nebo se projevuje jen příznaky základního onemocnění, které vedlo k poškození ledvin (např. dehydratace při gastroenteritidě). Pokud nedojde k intervenci – např. substituci tekutin nebo ke spontánní úpravě – nastupuje 2. fáze – fáze manifestního poškození, která může probíhat oligoanuricky (horší prognóza) nebo neoliguricky (lepší prognóza). V této fázi je nemocný ohrožen hyperhydratací (riziko levostranného srdečního selhání, plicního edému, edému mozku) a minerálovými poruchami (hyperkalemie, metabolická acidóza) a uremií. Pokud se funkce ledvin obnoví (spontánně nebo vlivem léčby), rozvine se 3. fáze – polyurická fáze, během níž je třeba nemocného monitorovat pro možnost excesívních ztrát tekutin a minerálů (sodíku, draslíku).
Při vyšetřování nemocného s akutním poškozením ledvin nebo podezřením na ně zůstává základem anamnéza (ztráty tekutin, urologická onemocnění, předcházející infekty, pečlivá léková anamnéza se zaměřením na tzv. trio infernal – ACE inhibitory, diuretika, nesteroidní antiflogistika, nedávné operace). Samozřejmostí je základní vyšetření biochemické, hematologické, nesmí být opomenuto vyšetření moči (biochemicky a sedimentu). Základními parametry zůstávají i v současnosti krevní ionty, urea a kreatinin, a to i přesto, že probíhá intenzivní výzkum nových biomarkerů renálního poškození [18]. Přítomnost tzv. smíšeného močového syndromu (mikroskopická hematurie s proteinurií, případně válců) musí vzbudit podezření na rychle progredující glomerulonefritidu (RPGN), jeden z nejzávažnějších akutních stavů v nefrologii, který představuje absolutní indikaci k renální biopsii. Zejména při tomto tzv. aktivním močovém nálezu a zvláště při doprovodné plicní symptomatologii (hemoptýza, nejasný plicní infiltrát na rentgenovém snímku) zvažujeme systémovou vaskulitidu (ANCA asociovanou vaskulitidu) nebo Goodpastureovu nemoc a vyšetřujeme ve statimovém režimu protilátky ANCA (protilátky proti cytoplazmě neutrofilních granulocytů) a anti‑GBM (protilátky proti glomerulární bazální membráně). K rutinnímu laboratornímu vyšetření pacienta s nejasným akutním poškozením ledvin by mělo patřit i stanovení LDH (laktátdehydrogenáza), jejíž zvýšení může svědčit pro hemolyticko‑uremický syndrom (HUS), který lze náležitou léčbou (čerstvě zmražená plazma, plazmaferéza) v iniciální fázi zvrátit, a umožnit tak reparaci renální funkce.
Rozlišení prerenálního a intrarenálního AKI nemusí být vždy snadné, oba druhy postižení se mohou vyskytovat i společně, resp. mohou v sebe přecházet. V diferenciální diagnostice může posloužit vyšetření frakční exkrece sodíku (FENa), které vychází z předpokladu, že při prerenální lézi došlo ke snížení glomerulární filtrace, ale funkce tubulů je zachována. V tomto případě je moč koncentrovaná a obsahuje nižší množství sodíku. Naopak v případě akutní tubulární nekrózy s porušením zpětné resorpce vody a sodíku je moč zředěná a obsahuje větší množství nevstřebaného sodíku. K výpočtu lze použít následující vzorec:
FENa = (U ‑ Na × S ‑ kreatinin) / (S ‑ Na × U ‑ kreatinin) × 100.
Hodnota nad 1 svědčí pro prerenální etiologii, pod 1 pro intrarenální AKI.
Ze zobrazovacích metod užíváme především ultrazvukové vyšetření ledvin a močových cest, které je dostupné prakticky kdykoli a kdekoli i ve statimovém režimu. Nález zvětšených ledvin svědčí spíše pro akutní poškození ledvin, svraštělé a zmenšené ledviny vídáme při chronickém onemocnění ledvin s výjimkou iniciálních stadií diabetické nefropatie. Pomocí ultrazvukového vyšetření zjistíme případné známky městnání moči (dilatované pánvičky, naplněný močový měchýř). Podání kontrastní látky při CT vyšetření je spojeno s rizikem dalšího poškození ledvin, proto jej indikujeme velmi uvážlivě. Renální biopsii provádíme zejména při podezření na RPGN. Zde je třeba zdůraznit, že vzhledem k relativní vzácnosti těchto stavů je vhodné pacienta přeložit na specializované pracoviště s dostupností příslušných vyšetřovacích metod, včetně dostupnosti specializovaného nefropatologa se zkušeností s diagnostikou a léčbou těchto stavů včetně zvládání komplikací.
Terapie AKI se řídí podle etiologie základního onemocnění, jde například o léčbu šoku, substituce krevními deriváty při akutní posthemoragické anemii, vysazení nefrotoxických léčiv, zajištění derivace moči apod. Pokud je nevyhnutelné podávat nefrotoxická léčiva (např. aminoglykosidová antibiotika), monitorujeme jejich hladiny.
Ve většině případů se podaří AKI zvládnout adekvátní náhradou tekutin, upřednostňujeme krystaloidy. Místo fyziologického roztoku, který obsahuje vysoké množství chloridů s toxickým vlivem na funkci ledvin, užíváme raději tzv. balancované roztoky (např. Ringer laktát nebo Plasmalyte). Hydroxyetylškroby (HAES) se již podle doporučení výboru EMA nemají používat kvůli zjištění, že pacienti s těžkou sepsí léčení HAES byli vystaveni většímu riziku poškození ledvin vyžadujícího dialýzu. Tekutiny doplňujeme za monitorace diurézy, extrarenálních ztrát a centrálního žilního tlaku, dále sledujeme v pravidelných intervalech (1 – 2× denně) mineralogram. Energetický příjem pacienta by se měl pohybovat mezi 20 – 30 kcal/ kg/ den, doporučené cílové hodnoty glykemie se pohybují v rozmezí 6,1 – 8,3 mmol/ l. Vzhledem k bezproblémové dostupnosti dialýzy v našich podmínkách neomezujeme příjem bílkovin pacienta, abychom tím hypoteticky oddálili potřebu dialýzy. Pro pacienta je výhodnější enterální výživa, parenterální výživu indikujeme při nemožnosti enterální nutrice. Dříve paušálně podávaný furosemid indikujeme jen v případě přítomnosti hypervolemie a pozitivní tekutinové bilance, spíše však v těchto případech zvažujeme dialýzu. Podávání tzv. renálních dávek dopaminu s představou zlepšení perfuze ledvin je nepodložené [19].
Několik pokusů farmakologicky ovlivnit předpokládané mechanizmy uplatňující se v CIN přineslo nedostatečné nebo žádné konkrétní výsledky. Použití acetylcysteinu je od jeho zavedení v prevenci CIN zdrojem sporů. Nedávné zjištění [20] platnost studií hodnotících ochranný účinek acetylcysteinu pomocí sérového kreatininu zpochybňuje. Studie hodnotící potenciální ochranné účinky teofylinu a aminofylinu bohužel přinesly podobně rozporuplné výsledky jako studie s acetlycysteinem. Teofylin může být vhodným kandidátem pro prevenci CIN u pacientů přijatých na jednotku intenzivní péče (JIP). V jedné studii bylo u pacientů na JIP, kteří byli hydratováni podle klinických a paraklinických pozorování, profylaktické podávání infuze s 200 mg teofylinu 30 minut před vyšetřením účinnější než podání acetylsysteinu [21]. Toto schema je mimořádně vhodné pro pacienty na JIP podstupující neodkladné výkony. Je nutné však mít na zřeteli i možnost, že podávání profylaxe teofylinem u pacientů podstupujících koronarografii není vždy výhodné, protože může u pacientů s koronární ischemií vyvolat arytmie.
Obecně pro prevenci CIN lze doporučit vysazení nesteroidních antiflogistik a diuretik 24 hodin před vyšetřením a jejich podávání lze obnovit 24 hodin po výkonu. Metformin je třeba vysadit ráno před vyšetřením a v případě, že nedošlo k rozvoji CIN, lze jeho podání obnovit. Hydratační protokol je povinný u všech pacientů s rizikem. Všechny pacienty podstupující kontrastní vyšetření je třeba poučit, aby před vyšetřením vypili nejméně 500 ml vody a během 24 hodin po vyšetření 2 500 ml [22]. Při intravenózní hydrataci se doporučuje aplikace fyziologického roztoku rychlostí 1 ml/ kg tělesné hmotnosti za hod (maximálně 100 ml/ h). Podávání se zahájí 4 hod před aplikací kontrastní látky a pokračuje se v něm 24 hodin po vyšetření. U rizikových pacientů je intravenózní hydratace pomocí fyziologického roztoku v průběhu 24 hodin, která se zahájí 12 hodin před vyšetřením nebo ráno před vyšetřením rychlostí 1 ml/ kg tělesné hmotnosti za hodinu. Radiolog musí omezit množství kontrastní látky na minimum a použit nízkoosmolární nebo izoosmolární látku. Obhájit lze také podání 1 200 mg acetylcysteinu dvakrát denně v den vyšetření a den před vyšetřením, ačkoli na tuto alternativu není jednotný názor. U akutního výkonu lze první perorální dávku nahradit intravenózním bolusem 1 200 mg acetylcysteinu. Někdy je zapotřebí vypracovat individuální schéma hydratace a nalézt rovnováhu mezi ochranou funkce ledvin a zabráněním převodnění. U pacientů, kteří nemohou podstoupit odpovídající hydrataci a/ nebo kteří jsou přijati na JIP, lze obhájit i podání 200 mg teofylinu 30 minut před vyšetřením. V prevenci CIN byl studován i trimetazidin, v jedné menší studii [23] signifikantně snižoval riziko CIN v kombinaci s hydratací ve srovnání s pacienty, jimž byl podáván samotný krystaloid.
Epizoda AKI i nutnost dialýzy představuje nezávislý rizikový faktor rozvoje chronického onemocnění ledvin i celkové morbidity a mortality pacientů [24]. Indikace náhrady funkce ledvin (RRT) jsou podobné jako u terminálního stadia CKD. Dialýza je indikována při anurii, hyperkalemii > 6,5 mmol/ l, těžké, jinak nezvládnutelné metabolické acidóze, hyperhydratatci s plicním edémem, symptomech uremie (perikarditida, neurologická či gastrointestinální symptomatologie). V principu lze užít dvě základní modality: intermitentní hemodialýzu (IHD) a kontinuální náhradu funkce ledvin (CRRT) [25]. Detailní rozbor strategie dialyzační léčby přesahuje rozsah tohoto sdělení, obecně však lze říci, že IHD volíme u hemodynamicky stabilizovaných pacientů a u těch, kde je zapotřebí rychle korigovat minerálovou poruchu (hyperkalemii, hyperkalcemii). CRRT užíváme u hemodynamicky nestabilních pacientů, např. v šokovém stavu, při srdečním selhání, u kterých by mohl být výhodný i předpokládaný imunomodulační efekt procedury (odstranění mediátorů zánětu). Nevýhodou CRRT je značná finanční a ošetřovatelská náročnost, dále pak horší dostupnost – zdravotnická zařízení vyššího typu – je k ní třeba též vyšší zkušenost personálu. Užití peritoneální dialýzy v léčbě akutního selhání ledvin je ve vyspělých zemích raritou, s výjimkou dětí a pacientů bez možnosti založení cévního přístupu [26].
Prognóza AKI závisí na zvládnutí základní příčiny onemocnění, z výše uvedeného přehledu je však zřejmé, že se vždy jedná o závažnou a potenciálně i život ohrožující komplikaci. I přes značné pokroky ve znalostech patogeneze AKI jsou naše současné terapeutické možnosti poněkud omezené. Pacienti, kteří prodělali akutní poškození ledvin, by měli být sledováni nefrologem mimo jiné proto, že jsou tito pacienti ohroženi rozvojem CKD [24,27], resp. až desetinásobně vyšším rizikem rozvoje terminální fáze CKD – renálního selhání [7,24].
Doručeno do redakce: 25. 1. 2014
Přijato po recenzi 10. 2. 2014
MU Dr. PhDr. Oskar Zakiyanov
www.vfn.cz
zoskar@post.cz
Zdroje
1. Lameire N, Van Biesen W, Vanholder R. Acute renal failure. Lancet 2005; 365 : 417–430.
2. Mehta RL, Kellum JA, Shah SV et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; 11: R31.
3. Bellomo R, Ronco C, Kellum JA et al. Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care 2004; 8: R204–R212.
4. Kellum JA, Bellomo R, Ronco C et al. The 3rd International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI). Int J Artif Organs 2005; 28 : 441–444.
5. Uchino S, Bellomo R, Goldsmith D et al. An assessment of the RIFLE criteria for acute renal failure in hospitalized patients. Crit Care Med 2006; 34 : 1913–1917.
6. Ricci Z, Cruz DN, Ronco C. Classification and staging of acute kidney injury: beyond the RIFLE and AKIN criteria. Nat Rev Nephrol 2011; 7 : 201–208. doi: 10.1038/nrneph.2011.14.
7. Collins AJ, Foley RN, Chavers B et al. US Renal Data System 2013 Annual Data Report. Am J Kidney Dis 2014; 63 (1 Suppl): A7. doi: 10.1053/j.ajkd.2013.11.001.
8. Hsu CY, McCulloch CE, Fan D et al. Community-based incidence of acute renal failure. Kidney Int 2007; 72 : 208–212.
9. Hsu CY, Chertow GM, McCulloch CE et al. Nonrecovery of kidney function and death after acute on chronic renal failure. Clin J Am Soc Nephrol 2009; 4 : 891–898.
10. Hegarty J, Middleton RJ, Krebs M et al. Severe acute renal failure in adults: place of care, incidence and outcomes. QJM 2005; 98 : 661–666.
11. Levey AS, Eckardt KU, Tsukamoto Y et al. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2005; 67 : 2089–2100.
12. Prescott AM, Lewington A, O'Donoghue D. Acute kidney injury: top ten tips. Clin Med 2012; 12 : 328–332.
13. Madyoon H, Croushore L, Weaver D et al. Use of fenoldopam to prevent radiocontrast nephropathy in high-risk patients. Catheter Cardiovasc Interv 2001; 53 : 341–345.
14. McCullough PA, Wolyn R, Rocher LL et al. Acute renal failure after coronary intervention: incidence, risk factors, and relationship to mortality. Am J Med 1997; 103 : 368–375.
15. Solomon RJ. Antioxidant therapy with N-acetylcysteine for contrast-induced acute kidney injury: a final nail in the coffin? Coron Artery Dis 2014; 25 : 94–95.
16. Moore RD, Steinberg EP, Powe NR et al. Nephrotoxicity of high-osmolality versus low-osmolality contrast media: randomized clinical trial. Radiology 1992; 182 : 649–655.
17. Pannu N, Wiebe N, Tonelli M. Prophylaxis strategies for contrast-induced nephropathy. JAMA 2006; 295 : 2765–2779.
18. Zakiyanov O, Kriha V, Vachek J et al. Placental growth factor, pregnancy-associated plasma protein-A, soluble receptor for advanced glycation end products, extracellular newly identified receptor for receptor for advanced glycation end products binding protein and high mobility group box 1 levels in patients with acute kidney injury: a cross sectional study. BMC Nephrol 2013; 14 : 245.
19. Druml W. Acute renal failure is not a "cute" renal failure! Intensive Care Med 2004; 30 : 1886–1890.
20. Hoffmann U, Fischereder M, Krüger B et al. The value of N-acetylcysteine in the prevention of radiocontrast agent-induced nephropathy seems questionable. J Am Soc Nephrol 2004; 15 : 407–410.
21. Huber W, Eckel F, Hennig M et al. Prophylaxis of contrast material-induced nephropathy in patients in intensive care: acetylcysteine, theophylline, or both? A randomized study. Radiology 2006; 239 : 793–804.
22. Stacul F, van der Molen AJ, Reimer P et al. Contrast induced nephropathy: updated ESUR Contrast Media Safety Committee guidelines. Eur Radiol 2011; 21 : 2527–2541. doi: 10.1007/s00330-011-2225-0.
23. Rahman MM, Haque SS, Rokeya B et al. Trimetazidine in the prevention of contrast induced nephropathy after coronary angiogram. Mymensingh Med J 2012; 21 : 292–299.
24. Goldstein SL, Chawla L, Ronco C et al. Renal recovery. Crit Care 2014; 18 : 301.
25. Palevsky PM, Zhang JH, O'Connor TZ et al. Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med 2008; 359 : 7–20. doi: 10.1056/NEJMoa0802639.
26. Bellomo R, Cass A, Cole L et al. Intensity of continuous renal-replacement therapy in critically ill patients. N Engl J Med 2009; 361 : 1627–1638. doi: 10.1056/NEJMoa0902413.
27. Thakar CV, Christianson A, Himmelfarb J et al. Acute kidney injury episodes and chronic kidney disease risk in diabetes mellitus. Clin J Am Soc Nephrol 2011; 6 : 2567–2572.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2014 Číslo 1
-
Všechny články tohoto čísla
- Invazivní léčba karotických stenóz a možnosti její optimalizace transkraniální dopplerovskou ultrasonografií
- Trvalá kardiostimulace z pohledu nových evropských doporučení roku 2013
- Kardiohepatální syndrom u chronického srdečního selhání
- Prognostický význam elevace funkčních jaterních testů u akutních koronárních syndromů s manifestním srdečním selháním
- Vývoj renálních parametrů u pacientů s pokročilým srdečním selháním léčených levosimendanem – retrospektivní analýza
- Renální denervace – budoucnost nebo zklamání
- Hluboká žilní trombóza a plicní embolie při užívání hormonální antikoncepce
- Argumenty pro konzervativní léčbu chronické formy ischemické choroby srdeční přibývají
- Komplexní ošetřovatelská dokumentace při krátkodobé hospitalizaci pacientů indikovaných k trvalé kardiostimulaci
- XXVII. ročník „Šamánkových“ Poděbrad
- XVII. Kardiovaskulární dny v Lázních Teplice nad Bečvou
- Interní medicína
- Chronické onemocnění ledvin – novinky v klasifikaci a terapii
- Farmakoterapie při chronickém onemocnění ledvin
- Akutní poškození ledvin
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Vybrané choroby ledvin v těhotenství
- Infekce dolních a horních močových cest
- Editorial 2014
- Hluboká žilní trombóza a plicní embolie při užívání hormonální antikoncepce. Kardiol Rev Int Med 2014; 16(1): 36–38
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Akutní poškození ledvin
- Vybrané choroby ledvin v těhotenství
- Rychle progredující glomerulonefritidy (srpkovité glomerulonefritidy)
- Farmakoterapie při chronickém onemocnění ledvin
