Ivabradin v léčbě ischemické choroby srdeční – výsledky klinické studie BEAUTIFUL
Ivabradine in the treatment of ischemic heart disease – results of the BEAUTIFUL study
The aim of the BEAUTIFUL clinical trail was to evaluate whether lowering of the heart rate (HR) with the specific sinoatrial node If channels inhibitor ivabradine in patients with stabilized ischemic heart disease (IHD) and left ventricular systolic dysfunction leads to a reduction in cardiovascular mortality and morbidity. The study placebo arm served for testing the hypothesis that elevated resting HR is a marker of subsequent cardiovascular mortality and morbidity. The study involved 10 970 patients with documented IHD and left ventricular ejection fraction of < 0.40, who were randomized to take either ivabradine or placebo. The primary clinical endpoint was the sum of cardiovascular deaths, hospitalisations due to myocardial infarction and hospitalizations due to cardiac failure. The patients were followed up for a median of 19 months. The mean basal HR of the patients entering the study was 71.6/ min. Patients in the placebo arm with resting HR ≥ 70/ min had, in comparison to those with resting HR < 70/ min, higher risk of cardiovascular death (by 34%; p=0.0041), hospitalizations due to cardiac failure (by 53%; p < 0.001), hospitalizations due to myocardial infarction (by 46 %; p = 0.0066) and coronary revascularization (by 38%; p = 0.037). Administration of ivabradine did not affect the incidence of the composite clinical endpoint (HR = 1.0; n.s.). Treatment with ivabradine in a pre‑defined subgroup of patients with basal resting HR ≥ 70/ min significantly reduced the number of post myocardial infarction hospitalizations (HR = 0.94; p = 0.001) and the need for coronary revascularization (HR = 0.70; p = 0.016). Post hoc analysis published a year later showed that ivabradine significantly reduced incidence of primary clinical endpoint by 24% and the number of hospitalizations for myocardial infarction by 42% in patients who suffered from limiting angina at baseline. The majority of patients included in the study (87%) took beta‑blockers. Administration of ivabradine was safe and well tolerated. HR reduction with ivabradine in patients with IHD and left ventricular systolic dysfunction did not reduce the risk of cardiovascular events. Elevated resting HR (≥ 70/ min) identifies the patients with significantly increased risk of cardiovascular events. Reduction of HR with ivabradine in these patients had a positive effect on patient prognosis. Ivabradine also reduced the incidence of cardiovascular events in patients suffering from limiting angina at baseline. The results suggested that the positive effects of ivabradine are multiplied in patient with higher HR and co ‑ morbid angina.
Key words:
angina pectoris – ivabradine – BEAUTIFUL clinical trial – heart rate reduction – cardiovascular mortality – cardiovascular morbidity
Autoři:
J. Hradec
Působiště autorů:
III. interní klinika 1. lékařské fakulty UK a VFN, Praha
Vyšlo v časopise:
Kardiol Rev Int Med 2010, 12(1): 33-37
Souhrn
Klinická studie BEAUTIFUL ověřovala, zda zpomalení srdeční frekvence (SF) specifickým inhibitorem kanálů If v sinoatriálním uzlu ivabradinem bude mít u nemocných se stabilizovanou ischemickou chorobou srdeční (ICHS) a systolickou dysfunkcí levé srdeční komory za následek snížení kardiovaskulární mortality a morbidity. V placebové větvi studie byla také testována hypotéza, že zvýšená klidová SF je markerem následné kardiovaskulární mortality a morbidity. Do studie bylo zařazeno celkem 10 917 nemocných s dokumentovanou ICHS a ejekční frakcí levé komory < 0,40, kteří byli randomizováni k užívání ivabradinu nebo placeba. Primárním sledovaným klinickým ukazatelem byl součet kardiovaskulárních úmrtí, hospitalizací pro infarkt myokardu a hospitalizací pro srdeční selhání. Průměrná doba sledování nemocných ve studii byla 19 měsíců. Průměrná bazální SF nemocných při vstupu do studie byla 71,6/ min. Nemocní v placebové větvi, kteří měli klidovou SF ≥ 70/ min, ve srovnání s těmi, jež měli bazální klidovou SF < 70/ min, měli vyšší riziko úmrtí z kardiovaskulárních příčin (o 34 %; p = 0,0041), hospitalizací pro srdeční selhání (o 53 %; p < 0,001), hospitalizací pro infarkt myokardu (o 46 %; p = 0,0066) a koronární revaskularizace (o 38 %; p = 0,037). Podávání ivabradinu neovlivnilo výskyt kombinovaného klinického ukazatele (HR = 1,0; n.s.). V předem specifikované podskupině nemocných s bazální klidovou SF ≥ 70/ min léčba ivabradinem významně snížila počet hospitalizací pro infarkt myokardu (HR = 0,94; p = 0,001) a nutnost koronárních revaskularizací (HR = 0,70; p = 0,016). Post hoc analýza publikovaná o rok později ukázala, že u nemocných, kteří měli při vstupu do studie limitující anginu pectoris, ivabradin významně snížil výskyt primárního klinického ukazatele o 24 % a počet hospitalizací pro infarkt myokardu o 42 %. Většina nemocných ve studii (87 %) užívala betablokátory. Podávání ivabradinu bylo bezpečné a dobře tolerované. Snížení SF ivabradinem u nemocných s ICHS a systolickou dysfunkcí levé komory nesnížilo riziko výskytu kardiovaskulárních příhod. Zvýšená klidová SF (≥ 70/ min) identifikuje nemocné, kteří mají významně zvýšené riziko kardiovaskulárních příhod. Snížení SF ivabradinem u těchto nemocných mělo příznivý vliv na prognózu. Také u nemocných s limitující anginou pectoris při vstupu do studie snížil ivabradin výskyt kardiovaskulárních příhod. Zdá se, že se příznivý účinek ivabradinu při vyšší SF a angině pectoris násobí.
Klíčová slova:
angina pectoris – ivabradin – klinická studie BEAUTIFUL – snížení srdeční frekvence – kardiovaskulární mortalita – kardiovaskulární morbidita
Úvod
Ve studii BEAUTIFUL (morBidity ‑ mortality EvAlUaTion of the If inhibitor ivabradin in patients with coronary disease and leFt ventricULar dysfunction) byl studován účinek prvního klinicky používaného blokátoru kanálů If ivabradinu u nemocných s chronickou ischemickou chorobou srdeční (ICHS) a systolickou dysfunkcí levé komory [1]. Iontové kanály If se vyskytují takřka výhradně v sinoatriálním uzlu a jsou zodpovědné za proud směřující dovnitř buněk. Tento proud je pozoruhodný tím, že je aktivován hyperpolarizací. Proto jsou kanály aktivované v průběhu fáze klidového potenciálu a urychlují diastolickou depolarizaci sinusového uzlu a tím i jeho pacemakerovou funkci. Pro tyto své neobvyklé vlastnosti byly pojmenovány If (I znamená proud a f podivný nebo legrační – funny). Blokáda kanálu If ivabradinem vede ke zpomalení diastolické depolarizace sinoatriálního uzlu a bradykardii [2].
Řada předcházejících studií a epidemiologických průzkumů konzistentně ukázala, že klidová srdeční frekvence (SF) má vliv na prognózu. Čím je klidová SF vyšší, tím je větší celková i kardiovaskulární mortalita. Platí to jak pro obecnou populaci [3], tak i pro nemocné s hypertenzí [4], chronickou ICHS [5], akutním infarktem myokardu (IM) [6] a chronickým srdečním selháním [7]. Všechna tato data byla získána z epidemiologických studií, trvajících až několik desítek let, a vedla ke vzniku hypotézy, že klidová SF by mohla být společným jmenovatelem v patofyziologických mechanizmech vzniku kardiovaskulárních onemocnění a jejich komplikací, jako jsou IM nebo srdeční selhání. Není ovšem jasné, zda vyšší srdeční frekvence je skutečným kauzálním rizikovým faktorem horší prognózy nebo jen jejím markerem [8 – 9]. Příznivé ovlivnění prognózy nemocných po prodělaném IM nebo s chronickým srdečním selháním betablokátory může být podmíněno nejenom zpomalením SF, ale i dalšími účinky betablokátorů, např. snížením tonusu sympatoadrenálního systému [7,10 – 11]. Není jasné, zda samotné farmakologické zpomalení srdeční frekvence bude mít příznivý vliv na prognózu. Ivabradin se svým bradykardizujícím účinkem a absencí jiných hemodynamických nebo neurohumorálních účinků je ideálním nástrojem k tomu, aby se na tuto otázku získala odpověď.
Studie BEAUTIFUL
Ve studii BEAUTIFUL bylo randomizováno 10 917 nemocných se stabilizovanou chronickou ischemickou chorobou srdeční, která byla dokumentována koronární angiografií, prodělaným infarktem myokardu nebo předcházející chirurgickou či katetrizační koronární revaskularizací, a se systolickou dysfunkcí levé komory (EF < 0,40 a LVED > 56 mm). Všichni nemocní museli mít sinusový rytmus s frekvencí > 60/ min. Byli randomizováni v poměru 1 : 1 k užívání placeba nebo ivabradinu v počáteční dávce 2 × 5 mg, která byla titrována k cílové dávce 2 × 7,5 mg. Primárním sledovaným klinickým ukazatelem byla kombinace kardiovaskulárních úmrtí, hospitalizací pro akutní infarkt myokardu a hospitalizací pro nově vzniklé nebo akutně zhoršené srdeční selhání. Průměrná doba sledování nemocných byla 19 měsíců. Nemocní byli velmi dobře léčeni, většina z nich měla léky doporučované pro sekundární prevenci včetně betablokátorů, které užívalo 84 % nemocných.
Průměrná klidová SF při randomizaci byla 71,6/ min. Zhruba polovina zařazených nemocných měla bazální klidovou SF ≥ 70/ min a polovina < 70/ min. Tyto dvě předem protokolem specifikované podskupiny nemocných byly hodnoceny zvlášť. Po šesti měsících od randomizace snížil ivabradin proti placebu průměrnou klidovou SF o 7,2/ min, s prodlužující se dobou sledování průměrný rozdíl SF klesal, po 12 měsících byl 6,4/ min, po 18 měsících 6,0/ min a po 24 měsících 5,6/ min. Tento pokles byl způsoben tím, že pokud u nemocného klesla klidová SF pod 50/ min, byla podle protokolu studijní medikace ukončena bez ohledu na to, zda bradykardie byla symptomatická či nikoliv.
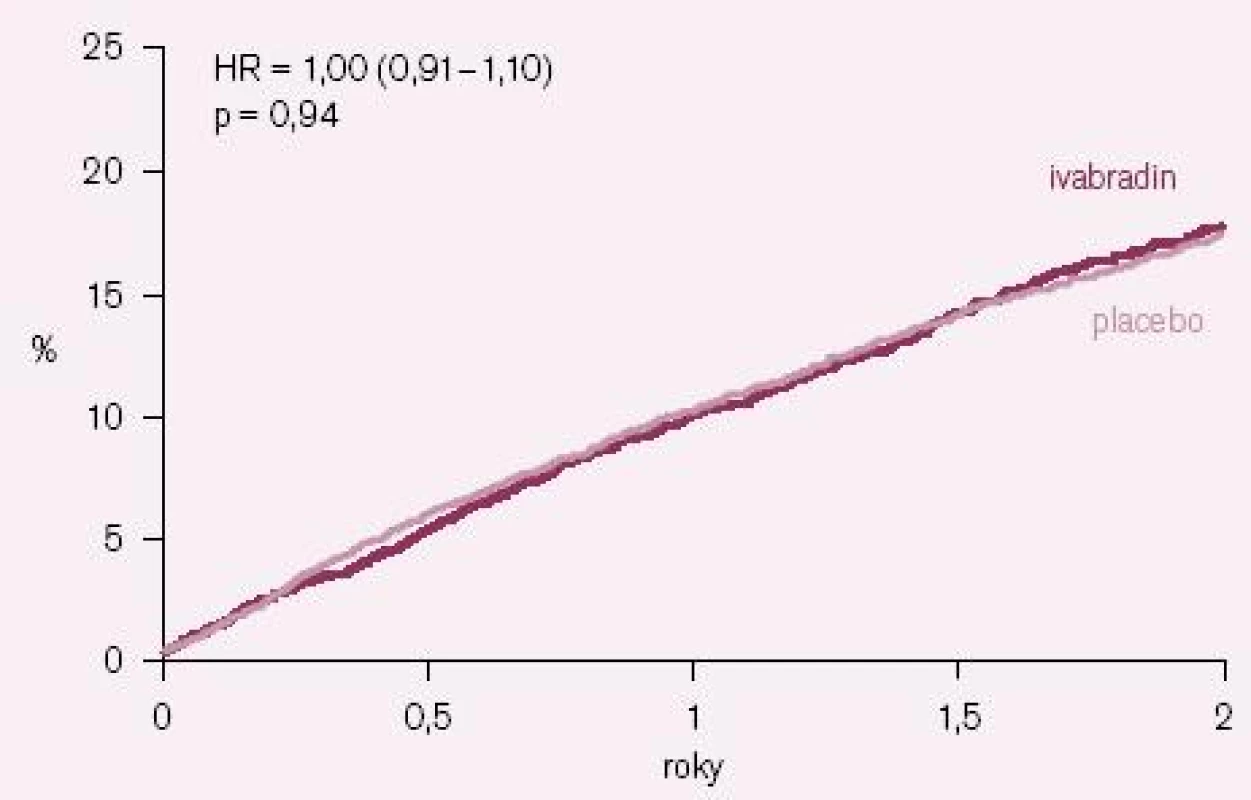
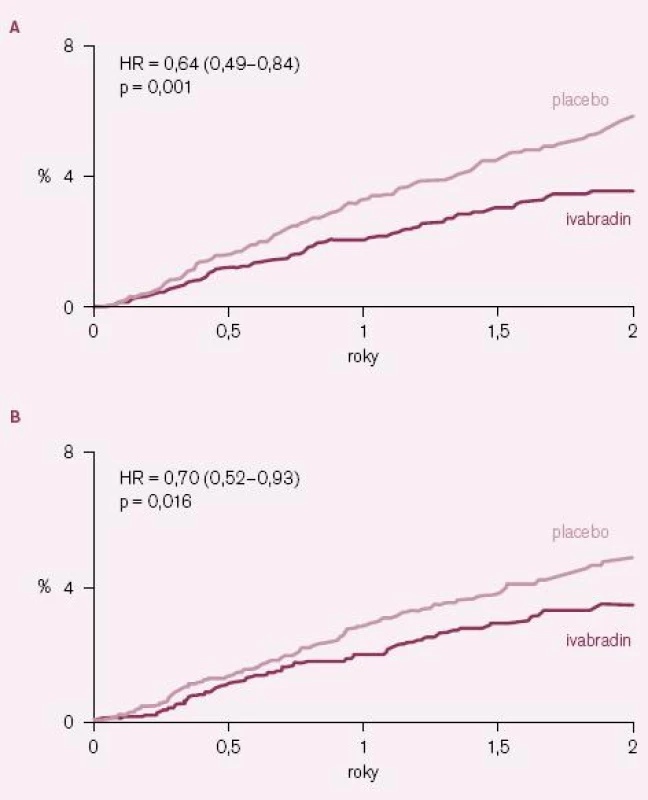
Výsledky studie BEAUTIFUL byly paralelně s první ústní prezentací na kongresu Evropské kardiologické společnosti 2008 v Mnichově publikovány v prestižním časopisu The Lancet [12]. Ivabradin nesnížil výskyt primárního sledovaného kombinovaného klinického ukazatele, který se vyskytl u 844 nemocných (15,4 %) v ivabradinové skupině a u 832 nemocných (15,3 %) v placebové skupině; poměr rizik (HR) = 1,0 (95 % CI = 0,91 – 1,1); p = 0,94 (obr. 1). Účinek ivabradinu byl podobný ve všech prespecifikovaných podskupinách nemocných s výjimkou podskupin nemocných s vyšší (≥ 70/ min) a nižší (< 70/ min) bazální klidovou SF. Ani výskyt sledovaných sekundárních klinických ukazatelů se v celé studované populaci nelišil mezi skupinami užívajícími ivabradin a placebo. V předem specifikované podskupině nemocných se vstupní klidovou SF ≥ 70/ min sice došlo při ivabradinu k malému poklesu výskytu primárního klinického ukazatele o 9 %, ale tento pokles nebyl statisticky významný (HR = 0,91; 95 % CI = 0,81 – 1,04; p = 0,17). Ani u této podskupiny nemocných ivabradin neovlivnil počet kardiovaskulárních úmrtí (HR = 1,02; 95 % CI = 0,86 – 1,21; p = 0,82), úmrtí na srdeční selhání a hospitalizací pro srdeční selhání. V kontrastu s tím ale ivabradin u této podskupiny nemocných statisticky významně snížil počet hospitalizací pro IM (HR = 0,64; 95 % CI = 0,49 – 0,84; p = 0,001) a nutnost koronárních revaskularizací (HR = 0,70; 95 % CI = 0,52 – 0,93; p = 0,016) (obr. 2 A – B).
Výskyt závažných nežádoucích účinků byl u nemocných, kteří užívali ivabradin, stejný jako u nemocných, jež užívali placebo (23 % pro obě skupiny). Jak se dalo očekávat a jak také vyplývá z mechanizmu účinku ivabradinu, byl výskyt bradykardie (< 50/ min) významně vyšší při ivabradinu (13 %) než při placebu (2 %). U všech těchto nemocných bylo podle protokolu trvale přerušeno podávání studijní medikace. U naprosté většiny z nich však byla bradykardie asymptomatická, symptomatická byla jen u 21 % nemocných s bradykardií. Výskyt vizuálních nežádoucích účinků včetně fosfénů byl překvapivě nízký – jen u 0,5 % nemocných na ivabradinu proti 0,2 % nemocných na placebu.
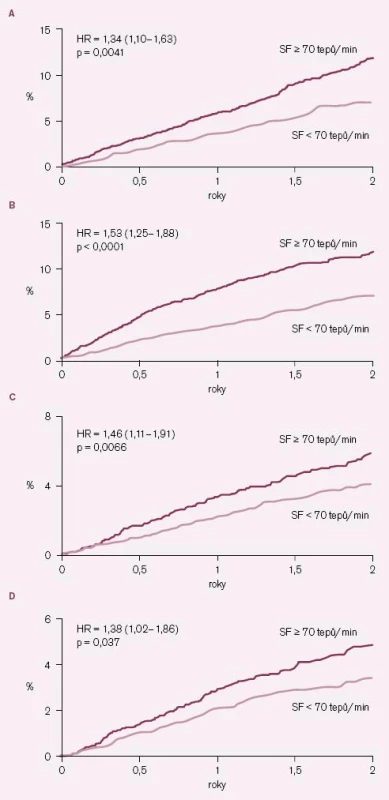
Vedlejším, ale velmi cenným výsledkem studie BEAUTIFUL byla subanalýza placebové skupiny, která umožnila poprvé v historii prospektivním způsobem sledovat a hodnotit vztah mezi klidovou SF a výskytem kardiovaskulárních příhod [13]. Výskyt kardiovaskulárních příhod byl analyzován pomocí Coxových proporcionálních modelů rizika u dvou podskupin nemocných z placebové skupiny – nemocných se vstupní klidovou SF ≥ 70/ min (n = 2 693 nemocných) a nemocných se vstupní klidovou SF < 70/ min (n = 2 745 nemocných). Byly provedeny také analýzy se SF jako kontinuálním parametrem. Po korekci na vstupní charakteristiky měli nemocní se vstupní klidovou SF ≥ 70/ min významně zvýšené riziko kardiovaskulárního úmrtí (o 34 %; p = 0,0041), hospitalizace pro srdeční selhání (o 53 %; p < 0,0001), hospitalizace pro infarkt myokardu (o 46 %; p = 0,0066) a koronární revaskularizace (o 38 %; p = 0,037) (obr. 3 A – D). Na každý vzestup klidové SF o 5/ min stoupl výskyt kardiovaskulárních úmrtí o 8 % (p = 0,0005), počet hospitalizací pro srdeční selhání o 16 % (p < 0,0001), hospitalizací pro infarkt myokardu o 7 % (p = 0,052) a koronárních revaskularizací o 8 % (p = 0,034). Vzestup mortality a počtu klinických příhod, jejichž příčinou je srdeční selhání (hospitalizace a úmrtí) je při SF ≥ 70/ min kontinuální, zatímco pro koronární příhody je vztah mezi stoupající SF a stoupajícím počtem příhod méně zřetelný.
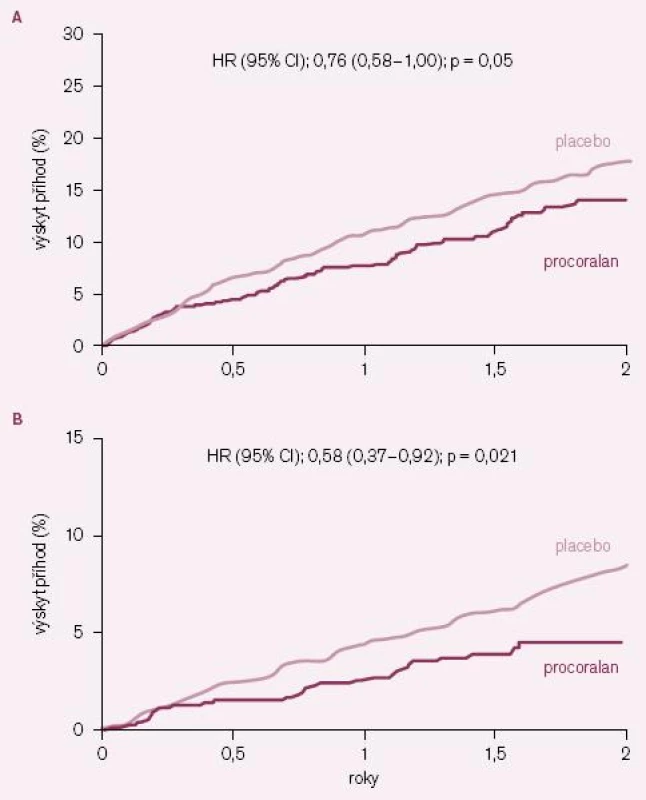
S ročním zpožděním byly publikovány zajímavé výsledky post hoc analýzy účinku ivabradinu u podskupiny nemocných ze studie BEAUTIFUL, kteří měli při vstupu do studie anginu pectoris (AP) [14]. Z celé populace 10 917 nemocných ve studii jich mělo při vstupu 1 507 (13,8 %) limitující AP: 734 jich bylo na ivabradinu a 773 na placebu. Z těchto nemocných s AP jich 712 mělo vstupní klidovou SF ≥ 70/ min. Léčba ivabradinem byla u podskupiny nemocných s AP spojena s významným snížením výskytu primárního kombinovaného klinického ukazatele o 24 % (HR = 0,76; 95 % CI = 0,58 – 1,00) a hospitalizací pro IM o 42 % (HR = 0,58; 95 % CI = 0,37 – 0,92) (obr. 4 A – B). U nemocných s AP a současně i vstupní klidovou SF ≥ 70/ min snížil ivabradin počet hospitalizací pro IM o 73 % (HR = 0,27; 95 % CI = 0,11 – 0,66) a koronární revaskularizace o 59 % (HR = 0,41; 95 % CI = 0,17 – 0,99). I u podskupiny nemocných s AP byl ivabradin bezpečný a dobře tolerovaný.
Co z výsledků studie BEAUTIFUL vyplývá?
Studie BEAUTIFUL, její podskupinová analýza nemocných s vyšší SF a nedávno publikovaná post hoc podskupinová analýza nemocných s AP nepochybně přinesly celou řadu zajímavých a důležitých poznatků. Především analýza vztahu klidové SF a výskytu kardiovaskulárních příhod v placebové větvi prospektivním způsobem definitivně potvrdila to, co jsme předpokládali na základě epidemiologických studií a dodatečných podskupinových analýz. Zvýšená klidová SF (≥ 70/ min) identifikuje nemocné, kteří mají zvýšené riziko kardiovaskulárních příhod. Nicméně hypotéza, že farmakologické snížení srdeční frekvence ivabradinem u nemocných s chronickou ICHS a systolickou dysfunkcí levé komory sníží výskyt budoucích kardiovaskulárních příhod, se bohužel nepotvrdila, respektive potvrdila se jen pro nemocné se zvýšenou klidovou SF (≥ 70/ min) a jen pro koronární příhody – infarkty myokardu, nestabilní anginu pectoris a nutnost koronární revaskularizace. A to i přesto, že většina nemocných (84 %) byla současně léčena betablokátory. Další podskupinu nemocných se zvýšeným kardiovaskulárním rizikem představují nemocní s AP, kteří mají symptomatickou ischemii myokardu. Je známo, že tito nemocní mají vyšší riziko akutních koronárních příhod. V post hoc analýze u nemocných s AP ivabradin snížil významně výskyt primárního kombinovaného klinického ukazatele z hlavní studie BEAUTIFUL o 24 %. Pokles rizika byl způsoben především významným snížením počtu hospitalizací pro IM o 42 %. Tyto výsledky jsou v kontrastu s výsledky hlavní studie BEAUTIFUL, ve které ivabradin neměl na výskyt primárního kombinovaného klinického ukazatele žádný vliv. Vysvětlením je nejspíše fakt, že v celé studii BEAUTIFUL tvořily většinu primárních endpointů hospitalizace pro srdeční selhání, zatímco v subpopulaci nemocných s AP se jako primární endpointy častěji vyskytovaly koronární příhody, zejména IM. To podporuje hypotézu, že zpomalení SF ivabradinem má větší vliv na výskyt koronárních příhod. Zdá se, že příznivý účinek ivabradinu je zprostředkován jeho příznivým účinkem na ischemii myokardu a pravděpodobné snížení incidence IM. To je v souladu s prokázanými antiischemickými účinky ivabradinu. Naopak, poněkud překvapivě se nepotvrdilo, že snížení SF ivabradinem může snížit výskyt hospitalizací pro a úmrtí na srdeční selhání, přestože zvýšená klidová SF je jednoznačně mohutným prediktorem takovýchto příhod. Může to znamenat, že zvýšená SF je jen markerem vysokého rizika vzniku a progrese srdečního selhání (tedy důsledkem), nikoliv jeho rizikovým faktorem (tedy příčinou). Větší jasno do vztahu SF, jejího snížení ivabradinem a srdečním selháním přinesou výsledky probíhající studie SHIFT (Systolic Heart failure treatment with the If‑inhibitor ivabradin Trial). V neposlední řadě studie BEAUTIFUL prokázala, že léčba nemocných se stabilizovanou chronickou ischemickou chorobou srdeční a systolickou dysfunkcí levé komory ivabradinem je naprosto bezpečná, a to dokonce i v situaci, kdy u 84 % nemocných byl ivabradin podáván současně s betablokátorem. Nemocní s AP ve studii BEAUTIFUL užívali betablokátory dokonce v 90 %! Nicméně, takřka polovina těchto nemocných nedosáhla doporučenou cílovou dávku podle platných guidelines. Důvody k tomu byly různé včetně bradykardie, hypotenze a sexuální dysfunkce. Podobné suboptimální dávkování betablokátorů je hlášeno také v průzkumech u nemocných s chronickým srdečním selháním [15], po prodělaném IM [16] a se stabilní AP [17].
Závěr
Lze konstatovat, že studie BEAUTIFUL ukázala, že antianginózní lék ivabradin může snížit výskyt kardiovaskulárních, zejména koronárních příhod u nemocných s chronickou ICHS a systolickou dysfunkcí levé komory, kteří mají i přes event. léčbu betablokátory klidovou SF ≥ 70/ min a/ nebo AP. Naopak také ukázala, že ivabradin není indikován u nemocných s chronickou ICHS a systolickou dysfunkcí levé komory, kteří mají klidovou SF < 70/ min a nemají AP. Studie BEAUTIFUL tak naznačila, jaké bude nejpravděpodobnější místo ivabradinu v léčbě chronické ICHS, nechala však ještě řadu otázek nezodpovězených. Předpokládaný prospěch z léčby ivabradinem u nemocných s chronickou ICHS, zachovanou systolickou funkcí levé komory, klidovou SF ≥ 70/ min a event. stabilní AP bude testovat nedávno zahájená klinická studie SIGNIFY.
prof. MUDr. Jaromír Hradec, CSc., FESC
III. interní klinika 1. lékařské fakulty UK a VFN, Praha
jhradec@vfn.cz
Zdroje
1. Fox K, Ferrari R, Tendera M et al. BEAUTIFUL Steering Comitee. Rationale and design of a randomized, double‑blind, placebo ‑ controlled trial of ivabradine in patients with stable coronary artery disease and left ventricular systolic dysfunction: the morBidity ‑ mortality EvAlUaTion of the If inhibitor ivabradine in patiens with coronary disease and left ventricULar dysfunction (BEAUTIFUL) study. Am Heart J 2006; 152 : 860 – 866.
2. DiFrancesco D, Camm AJ. Heart rate lowering by a specific and selective If current inhibition with ivabradine: A new therapeutic perspective in cardiovascular disease. Drugs 2004; 64 : 1757 – 1765.
3. Kannel WB, Kannel C, Paffenberger RS jr et al. Heart rate and cardiovascular mortality: the Framingham study. Am Heart J 1987; 113 : 1489 – 1494.
4. Palatini P, Casiglia E, Paulleto P. Relation between physical training and ambulatory blood pressure in stage I hypertensive subjects: results of the HARVEST trial. Circulation 1994; 90 : 2870 – 2872.
5. Diaz A, Bourassa MG, Guertin MC et al. Long‑term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J 2005; 26 : 967 – 974.
6. Hjalmarson A, Gilpin EA, Kjekshus J et al. Influence of heart rate on mortality after acute myocardial infarction. Am J Cardiol 1990; 65 : 547 – 553.
7. Kjekhus J, Gullestad L. Heart rate as a therapeutic target in heart failure. Eur Heart J 1999; (suppl H): H64 – H69.
8. Hradec J. Selektivní ovlivnění srdeční frekvence – nový fenomén v kardiovaskulární farmakoterapii. Remedia 2008; 18 : 114 – 119.
9. Reil JC, Böhm M. The role of heart rate in the development of cardiovascular disease. Clin Res Cardiol 2007; 96 : 585 – 592.
10. Kjekshus JK. Importance of heart rate in determining beta‑blocker efficacy in acute and long‑term acute myocardial infarction intervention trials. Am J Cardiol 1986; 57 : 43F – 49F.
11. Cucherat M. Quantitative relationship between resting heart rate reduction and magnitude of clinical benefits in post‑myocardial infarction. A meta‑regression of randomized clinical trials. Eur Heart J 2007; 28 : 3012 – 3019.
12. Fox K, Ford I, Steg PG et al. BEAUTIFUL Investigators. Ivabradin for patients with stable coronary artery disease and left ‑ ventricular systolic dysfunction (BEAUTIFUL): a randomised, double‑blind, placebo ‑ controlled trial. Lancet 2008; 372 : 807 – 816.
13. Fox K, Ford I, Steg PG et al. BEAUTIFUL Investigators. Heart rate as a prognostic risk factor in patients with coronary artery disease and left ‑ ventricular systolic dysfunction (BEAUTIFUL): a subgroup analysis of a randomised cotrolled trial. Lancet 2008; 372 : 817 – 821.
14. Fox K, Ford I, Steg G et al. BEAUTIFUL Investigators. Relationship between ivabradine treatment and cardiovascular outcomes in patients with stable coronary artery disease and left ventricular systolic dysfunction with limiting angina: a subgroup analysis of the randomized, controlled BEAUTIFUL trial. Eur Heart J 2009; 30 : 2337 – 2345.
15. Fonarow GC, Abraham WT, Albert NM et al. Dosing of beta‑blocker therapy before, during, and after hospitalization for heart failure (from Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients With Heart Failure). Am J Cardiol 2008; 102 : 1524 – 1529.
16. Gislason GH, Rasmussen JN, Abildstrom SZ et al. Long‑term compliance with beta‑blocker, angiotensin‑converting enzyme inhibitors, and statins after acute myocardial infarction. Eur Heart J 2006; 27 : 1153 – 1158.
17. Wiest FC, Bryson CL, McDonnel MB et al. Suboptimal pharmacotherapeutic management of chronic stable angina in the primary care setting. Am J Med 2004; 117.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2010 Číslo 1
-
Všechny články tohoto čísla
- Reziduální vaskulární riziko a celosvětová aktvita R3I (Residual Risk Reduction Initiative)
- Deprese u pacientů s kardiologickým onemocněním
- Studie CORD – analýza nemocných starších 80 let a nemocných s izolovanou systolickou hypertenzí
- Carvedilol v léčbě kardiovaskulárních onemocnění
- Ivabradin v léčbě ischemické choroby srdeční – výsledky klinické studie BEAUTIFUL
- Noví hráči na šachovnici protidestičkové léčby – co můžeme očekávat?
- Tenektepláza v současné klinické praxi
- Neléčíme příliš?
- Jsou rozdíly v účinku inhibitorů ACE klinicky významné? Co říkají výsledky studií ONTARIO
- Heart Failure 2009 – NICE
- Galerie autorů
- Možnosti léčebného ovlivnění tepenné tuhosti
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Carvedilol v léčbě kardiovaskulárních onemocnění
- Deprese u pacientů s kardiologickým onemocněním
- Tenektepláza v současné klinické praxi
- Jsou rozdíly v účinku inhibitorů ACE klinicky významné? Co říkají výsledky studií ONTARIO
