Novinky v koronárních intervencích
Latest developments in coronary interventions
Due to progress made in coronary interventions, we have seen over the last 20 years a dramatic improvement in early results and subsequent long‑term prognosis of patients treated with percutaneous coronary interventions. New generations of drug‑eluting stents (DES) and a wider use of new modalities for a more detailed imaging of the character of lesions in coronary arteries, as well as the concept of functional revascularization, have all brought about significant benefits. These new methods are used mainly in situations where angiography and stress tests cannot provide adequate information on actual haemodynamic significance of a coronary artery stenosis. This paper summarises the current state of knowledge about DES. We present key modalities to optimise PCI performance and provide a brief summary of recommendations for antithrombotic therapy after stent implantation in selected clinical settings.
Keywords:
coronary artery disease – intravascular ultrasound – fractional flow reserve – optical coherence tomography – drug‑eluting stents – polymer – antiaggregation
Autoři:
O. Aschermann; M. Mates; K. Kopřiva
Působiště autorů:
Kardiocentrum, Nemocnice Na Homolce, Praha
Vyšlo v časopise:
Kardiol Rev Int Med 2015, 17(3): 207-213
Kategorie:
Kardiologická revue
Souhrn
Během posledních 20 let došlo v návaznosti na pokrok v koronárních intervencích k zásadnímu zlepšení časných výsledků i následné dlouhodobé prognózy pacientů ošetřených touto metodou. Významným přínosem jsou nové generace lékových stentů (DES), dále je to širší využití nových modalit detailnějšího zobrazení charakteru postižení věnčitých tepen a současně aplikace konceptu funkční revaskularizace. Tyto nové metody jsou využívány především v případech, kdy nejsou angiografie i neinvazivní zátěžové testy schopny podat správnou informaci o skutečné hemodynamické významnosti stenózy koronární tepny. V tomto sdělení shrnujeme současný stav poznatků o DES, prezentujeme stěžejní modality pro optimalizaci výkonu PCI a předkládáme stručné shrnutí doporučení pro antitrombotickou léčbu po implantaci stentu ve vybraných klinických indikacích.
Klíčová slova:
ischemická choroba srdeční – intravaskulární ultrazvuk – frakční průtoková rezerva – optická koherenční tomografie – lékové stenty – polymer – antiagregace
Úvod
Perkutánní koronární intervence (PCI) je jednou z nejčastěji používaných metod v kardiologii. Trvale se zlepšující kvalita instrumentária, širší využití nových zobrazovacích metod, hodnocení funkčního dopadu organických změn a moderní doprovodná medikace dovolují řešit stále složitější nálezy s vyšší úspěšností a nižším rizikem komplikací.
Jednou z hlavních limitací optimálního výsledku PCI je restenóza – proliferace neointimy vedoucí k recidivě stenózy intervenované tepny, obávanou komplikací je pak trombóza stentu s jejími život ohrožujícími konsekvencemi. V prevenci, ale i v léčbě restenózy, jsou již řadu let nejúčinnější stenty uvolňující léky (DES) [1]. K maximálnímu snížení výskytu trombózy ve stentu zásadně přispívá jednak správná indikace koronární intervence – měly by být intervenovány jen skutečně hemodynamicky významné stenózy (funkční hodnocení stenóz metodou frakční průtokové rezervy – FFR), druhým faktorem je pak dosažení optimálního primárního výsledku PCI. K tomu významně napomáhají nové metody detailního zobrazení lumina i stěny věnčité tepny, jakými jsou intravaskulární ultrazvuk (IVUS) a optická koherenční tomografie (OCT). Anti-trombotická farmakoterapie po letech dominance clopidogrelu zaznamenala nástup nových farmak – prasugrelu a ticagreloru, které se zvláště u akutních koronárních syndromů ukázaly jako efektivnější než clopidogrel.
Nové metody umožňující anatomické i hemodynamické posouzení nálezu
Intravaskulární ultrazvuk
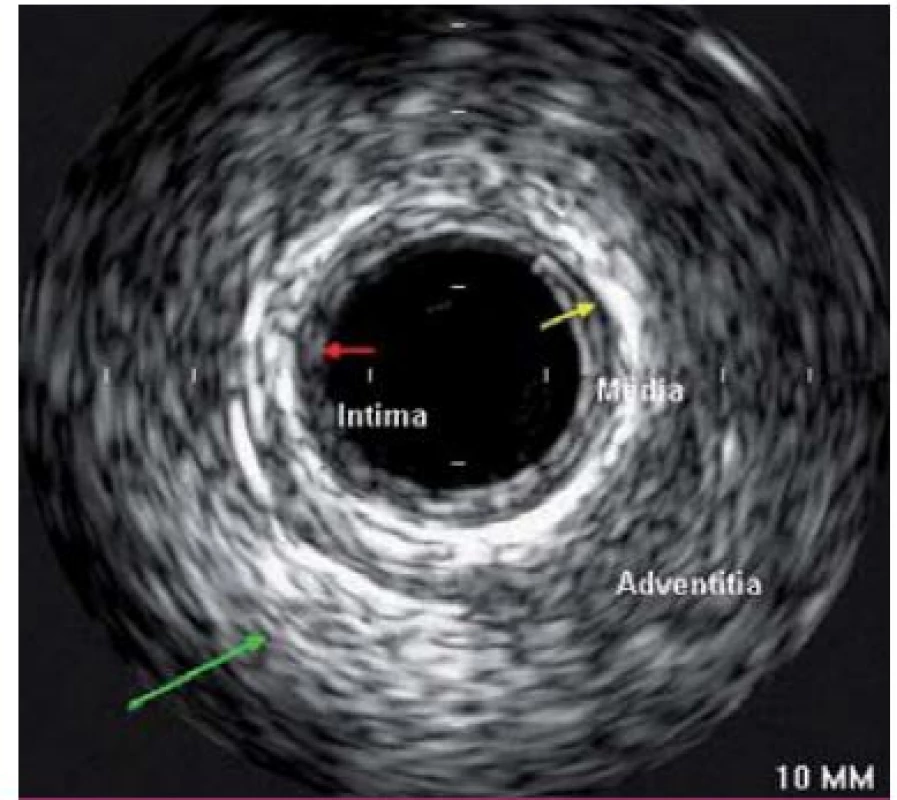
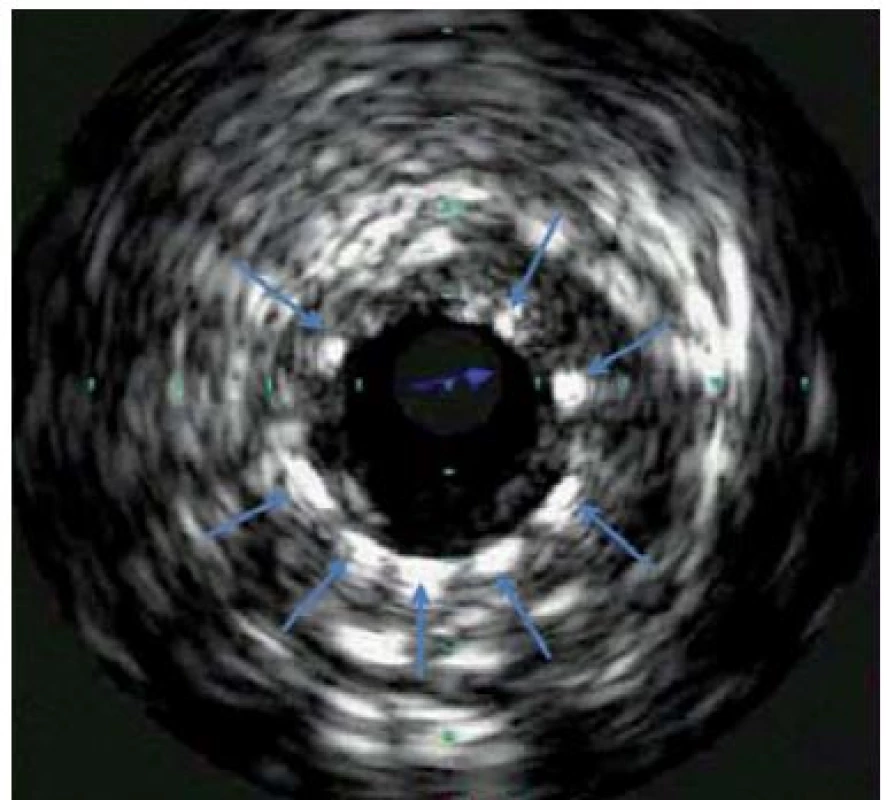
Jako metoda byl vyvinut Bomem v Rotterdamu již v roce 1971, první zobrazení lidských tepen bylo provedeno v roce 1988. Intravaskulární ultrazvuk (IVUS) využívá principu odražených ultrazvukových vln k podrobnému zobrazení cévní stěny, je prováděn pomocí miniaturní ultrazvukové sondy zavedené přímo do koronární tepny. Sonda se zavádí za vyšetřovaný úsek tepny do periferie a poté je kontinuální rychlostí stahována zpět k ústí koronární tepny. Axiální (hloubkové) rozlišení je v řádu 80 – 100 µm. IVUS zobrazí strukturu stěny cévy (obr. 1) včetně složení aterosklerotických plátů, kde je schopen určit přítomné kalcifikace, fibrózní pláty či trombus. Umožňuje přesnější kvantifikaci závažnosti stenózy a výpočet minimální plochy lumen v místě zúžení. Dokáže zobrazit intimální trhliny – disekce a též případně pozitivní remodelaci tepny. Jeho využití je u morfologicky nepřehledných lézí (léze v bifurkacích, ostiální stenózy). Napomáhá upřesnění významu angiograficky hraniční stenózy, bližšímu zhodnocení stenózy kmene levé věnčité tepny. Další oblastí využití je určení adekvátního roztažení implantovaného stentu, jeho apozici ke stěně tepny (obr. 2). V rámci metody je možnost využití tzv. virtuální histologie, která vychází z principu intravaskulárního ultrazvuku a zobrazuje kvalitativní složení plátu. V něm rozlišuje tkáň fibrózní, tukovou, kalcifikace a nekrotické hmoty, což samotná angiografie neumožňuje (obr. 3). Takto může pomoci ve stratifikaci nestability a rizikovosti aterosklerotického plátu a při volbě nejvhodnější léčebné strategie, což může pozitivně ovlivňovat krátkodobou i dlouhodobou prognózu nemocných [2].
Frakční průtoková rezerva
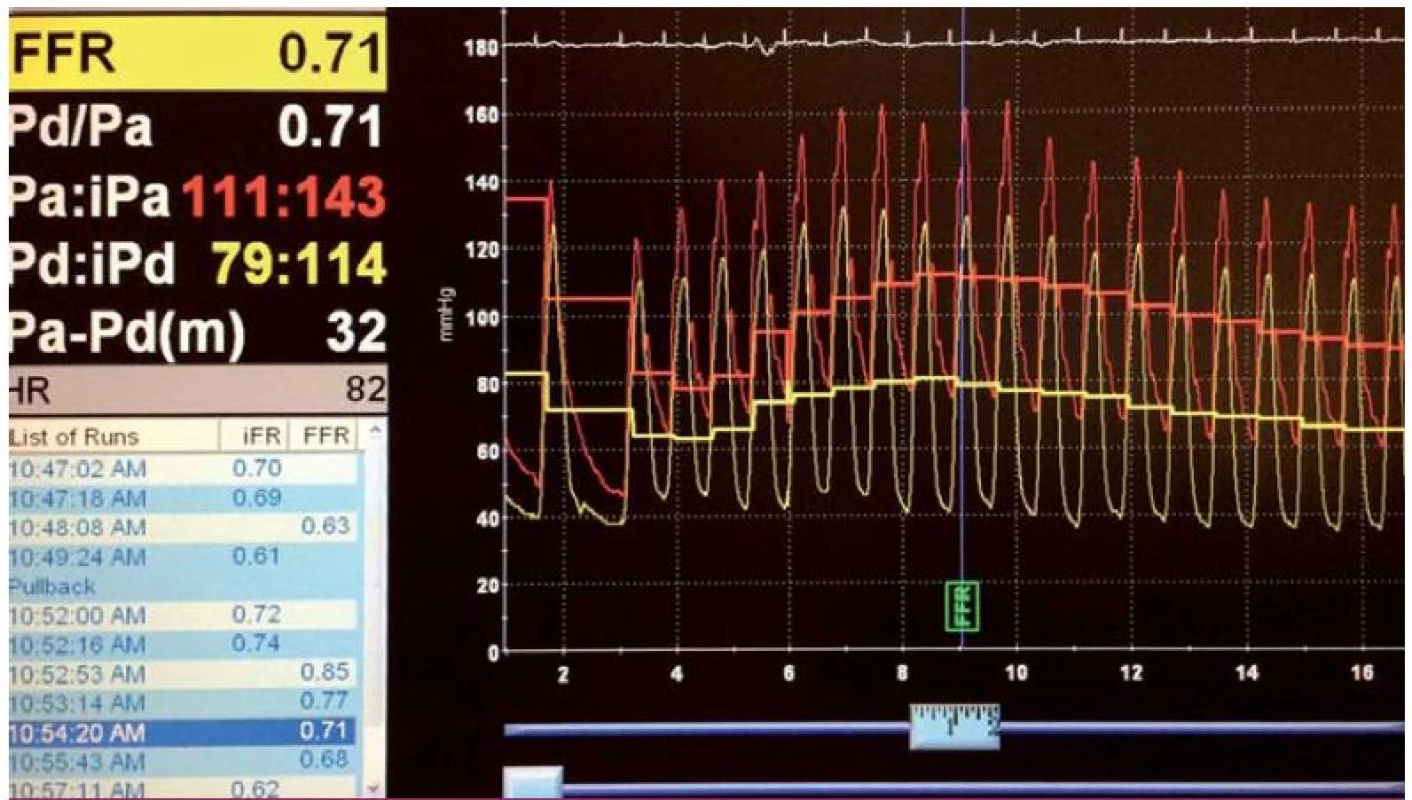
Detekce zátěží vyvolané ischemie myokardu a její odstranění intervencí hraje klíčovou roli v přístupu k pacientům se stabilní ischemickou chorobou srdeční (ICHS). Je známo, že v určitých případech nejsou neinvazivní zátěžové testy ani angiografie schopny podat správnou informaci o skutečné hemodynamické významnosti stenózy koronarní tepny. Provedení intervence u hemodynamicky nevýznamné stenózy pak ve srovnání s konzervativní léčbou zhoršuje prognózu [3]. Léze věnčitých tepen se stenózami mezi 40 a 70 % mohou patřit mezi hemodynamicky významné, ale i nevýznamné, a jsou proto označovány jako tzv. šedá zóna [4 – 6]. I přes nesporný rozvoj technologií koronární angiografie i následného zpracování získaného obrazu, včetně 2D a 3D kvantitativní analýzy, je nutno do jisté míry počítat s limitací v určení funkčního významu postižení. Použití invazivního testování měřením myokardiální FFR (fractional flow reserve) pro rozhodnutí o provedení PCI bylo v provedených pracích statisticky významně lepší než rozhodování jen podle angiografického nálezu [7]. Metoda vychází z principu měření tlakového gradientu na stenóze při maximální hyperemii – průtoku postiženou věnčitou tepnou. Hodnotí poměr středních tlaků za stenózou a před stenózou – tuto hodnotu reprezentuje aortální tlak. V praxi je distální tlak měřen tlakovým senzorem na supertenkém vodiči odpovídajícím vodiči pro standardní koronární intervenci (PCI vodič), a to v klidu a po podání vazodilatačního podnětu (adenozin). U metody bylo dokázáno, že má vynikající senzitivitu i specificitu v porovnání s konvenčními zátěžovými testy, jako jsou ergometrie, zátěžová echokardiografie či perfuzní scintigrafie myokardu [8,9].
Získaná hodnota vypovídá o funkčním významu lézí (obr. 4):
- hodnoty FFR < 0,75 svědčí pro funkčně významnou stenózu,
- hodnoty FFR > 0,80 svědčí pro funkčně nevýznamnou stenózu,
- hodnoty FFR 0,75 – 0,80 jsou považovány za hraniční.
První zásadní prací, která hodnotila význam FFR při koronárních intervencích, byla studie DEFER [10]. Ve studii byl prokázán nízký výskyt vedlejších příhod u konzervativně řešených pacientů se stabilní anginou pectoris a hodnotou FFR > 0,75, výskyt úmrtí a infarktu myokardu (IM) byl u těchto nemocných pod 1 % ročně [10].
Mezníkem pak byla studie FAME publikovaná v roce 2009, která zahrnula 1 005 pacientů s vícečetným postižením věnčitých tepen a rozdělovala je k PCI na základě angiografie či na základě funkčního hodnocení FFR [6]. Výsledky obdobně jako u předchozích prací doložily významné snížení kombinovaného end‑pointu (úmrtí a výskyt IM) v dvouletém sledování ve skupině funkčně vedené revaskularizace (graf 1). Současně práce doložila bezpečnost konzervativní strategie u funkčně nevýznamných postižení, když se ve skupině konzervativně léčených 517 pacientů vyskytl při sledování do dvou let pouze jeden IM.

U pacientů se stabilní ICHS a funkčně nevýznamným postižením věnčitých tepen byl výskyt kombinovaného end‑pointu (úmrtí a výskyt IM) 1 % ročně. Naopak při funkčně významném postižení léčeném pouze medikamentózně je výskyt úmrtí a IM 5 – 10 % ročně. U nemocných s lézemi ošetřenými PCI se stentem bez uplatnění znalosti jejich funkčního dopadu byl pak výskyt úmrtí a IM přibližně 3 %. To znamená, že provedení PCI s implantací stentů u funkčně nevýznamných postižení je spojeno se zhoršením dlouhodobé prognózy u této skupiny pacientů.
Optická koherentní tomografie
Je metoda založená na polarizaci světla v tkáních, používá vlnovou délku blízkou infračervenému světlu – přibližně 1 300 nm. Vlastní katetr je obdobný katetru, který používáme pro zobrazení IVUS. Přes rotující systém s optickým skleněným vláknem může být optický signál směřován a odražený získán tak, že poskytuje velmi detailní obraz tkáně s extrémně vysokým rozlišením (10 – 20 µm), což je asi 10× více než IVUS (100 – 150 µm). Naopak hloubka penetrace do tkáně je v případě optické koherenční tomografie (OCT) menší (1 – 2 mm) než v případě vyšetření metodou IVUS (4 – 8 mm) [11].
První in vivo aplikace OCT byla provedena v oftalmologii, kde slouží i nyní k zobrazení retinálních struktur, práce na toto téma byla publikována již v roce 1993. Tím, že je jeho zobrazení velmi jemné, umožňuje rozlišení tkáňových charakteristik (fibrózní tkáň, kalcifikace, plát bohatý na lipidy) a je schopno identifikovat plát s tenkou fibrózní čepičkou (může znamenat potenciálně nestabilní léze). V průběhu koronární intervence přináší OCT detailní informace – určit přítomnost disekce, trombu, špatnou apozici stentu. Recentní práce též využívaly OCT k hodnocení charakteristiky tkáně v případě restenózy (opakované restenózy stentem ošetřeného segmentu); zajímavým zjištěním byly odlišné morfologie u lékových stentů ve srovnání s klasickými metalickými stenty.
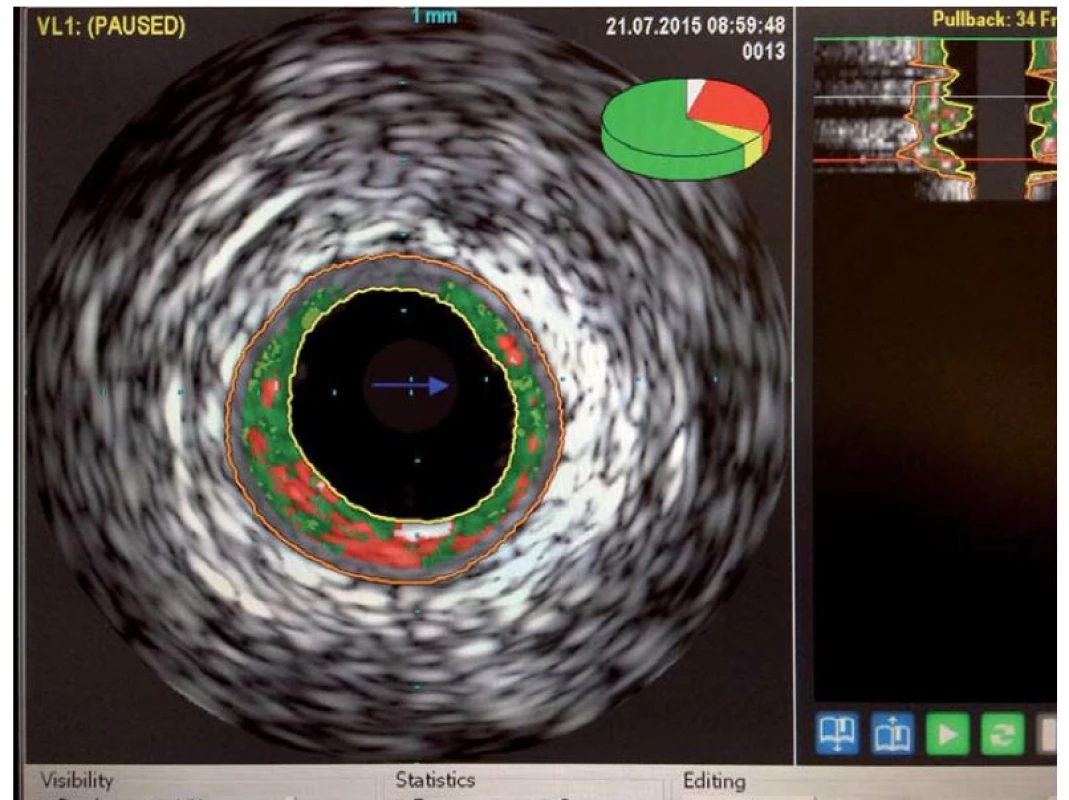
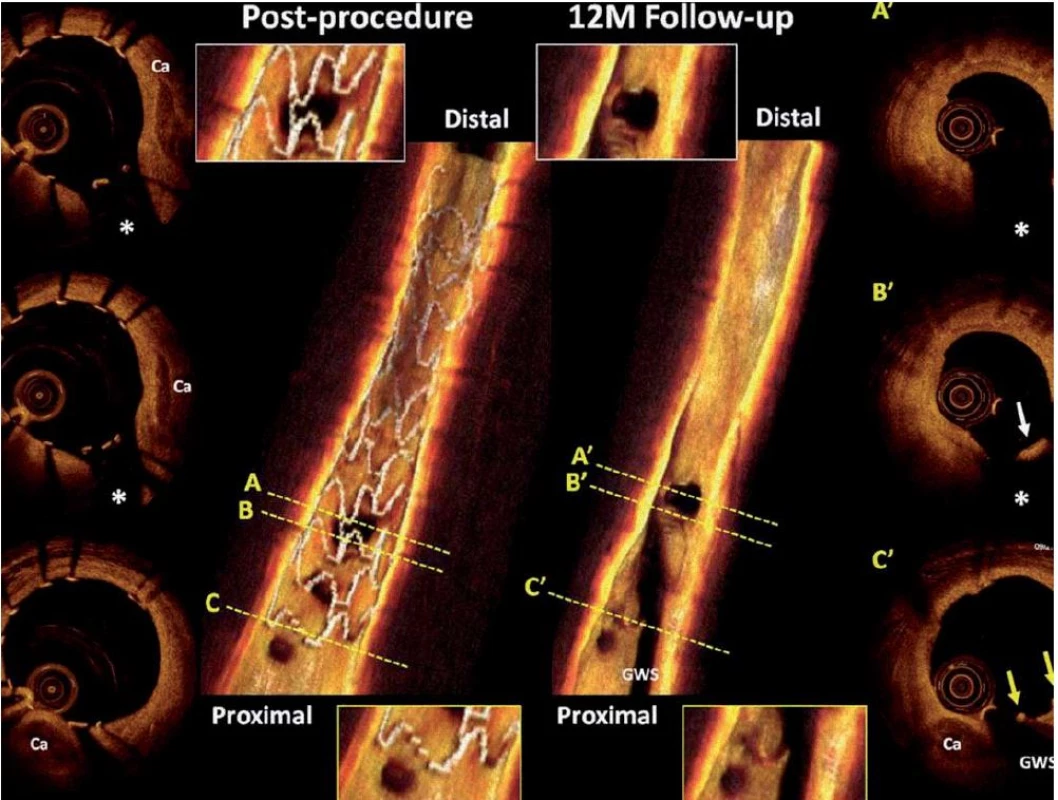
DES signifikantně potlačují proces neointimální hyperplazie, studie s OCT a IVUS demonstrovaly, že dvě třetiny sirolimem krytých lékových stentů jsou kryty neointimou (tloušťka tkáně < 100 µm), což je pod hranicí rozlišovací schopnosti IVUS [12]. OCT je také nejefektivnější metodou při sledování pokrytí strutů stentu u pacientů s implantovaným DES – nekompletní pokrytí je uvažováno za jeden z důležitých rizikových faktorů pozdní trombózy stentu. V tomto kontextu je novou oblastí ideálně využívající možnosti OCT detekce apozice a postupné degredace biodegradabilních stentů (vstřebatelných stentů – viz níže) (obr. 5). To, že je metoda velmi perspektivní a efektivní, se opět promítlo ve stávajících doporučeních ESC, kde v indikaci prevence restenózy a trombózy stentu mají IVUS a OCT indikaci v kategorii IIa [13]. Práce z nedávné doby naznačily, že OCT vedené implantace stentů mohou vést k lepšímu dlouhodobému klinickému výsledku [14].
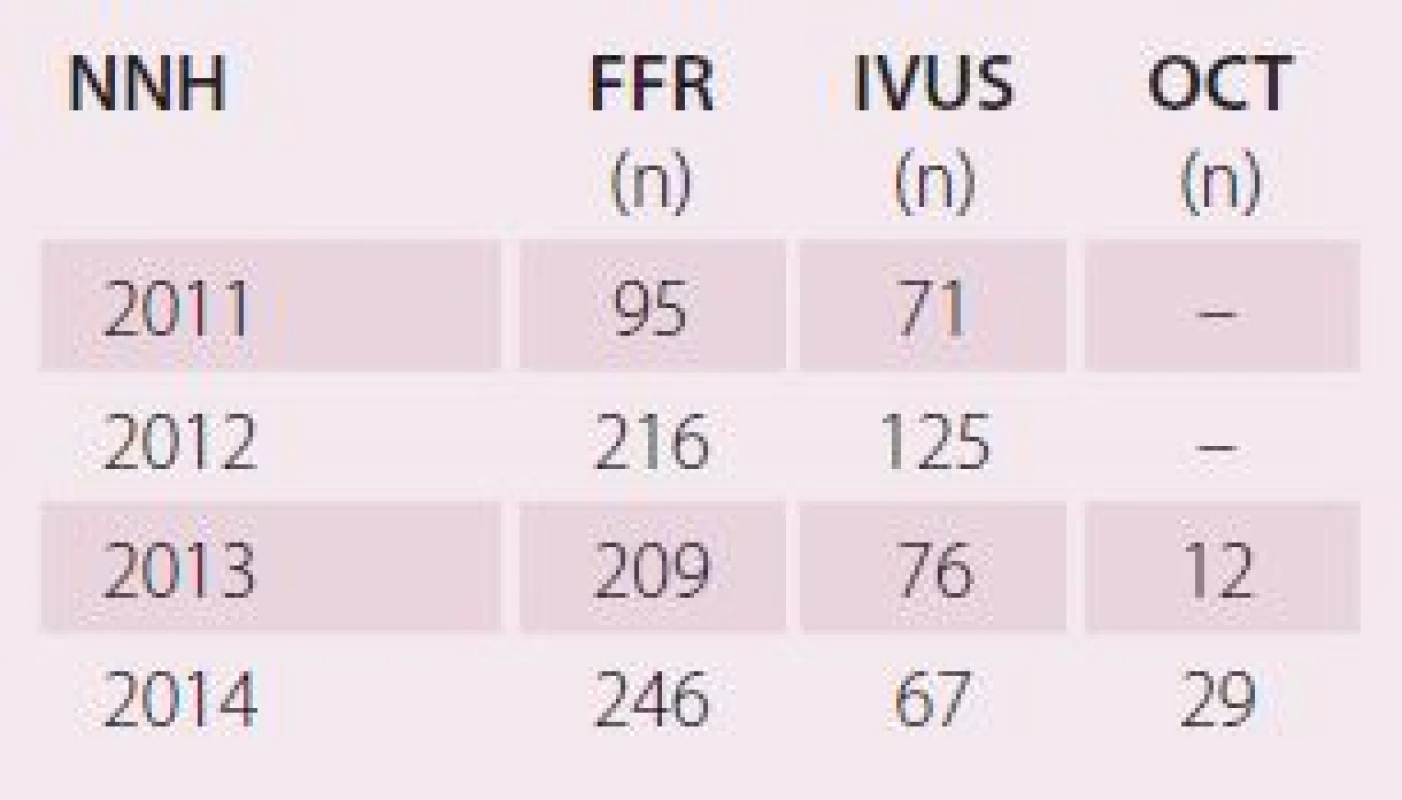
Zastoupení jednotlivých metod na našem pracovišti v posledních čtyřech letech ukazuje tab. 1.
Lékové stenty
První metalický stent byl implantován v roce 1986 (Puel a Sigwart), kdy důvodem byla prevence akutního uzávěru tepny po samotné balonkové dilataci stenózy (POBA) a redukce výskytu restenózy, která se po POBA vyskytovala až v 30 – 40 %. V dalších letech se ukázalo, že také při použití metalických stentů (bare metal stent – BMS) vzniká restenóza až u 20 – 30 % léčených pacientů. Jejím podkladem je neointimální hyperplazie, komplexní reakce stěny tepny zahrnující proliferaci a migraci buněk hladkého svalstva medie do tzv. neointimy, která vzniká během prvních 6 – 9 měsíců po implantaci stentu. Jde o reakci na mechanické poškození stěny cévy při implantaci stentu a dilataci balonku, kterou představuje zánětlivá lokální reakce. Již v roce 2001 byly do klinické praxe zavedeny lékové stenty (DES) s cílem omezení rozsahu restenózy a nutnosti opakované intervence. První látky, které byly na povrchu stentu použity, byly paclitaxel a sirolimus. Pilotní, ale i následné klinické studie ukázaly, že výskyt restenózy přímo v lékovém stentu („in stent“ restenóza) či v jeho bezprostředním okolí („in segment“ restenóza) je při užití DES o řád nižší proti běžným metalickým stentům. Podstatou účinku DES je inhibice proliferace neointimy, nedochází tedy k její excesivní tvorbě, která nastávala po implantaci běžných kovových stentů. Již v jedné z prvních studií SIRIUS dosáhlo snížení výskytu restenózy 92 %. Též v podskupině diabetiků léčených PCI s použitím sirolimem krytého stentu bylo prokázáno 83% snížení vzniku restenózy ve stentu [1]. Ještě lepších výsledků je pak dosahováno při použití nových generací DES s více účinnými analogy sirolimu. Například u téměř 4 000 pacientů s implantovaným stentem uvolňujícím everolimus (SPIRIT ‑ IV trial) byl primární endpoint nutnosti opakované revaskularizace intervenované léze v jednom roce signifikantně nižší [15]. Obdobné výsledky pak přinesly i studie COMPARE, RESOLUTE „all‑comers“ a PLATINUM.
Schválené indikace DES
V současné době jsou známé výsledky více než sta randomizovaných klinických studií s DES a desítky různých typů lékových stentů obdržely CE značku. V USA byly k použití lékových stentů FDA vybrány pouze stenty hodnocené v randomizovaných studiích s více než 1 000 nemocnými, které pro každý z typů DES prokazovaly ve srovnání s BMS statisticky významné snížení nutnosti následné revaskularizace ošetřené tepny v době do devíti měsíců od implantace. Doba sledování pacientů zařazených do stěžejních studií byla určena na pět let [16,17]. Primárně se jednalo o stabilní formy ICHS a méně komplexní léze, nicméně v běžné klinické praxi 50 – 80 % léčených pacientů tato kritéria nesplňovalo. Proto byly na základě příznivých výsledků klinické praxe indikace DES postupně rozšířeny pro komplexní léze (postižení více věnčitých tepen, chronické okluze, bifurkační léze, žilní bypassy), ale i na skupinu akutních koronárních syndromů, což se odrazilo i v současně platných doporučeních Evropské kardiologické společnosti. DES zde mají jednoznačné doporučení pro pacienty s akutními koronárními syndromy (STEMI i non‑STEMI), pro pacienty s diabetes mellitus, pro restenózu a pro pacienty s renální insuficiencí [13].
Nové DES
Vývoj lékových stentů je kontinuální proces se snahou o zvýšení efektivnosti a bezpečnosti instrumentária. Jedním z důležitých parametrů, který je dlouhodobě diskutován, je krytí povrchu stentů polymery, jež představují nosné medium pro postupné uvolňování v nich obsažené účinné látky. V prvních generacích DES se jednalo o trvalé polymery, které se následně ukázaly jako jedna z možných příčin pozdní trombózy stentu [18,19].
Proto byly postupně vyvinuty stenty s biokompatibilními, resp. biodegradabilními polymery, které se po uvolnění účinné látky (to se děje v řádech měsíců) vstřebají, a je tak umožněna rychlejší a kompletní endotelizace stentu, a tak je sníženo riziko pozdní či velmi pozdní (po jednom roce od implantace) trombózy stentu (například stenty Biomatrix, Biosensors). V případě použití DES ve spojení s biodegradabilním polymerem je dvouletý kumulativní výskyt trombózy stentu (definitivní a pravděpodobné) relativně nízký (přibližně 0,8 %), s většinou příhod charakterizovaných jako subakutní trombóza. Další možností je aplikace účinné látky na povrch stentu bez využití polymeru – jedná se o tzv. fokální abluminální rezervoáry s účinnou látkou (sirolimus + mastná kyselina s dlouhými řetězci), kdy jde o kontrolované a na endotel cílené uvolnění léku během tří měsíců po implantaci (stent Cre8, Alvimedica). V některých případech je využito současné krytí luminálního povrchu stentu antitrombotickými látkami (ultratenká vrstva 0,3 µm karbonového krytí) nebo médiem vedoucím k urychlení kompletní endotelizace stentu – receptory pro EPC (endoteliální progenitorové buňky). Současně je snaha o použití co nejnižší dávky antiproliferativního léku při zachování jeho efektu. Dalším problémem v souvislosti s implantací stentu je negativní ovlivnění vazomotorických vlastností ošetřeného úseku tepny. Implantovaný stent může také představovat mechanickou překážku při nutnosti další intervence, omezení přístupu do postranní větve a případně může i bránit případné následné chirurgické revaskularizaci. Zásadní inovací poslední doby je pak vstřebatelný (biodegradabilní) stent, který je již aktuálně k dispozici i pro klinické použití. Základem jeho struktury je kyselina mléčná, která se zhruba po šesti měsících od implantace začíná rozpadat a nakonec po přibližně dvou letech dojde ke kompletní degradaci materiálu stentu a ošetřený segment je takto znovu v „původním“ stavu. Stent je navíc kryt antiproliferativní látkou, analogem sirolimu everolimem (Absorb BVS) (obr. 6) [20]. Poslední generace lékových stentů se od předchozích liší svými podstatně lepšími mechanickými vlastnostmi, které umožňují nové použité materiály konstrukce stentu (slitiny chrom ‑ kobalt, chrom ‑ platina), s menší tloušťkou strutů stentu (70 – 80 µm oproti 120 µm u starší generace DES). To znamená také jejich snazší manipulaci, rozšiřuje možnosti použití na komplexní, složité léze a umožňuje lepší přístup do bočních větví u bifurkačních lézí.

Antitrombotická léčba v roce 2015
Duální antiagregační léčba
Doba trvání duální antiagregační léčby (tedy podávání kyseliny acetylosalicylové (ASA) a inhibitoru receptorů P2Y12) je aktuálně stanovena pro DES u stabilních forem ICHS v délce šesti měsíců. Za určitých okolností a u některých typů DES může být dostačující i léčba po dobu tří měsíců, ale evidence není dostatečně silná [21]. U nemocných se STEMI je doporučeno podat P2Y12 inhibitor (clopidogrel, ticagrelor, prasugrel) již v době prvního kontaktu se zdravotní službou, ihned po stanovení diagnózy. Rezistence na ASA se vyskytuje u 5 – 45 % nemocných, rezistence na clopidogrel u 4 – 30 % nemocných. Duální rezistenci je možné nalézt přibližně u 6 % nemocných, u tohoto typu rezistence byl prokázán vyšší výskyt subakutní trombózy stentu. Nemocní, u kterých došlo ke vzniku trombózy, měli kombinovanou rezistenci v 52 %, v kontrolní skupině to bylo pouze v 11 % [22].
Doporučené postupy podávání antiagregační léčby a dosavadní evidence
Stabilní ICHS
Protidestičková léčba po implantaci stentu:
Duální protidestičková léčba (DAPT) je indikována po implantaci BMS na dobu jednoho měsíce. IA.
Duální protidestičková léčba (DAPT) je indikována po implantaci DES na dobu šesti měsíců. IA.
Kratší doba DAPT (< 6 měsíců) může být zvážena po implantaci DES u pacientů s vysokým rizikem krvácení. Indikace IIB.
Celoživotní léčba jedním protidestičkovým lékem, obvykle ASA, je doporučena. Indikace IA.
Akutní koronární syndrom bez elevací ST segmentů
ASA je doporučena pro všechny pacienty, kteří nemají kontraindikace jako iniciální nasycovací dávka 150 – 300 mg p.o. (nebo 80 – 150 mg i.v.), a dále pak udržovací dávka 75 – 100 mg denně. IA.
Inhibitor destičkových receptorů P2Y12 je doporučen společně s ASA po dobu 12 měsíců, pokud nejsou kontraindikace jako excesivně vysoké riziko krvácení. IA.
Možnosti jsou:
Prasugrel (60 mg nasycovací dávka a 10 mg udržovací dávka) u pacientů se známým angiografickým nálezem a indikací k provedení PCI, pokud nejsou kontraindikace. IB.
Ticagrelor (180 mg nasycovací dávka a 90 mg udržovací dávka) u pacientů se středním až vysokým rizikem ischemických příhod bez ohledu na iniciální léčebnou strategii = konzervativní/ intervenční léčba, pokud nejsou kontraindikace. IB.
Clopidogrel (600 mg nasycovací dávka a 75 mg udržovací dávka) tam, kde nejsou dostupné prasugrel či ticagrelor nebo jsou‑li tyto léky kontraindikovány. IB.
Infarkt myokardu s elevací ST segmentů
ASA je doporučena pro všechny pacienty, kteří nemají kontraindikace jako iniciální nasycovací dávka 150 – 300 mg p.o. (nebo 80 – 150 mg i.v.), a dále pak udržovací dávka 75 – 100 mg denně. IA.
Inhibitor destiček P2Y12 je doporučen společně s ASA po dobu 12 měsíců, pokud nejsou kontraindikace jako excesivně vysoké riziko krvácení. IA.
Je doporučeno podat P2Y12 inhibitor v době prvního kontaktu se zdravotní služ-bou. IB.
Možnosti jsou:
Prasugrel (60 mg nasycovací dávka a 10 mg udržovací dávka), pokud nejsou kontraindikace. IB.
Ticagrelor (180 mg nasycovací dávka a 90 mg udržovací dávka), pokud nejsou kontraindikace. IB
Clopidogrel (600 mg nasycovací dávka a 75 mg udržovací dávka) tam, kde nejsou dostupné prasugrel či ticagrelor nebo jsou‑li tyto léky kontraindikovány. IB
Poznámky
IA, IB – jednoznačná shoda o vhodnosti tohoto léčebného postupu.
IIA – daný léčebný postup je spíše doporučen.
IIB – daný léčebný postup může být zvážen.
III – daný léčebný postup není doporučen.
Závěry
Koronární intervence jsou v současné době jednou z rutinních metod revaskularizace myokardu jak u stabilních nemocných, tak u akutních koronárních syndromů. Ke zlepšení jejich časných i dlouhodobých výsledků přispěly v posledních letech jednak novější techniky v oblasti diagnostiky, jednak nové technologie používaných koronárních stentů. Tyto lékové a jiné stenty reprezentují důležitý pokrok v léčbě ischemické choroby srdeční a mnoha pacientům přinesly prospěch – významně snižují riziko restenózy ve všech klinických indikacích, zvláště pak u více komplexních lézí. Současně je nutná správná indikace jejich použití s maximalizací prospěchu, který pacientům nabízejí. Ten dosahujeme u těch nemocných, kde je intervence primárně adekvátně indikována (intervenovány jsou funkčně významné stenózy – FFR) a je dosaženo optimálního primárního výsledku PCI, čemuž významně napomáhají nové možnosti detailního pohledu do lumen tepny a na strukturu stěny věnčitých tepen (IVUS a OCT). Použitím těchto nových metod minimalizujeme riziko časné i pozdní trombózy stentu a pozdějšího rozvoje restenózy. V popředí dalšího vývoje technologií jsou biodegradabilní stenty, kde můžeme očekávat další vývoj – zdokonalování jejich designu tak, aby se mechanické vlastnosti těchto stentů v časné fázi po implantaci co nejvíce blížily dříve používaným kovovým stentům – mají vyšší radiální sílu. Tyto stenty budou v randomizovaných studiích dále zkoušeny u komplexních lézí. Pokračovat bude i snaha o zdokonalení stentů ze slitiny magnézia. Dalším faktorem, který má jednoznačně vliv na využití DES, jsou nové antiagregační látky, které jsou účinnější a mají lépe kontrolovatelný efekt než clopidogrel.
Doručeno do redakce: 6. 8. 2015
Přijato po recenzi: 18. 8. 2015
MUDr. Ondřej Aschermann
www.homolka.cz
ondrej.aschermann@seznam.cz
Zdroje
1. Moses JW, Leon MB, Pompa JJ et al. SIRIUS Investigators. Sirolimus eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med 2003; 349 : 1315 – 1323.
2. Mintz GS, Nissen SE, Anderson WD et al. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement, Reporting of Intravascular Ultrasound Studies (IVUS). A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol 2001; 37 : 1478 – 1492.
3. Mates M, Hrabos V, Hajek P et al. Long‑term follow‑up after deferral of coronary intervention based on myocardial fractional flow reserve measurement. Coron Artery Dis 2005; 16 : 169 – 174.
4. White CW, Wright CB, Doty DB et al. Does visual interpretation of the coronary arteriogram predict thephysiological importance of a coronary stenosis. N Engl J Med 1984; 310 : 819 – 824.
5. Uren NG, Melin JA, De Bruyne B et al. Relation between myocardial blood flow and the severity of coronary artery stenosis. N Engl J Med 1994; 330 : 1782 – 1788.
6. Tonino PA, Fearon WF, De Bruyne B et al. Angiographic versus functional severity of coronary artery stenoses in the FAME study fractional flow reserve versus angiography in multivessel evaluation. J Am Coll Cardiol 2010; 55 : 2816 – 2821. doi: 10.1016/ j.jacc.2009.11.096.
7. Bech GJ, De Bruyne B, Pijls NH et al. Fractional flow reserve to determine the appropriateness of angioplasty in moderate coronary stenosis: a randomized trial. Circulation 2001; 103 : 2928 – 2934.
8. Pijls NH, De Bruyne B, Peels K et al. Measurement of fractional flow reserve to assess the functional severity of coronary ‑ artery stenoses. N Engl J Med 1996; 334 : 1703 – 1708.
9. Bartunek J, Marwick TH, Rodrigues AC et al. Dobutamine‑induced wall motion abnormalities: correlations with myocardial fractional flow reserve and quantitative coronary angiography. J Am Coll Cardiol 1996; 27 : 1429 – 1436.
10. Pijls NH, van Schaardenburgh P, Manoharan G et al. Percutaneous coronary intervention of functionally nonsignificant stenosis: 5‑year follow‑up of the DEFER Study. J Am Coll Cardiol 2007; 49 : 2105 – 2111.
11. Yamaguchi T, Terashima M, Akasaka T et al. Safety and feasibility of an intravascular optical coherence tomography image wire system in the clinical setting. Am J Cardiol 2008; 101 : 562 – 567. doi: 10.1016/ j.amjcard.2007.09.116.
12. Matsumoto D, Shite J, Shinke T et al. Neointimal coverage of sirolimus‑eluting stents at 6 – month follow‑up: evaluated by optical coherence tomography. Eur Heart J 2007; 28 : 961 – 967.
13. Windecker S, Kohl P, Alfonso F et al. 2014 ESC/ EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio ‑ Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J 2014; 35 : 2541 – 2619. doi: 10.1093/ eurheartj/ ehu278.
14. Prati F, Di Vito L, Biondi ‑ Zoccai G et al. Angiography alone vs. angiography plus optical coherence tomography to guide decision ‑ making during percutaneous coronary intervention: the Centro per la Lotta contro l’Infarto ‑ Optimisation of Percutaneous Coronary Intervention (CLI ‑ OPCI) study. EuroIntervention 2012; 8 : 823 – 829.
15. Stone GW, Rizvi A, Newman et al. Everolimus‑eluting versus paclitaxel‑eluting stents in coronary artery disease. N Engl J Med 2010; 362 : 1663 – 1674. doi: 10.1056/ NEJMoa0910496.
16. Cypher sirolimus eluting coronary stent on Raptor over ‑ the ‑ wire delivery system – P020026: proval order. Rockwile, MD: Food and Drug Administration, 2003. [online] Available from: www.accessdata.fda.gov/ cdrh_docs/ pdf3/ P020026a.pdf.
17. Taxus Express2 paclitaxel‑eluting coronary stent system (monorail and over ‑ thewire) P030025: proval order. Rockwile, MD: Food and Drug Administration, 2003. [online] Available from: www.fda.gov/ cdrh/ pdf3/ P030025.html.
18. Joner M, Finn AV, Farb A et al. Pathology of drug‑eluting stents in humans: delayed healing. J Am Coll Cardiol 2006; 48 : 193 – 202.
19. Serruys PW, Daemen J. Are drug‑eluting stents associated with a higher rate of late thrombosis than bare metal stents ? Late stent thrombosis: a nuisance in both bare metal and drug‑eluting stents. Circulation 2007; 115 : 1433 – 1439.
20. Serruys PW, Ormiston J, Onuma Y et al. Absorb trial first ‑ in ‑ man evaluation of a bioabsorbable everolimus‑eluting coronary stent system: two‑year outcomes and results from multiple imaging modalities. Lancet 2009; 373 : 897 – 910. doi: 10.1016/ S0140 – 6736(09)60325 – 1.
21. Gershlick A, Kandzari DE, Leon MB et al. Zotarolimus‑eluting stents in patients with native coronaryartery disease: clinical and angiographic outcomes in 1,317 patients. Am J Cardiol 2007; 100 : 45M – 55M.
22. Wenaweser P, Dörffler ‑ Melly J, Imboden K et al. Stent thrombosis is associated with an impaired response to antiplatelet therapy. J Am Coll Cardiol 2005; 45 : 1748 – 1752.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2015 Číslo 3
-
Všechny články tohoto čísla
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
- Novinky v koronárních intervencích
- Mnohočetné postižení věnčitých tepen diagnostikované při pPCI pro STEMI: kompletní revaskularizace nebo konzervativní léčba. Studie Prague‑ 13.
- Erratum - Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Farmakologická a nefarmakologická léčba fibrilace síní – současný pohled
- Léčebné postupy u námahové anginy pectoris
- Srdeční zástava a poresuscitační péče
- Komentovaná zkrácená verze evropských doporučení pro diagnostiku a management akutní plicní embolie z roku 2014
- Co přinesla nová evropská guidelines pro trvalou kardiostimulaci a srdeční resynchronizační léčbu (2013) v oblasti diagnostiky arytmií pomocí dlouhodobého monitorování EKG – současné technické aspekty a typy dlouhodobého monitorování EKG
- Fixní trojkombinace antihypertenziv a subklinické orgánové poškození – kazuistika
- Studie IMPROVE‑ IT u pacientů s diabetes mellitus
- Studie TECOS – efekt sitagliptinu na kardiovaskulární příhody u diabetes mellitus 2. typu
- Co zaznělo v HOT lines na ČKS 2015
- Co zaznělo na ESC 2015
- 500 transplantací srdce v Brně
- 25th European Meeting on Hypertension and Cardiovascular Protection, Milan 2015
- Zemřel prof. MUDr. Miloš Štejfa, DrSc., FESC28. 5. 1929– 20. 5. 2015
- Vzpomínka na prof. Miloše Štejfu
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Srdeční zástava a poresuscitační péče
- Léčebné postupy u námahové anginy pectoris
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
