Pleurální výpotky – etiologie a diagnostika
Pleural effusion – aetiology and diagnostics
The main mechanisms of transudative and exudative pleural effusions formation are discussed together with diagnostic processes aiming to differentiate exudates from transudates as well as to determine the aetiology of the effusion.
Keywords:
pleural effusion – exudate – transudate
Autoři:
F. Salajka
Působiště autorů:
Plicní klinika LF UK a FN Hradec Králové
Vyšlo v časopise:
Kardiol Rev Int Med 2009, 11(4): 181-186
Kategorie:
Sympozium o primárních a nejčastějších sekundárních plicních hypertenzích
Souhrn
Jsou probrány základní mechanizmy tvorby pleurálního výpotku u exsudátů a transsudátů a diagnostické postupy zaměřené jak na rozlišení exsudátů od transsudátů, tak na stanovení etiologie výpotku.
Klíčová slova:
pleurální výpotek – exsudát – transsudát
Úvod
Pleura je serózní blána pokrývající povrch plic a vystýlající vnitřní stranu hrudního koše. Viscerální list pleury sleduje anatomickou stavbu plic, zabíhá hluboko do mezilalokových štěrbin a v oblasti plicní stopky přechází do parietální pleury. Celkový povrch pleury se u průměrně velkého dospělého člověka odhaduje na 4 000 cm2 [1]. Mezi parietální a viscerální pleurou je malá štěrbinka umožňující vzájemný pohyb obou listů po sobě. Mezi faktory umožňující hladké klouzání pleurálních listů patří pleurální tekutina, jejíž množství je za fyziologických podmínek odhadováno od 0,3ml/kg váhy po celkový objem v pravé i levé pleurální dutině zhruba 8,4 ± 4,3ml [2–3].
Původ pleurální tekutiny
Anatomicky je pleura tvořena vrstvou mezenchymálních buněk, pod nimiž je bazální membrána, dále vrstva elastického vaziva, vrstva řídké pojivové tkáně, ve které jsou uloženy nervy a krevní a lymfatické cévy, a hlubší vazivově elastická vrstva [4]. Povrch mezoteliálních buněk je zvětšen četnými 1–3 µm dlouhými mikroklky, jejichž hustota kolísá mezi 2–30 µm–2. Tyto mikroklky také přispívají ke snížení tření mezi parietálním a viscerálním listem pleury, protože jsou mezi nimi uchyceny glykoproteiny bohaté na hyaluronovou kyselinu, secernovanou mezoteliálními buňkami [1]. Intercelulární spojení mezoteliálních buněk, jejichž tloušťka se pohybuje kolem 2–4 µm, je organizováno podobně jako spojení cévních endotelií. Otvory mezi těmito spojeními umožňují difuzi malých molekul, pro něž je permeabilita mezotelií srovnatelná s permeabilitou mikrovaskulárních endotelií. Odstraňování větších molekul proteinů se děje prostřednictvím otvorů lymfatických cév.
Transfer tekutin a roztoků přes buněčnou membránu je nejlépe možné vysvětlit existencí kanálů – pórů, které jsou dvojího druhu. Jednak jde o poměrně početné malé póry o průměru 4–5 nm, kterými prochází malé molekuly až do velikosti inulinu, jednak méně časté (1 : 1 000–1 : 4 000) větší póry průměru 20–30 nm; na transportu velkých molekul se také účastní mechanizmus vezikulárního transportu – transcytózy. Kaudální část mediastinální a interkostální pleury a brániční pleura obsahují otvory o průměru 1–6 µm (stomata), kterými ústí do pleurálního prostoru lymfatické cévy. Stomata představují jedinou možnost odstranění buněk a částic z pleurálního prostoru, zatímco proteiny mohou být odstraňovány i zmíněným aktivním buněčným transportem (transcytózou) [1].
Anatomické a funkční vlastnosti obou pleurálních listů určují množství a složení pleurální tekutiny. Za fyziologických okolností složení pleurální tekutiny odpovídá plazmatickému filtrátu přes dvě membrány podobných vlastností tvořených kapilárními endoteliemi a pleurálními mezoteliemi. Koncentrace proteinů v pleurální tekutině a jejich poměr k hladině plazmatických proteinů je nízký, přičemž albumin tvoří významnější složku proteinového spektra než v plazmě. Koncentrace Na a Cl je nižší než v séru, hladina glukózy je srovnatelná a koncentrace HCO3 je vyšší, stejně jako pH (kolem 7,6) [1]. Pleurální tekutina obsahuje kolem 1 700 buněk/mm3, z toho 75% makrofágů, 23% lymfocytů a 1% mezoteliálních buněk [3]. Objem tekutiny v pleurálním prostoru je určován rovnováhou mezi přitékající a odtékající tekutinou, která je ovlivňována její filtrací parietální pleurou a následnou absorbcí viscerální pleurou podle Starlingova zákona, lymfatickou drenáží stomaty parietální pleury a absorbcí vázanou na elektrolyty. Podstatně větší tloušťka viscerální pleury než je tloušťka pleury parietální spolu s dalšími jejími vlastnostmi mají za následek, že podíl tekutiny vstřebané touto cestou do plicního intersticia je malý; většina tekutiny je odstraňována prostřednictvím lymfatických cév (přímou drenáží stomaty nebo přestupem z intersticia) parietální pleury. Tato cesta tedy představuje hlavní mechanizmus odstraňování tekutiny z pleurálního prostoru, jejíž denní obrat se na základě zvířecích modelů odhaduje na 100–200ml/den [1] (obr. 1).
![Schéma obratu tekutiny v pleurálním prostoru [podle 1].
1. transport tekutiny na základě Starlingova zákona z kapilár do intersticia, parietální pleurou do pleurálního prostoru a odtud viscerální pleurou do plicního intersticia, odkud je odváděna lymfatickými cévami; 2. drenáž tekutiny s elektrolyty i s většími molekulami, částicemi i buňkami lymfatickými stomaty; 3. transport tekutiny s elektrolyty i s menšími molekulami pleurálními póry; 4. transport tekutiny s elektrolyty i s většími molekulami transcytózou; (tloušťka pleurálních listů a velikost šipek znázorňujících obrat pleurální tekutiny není proporcionální).](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/85d626e8b47c78331b755d9548878282.png)
Tvorba pleurálního výpotku
Vznik pleurálního výpotku je důsledkem překročení rezervní kapacity pleurálního prostoru pro vstřebávání většího množství tekutiny, která se odhaduje na několik stovek ml denně [5]. Příčiny vzniku pleurálního výpotku mohou být rozděleny do tří základních skupin:
- změna rovnováhy transpleurálních tlaků
- porucha lymfatické drenáže
- zvýšení permeability mezotelií a kapilárního endotelu
Faktory z první skupiny jsou obvykle spojeny s extrapleurální patologií, situace ve druhé skupině se mohou týkat pleurálních nebo extrapleurálních lymfatických cév, zatímco třetí skupina je obvykle spojena s patologickým postižením pleurálních mezotelií. Z výše uvedených zákonitostí koloběhu tekutiny v pleurálním prostoru vyplývá, že na rozdíl od první skupiny je ve výpotcích vyvolaných mechanizmem druhé či třetí skupiny zvýšená koncentrace proteinů [2].
Výpotky vzniklé mechanizmem popsaným v bodě 1 jsou obvykle transsudáty. Nejčastější příčinou transsudátů je srdeční selhání. Přítomnost pleurální tekutiny je možné prokázat u velké části těchto pacientů. Zvýšený kapilární tlak v plicích při selhání levé komory zvyšuje průnik tekutiny do plicního intersticia, alveolů a pleurálního prostoru. Vzhledem k intaktnímu kapilárnímu endotelu je zastoupení proteinů a buněk nízké. Dalším přispívajícím faktorem může být zvýšení systémového žilního tlaku zvyšující filtraci tekutiny z parietálních kapilár a současně snižující lymfatickou drenáž zvýšením vyprazdňovacího tlaku torakálního duktu [6]. Dominujícím mechanizmem vzniku transsudátu kardiální etiologie je tedy zvýšení kapilárního tlaku v plicích [2]. Nemocní s kardiálním selháním provázeným výpotkem mají signifikantně vyšší kapilární tlak než nemocní bez výpotku, zatímco tlak v pravé síni se u těchto dvou skupin neliší [7].
Transsudát se objevuje u malé části (cca 6%) nemocných s jaterní cirhózou, nejčastěji jednostranně – vpravo. Téměř vždy je u těchto nemocných prokazatelná i přítomnost ascitu. Kromě hypalbuminemie a z ní vyplývajícího snížení plazmatického onkotického tlaku je množství tekutiny v pohrudniční dutině určováno také přímým přestupem ascitické tekutiny defekty v bránici, které jsou většinou mikroskopické velikosti. Stejným mechanizmem, tedy přestupem tekutiny bráničními defekty, je vysvětlován vznik fluidotoraxu u pacientů léčených peritoneální dialýzou. Přestup moče při urinotoraxu, který může být komplikací obstrukce močových cest, traumatu, renální biopsie nebo nádoru, se děje šířením moče v retroperitoneálním prostoru s následným přestupem bráničními lymfatickými cévami. Přítomnost intrapleurální tekutiny u nefrotického syndromu, lokalizovaná oboustranně a často subpulmonálně, je výsledkem retence solí a hyperhydratace. Menší výpotky, které je možné pozorovat u plicních atelektáz, jsou dávány do souvislosti s poklesem intratorakálního tlaku [6].
Exsudát vzniká tehdy, když je porušeno odstraňování proteinů a buněčných elementů z pleurální dutiny, nebo naopak když se tyto dostávají do pleurální dutiny v důsledku zvýšené prostupnosti mezoteliální membrány. Poškození lymfatické drenáže může nastat v důsledku zánětlivé nebo maligní infiltrace pleury nebo blokádou lymfatických stomat fibrinovými depozity. Příčinou také může být extrapleurální poškození lymfatických cév, jako jsou hypoplazie lymfatického systému, obstrukce mediastinálních lymfatických cév nebo ductus thoracicus. Určitou úlohu může hrát i zvýšení žilního tlaku v důsledku zvýšení výtokového tlaku v ductus thoracicus. Nejčastěji jsou exsudáty spojeny se zvýšenou vaskulární a mezoteliální permeabilitou. K tomuto zvýšení vedou dva základní mechanizmy – otevření nových pórů mezi jednotlivými buňkami nebo vznik nových transcelulárních cest pravděpodobně splynutím cytoplazmatických vezikulů s buněčnou membránou. V prvním případě je zvýšená prostupnost pro vodu a malé molekuly bez zvýšené propustnosti pro makromolekuly, zatímco ve druhém případě je zvýšen i prostup makromolekul. Podobné mechanizmy působí i na úrovni pleurálních mezotelií [2].
V modelovém případě subpleurálně uloženého plicního zánětu nejprve dojde k uvolnění tekutiny bohaté na proteiny do plicního intersticia v důsledku zvýšení hydraulického tlaku v plicních kapilárách a zvýšené propustnosti kapilárních endotelií. Zvýšení tlaku v plicním intersticiu při dosud zachovalé (ne)propustnosti mezotelií se projeví tvorbou výpotku charakteru transsudátu. Situace se ale velmi rychle změní poškozením mezotelií zánětlivými buňkami a mediátory se ztrátou bariérové selektivity a vznikem malého sterilního, na polymorfonukleáry bohatého výpotku. V dalším stadiu, když se zvětšuje endoteliální a mezoteliální poškození, se tvorba výpotku zvyšuje, do pleurálního prostoru mohou přestoupit bakterie se vznikem fibrinopurulentního zánětu a oba pleurální listy se pokryjí fibrinovou vrstvou, což dále sníží drenáž tekutiny [2]. Tvorba fibrinové vrstvy je podporována poruchou metabolizmu fibrinu se zvýšením prokoagulační a snížením fibrinolytické aktivity přítomnou u exsudátů; zajímavé je, že u transsudátů je tomu naopak [8].
Nejčastější typy výpotků
Údaje o častosti výskytu jednotlivých typů pleurálních výpotků se liší zejména v závislosti na typu hodnotícího pracoviště a na výběru nemocných – zda jde o celkový výskyt nebo o výpotky vyšetřované. Souhrn nejčastějších etiologických faktorů spojených s tvorbou výpotku ukazuje tab. 1. Podle klinických zkušeností pneumologických pracovišť je nejčastějším výpotkem vyžadujícím zařazení do vyšetřovacího programu výpotek maligní nebo paramaligní [10].
![Etiologie pleurálních výpotků [podle 9].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/4020071b7a6a695de4ab5b0dda1e7812.png)
Maligní pleurální výpotek vzniká v důsledku šíření nádoru na viscerální nebo parietální pleuru, což je prokázáno nejčastěji cytologickým vyšetřením pleurální tekutiny. Nádory stojí v pozadí více než poloviny velkých (nejméně 2/3 hemitoraxu na zadopředním snímku hrudníku) a masivních (celý hemitorax) výpotků [11]. Nejčastější příčinou maligních výpotků – asi u třetiny pacientů – bývá rakovina plic, následovaná rakovinou prsu a lymfomy. Výpotky se v některé fázi choroby objevují přibližně u 10% nemocných s nádorovou diagnózou. Asi u 5–10% nemocných s metastatickým postižením pleury se nepodaří primární tumor prokázat [12].
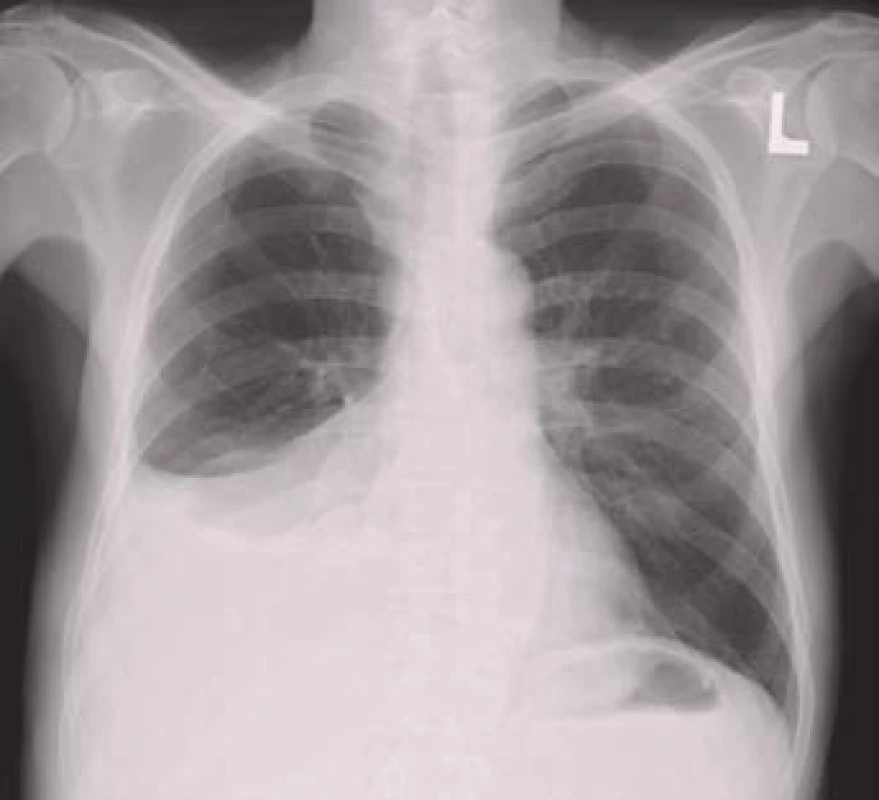
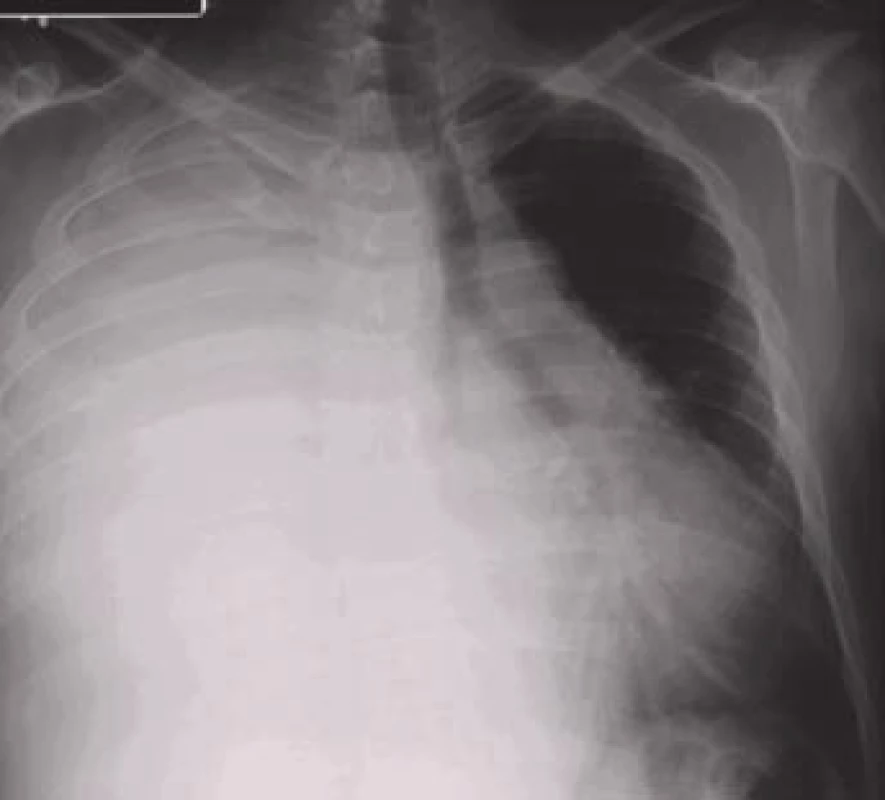
Termínem paramaligní výpotek se označují výpotky, které nevznikají v důsledku nádorového postižení pleury, ale přesto mají k primárnímu tumoru vztah. Nejsou tedy výsledkem maligní infiltrace pleury a neprokazujeme v nich maligní buňky. Mezi mechanizmy patří lokální vlivy nádoru (lymfatická obstrukce, bronchiální obstrukce s pneumonií a/nebo atelektázou, chylotorax, syndrom horní duté žíly), systémové účinky nádoru (plicní embolizace, hypalbuminemie) a komplikace související s radioační nebo cytostatickou léčbou [13].
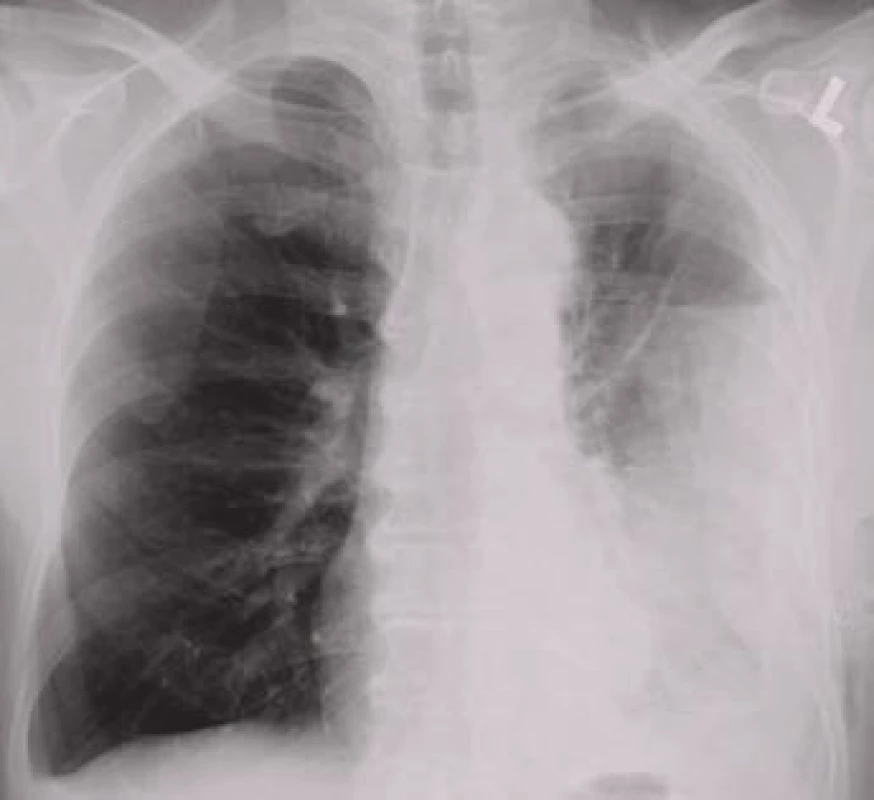
Parapneumonický výpotek je výpotek spojený se stejnostranným infekčním postižením plicního parenchymu. Mechanizmem uvedeným výše se objeví až u 57% nemocných hospitalizovaných pro pneumonii [14]. Komplikovaný parapneumonický výpotek je již výrazem přestupu infekce do pleurální dutiny; dosáhne li koncentrace bílých krvinek takového stupně, že výpotek má charakter hnisu, mluvíme o empyému [15]. Parapneumonické výpotky se bez adekvátní léčby obvykle vyvíjejí ve čtyřech stadiích. Stadium suché pleuritidy odráží počínající reaktivní postižení viscerálního listu pohrudnice. V exsudativním stadiu dojde v důsledku zvýšené permeability kapilárního endotelu a mezotelu k tvorbě výpotku. Přestup infekce do pleurální dutiny je charakteristický pro třetí, fibropurulentní stadium, kdy dochází k tvorbě fibrinových sraženin a membrán; v této fázi může vzhled výpotku nabýt charakteru empyému. V konečném stadiu organizujícího se výpotku fibroblasty přemění fibrinové membrány do tuhých vazivových povlaků [15].
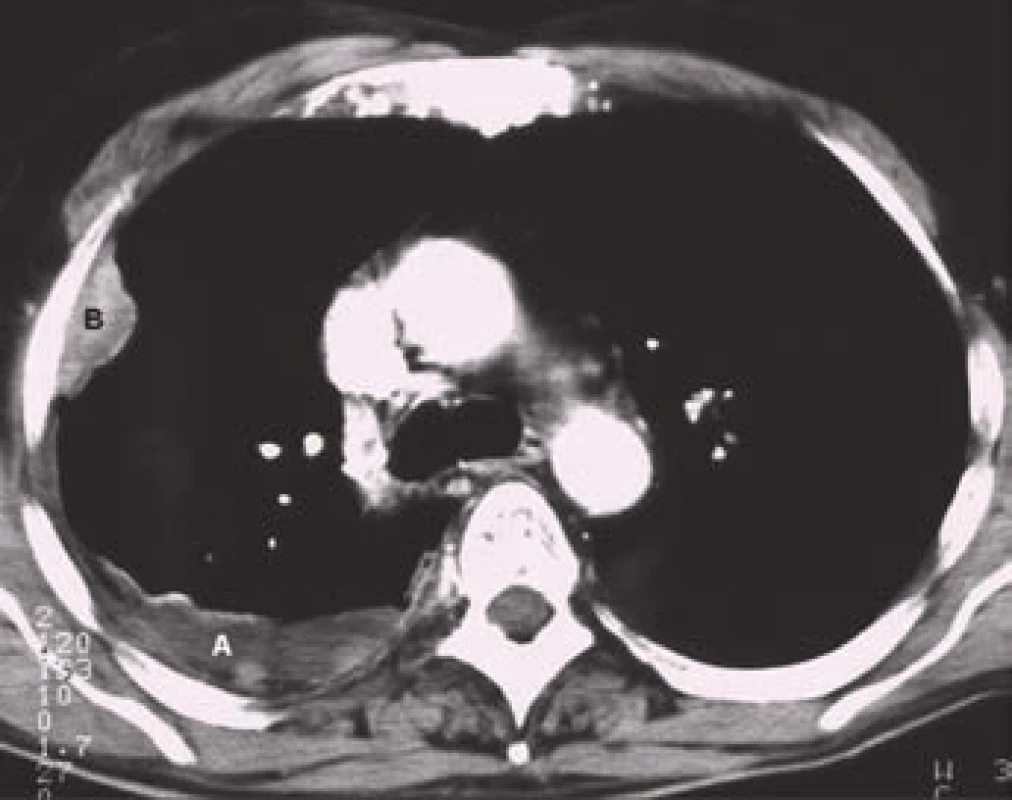
Pleurální výpotek tuberkulózního původu se objevuje přibližně u 5% nemocných s tuberkulózou plic. Typicky jde o jednostranné výpotky malé až střední velikosti, častěji se vyskytující u mladších osob. Tuberkulózní empyém je mnohem vzácnější a jeho vznik může mít několik příčin: progresi primárního tuberkulózního pleurálního výpotku, přímý přestup infekce do pleurálního prostoru z hrudních lymfatických uzlin nebo podbráničního ložiska, hematogenní rozsev, chronické empyémy mohou souviset i s resekční léčbou nebo kolapsoterapií. Tyto situace jsou již v současné době ojedinělé [16].
U nemocných se systémovými chorobami pojiva se může pleurální výpotek objevit až v 50% případů, především v souvislosti se SLE, Wegenerovou granulomatózou, revmatoidní artritidou a dalšími jednotkami. K tvorbě výpotku dochází v souvislosti s poškozením kapilárních endotelií a současně či následně mezotelií imunologickými mechanizmy [17].
Chylotorax je nahromaděním chylu v pleurální dutině. Vzhledem k průběhu ductus lymfaticus bývá většinou pravostranný. Chylus se v pohrudniční dutině nahromadí v důsledku porušení ductus thoracicus traumatem, oslabením jeho stěny nebo blokádou. K tomuto porušení může dojít mnoha mechanizmy. Jako traumatická neiatrogenní příčina může figurovat jakýkoli úraz s poškozením nebo zhmožděním hrudníku, úporný kašel nebo zvracení, porod (možnost výskytu u dítěte i matky). Traumatická iatrogenní příčina je obvykle spojena s chirurgickým výkonem na hrudníku, s ozařováním, skleroterapií jícnových varixů. Chorob, které mohou způsobit poškození ductus thoracicus, je celá řada; mezi nejčastější patří maligní nádory včetně lymfomů, některé infekce, cévní onemocnění a další [18].
Pseudochylotorax vzniká při dlouhé přítomnosti tekutiny v pleurální dutině. Tendenci k přeměně na pseudochylotorax mají výpotky přetrvávající v pleurální dutině po měsíce a roky. Cholesterol, jehož zvýšený obsah je pro tento výpotek typický, pochází pravděpodobně ze sérových lipoproteinů. Nejčastějšími příčinami jsou tuberkulózní pleuritida a výpotek při revmatoidní artritidě, dříve se tento výpotek často objevoval v souvislosti s léčebným pneumotoraxem [18].
Pleurální postižení ve formě výpotku v souvislosti s užíváním či aplikací některého léku je ve srovnání s rizikem postižení plicního intersticia nízké. Podle dosud publikovaných zkušeností je tvorba pleurálního výpotku dávána do souvislosti se zhruba 20 lékovými substancemi. Nejčastěji je výpotek spojen s aplikací některého sklerotizačního agens při léčbě jícnových varixů (výskyt ve 20–50% aplikací), dále nitrofurantoinu a metotrexatu [19].
Diagnostika pleurálních výpotků
V detekci přítomnosti pleurálního výpotku hraje klasický rentgenový snímek hrudníku úlohu spíše orientační. I při jeho provedení v poloze na boku dosahuje 100% senzitivity až tehdy, kdy množství výpotku překročí 500ml. Ultrazvuk je schopen diagnostikovat výpotky o velikosti 5–50ml a dosahuje 100% senzitivity při množství nejméně 100ml. Výhoda CT spočívá kromě simultánního zobrazení plicního parenchymu a mediastina i v přesném odlišení výpotku od pleurálního ztluštění [20].
Základním vyšetřením v diagnostice pleurálních výpotků je pleurální punkce se ziskem materiálu na další vyšetření. Torakocentéza může přinést upřesnění diagnózy a/nebo léčby až u 56% nemocných se změnou původní diagnózy u 45% pacientů [21]. Pleurální punkce nemá absolutní kontraindikaci. Mezi relativní kontraindikace patří krvácivé stavy, antikoagulační léčba, malé množství výpotku, mechanická ventilace, neschopnost pacienta spolupracovat, kožní onemocnění v místě předpokládaného vpichu [20]. Výjimkou z pravidla provést diagnostickou punkci každého zjištěného pleurálního výpotku nejasné etiologie jsou nemocní s kardiálním selháním provázeným tvorbou výpotku, u nichž by pleurální punkce měla být provedena jedině tehdy, je li přítomna jedna z následujících podmínek:
- výpotek není oboustranný a není srovnatelné velikosti,
- pacient má pleurální bolest na hrudi,
- pacient je febrilní.
Ve všech ostatních případech kardiálního selhání je punkce prováděna až tehdy, když tekutina nemizí ani po několika dnech intenzivní léčby [22]. Pleurální punkce, zejména je li prováděna pod ultrazvukovou kontrolou, je provázena jen minimem komplikací, z nichž k nejčastějším patří bolest (2,7%), dále pneumotorax (2,5%), dušnost (1,0%), kašel (0,8%) a vazovagální reakce (0,6%). Výskyt komplikací souvisí s množstvím odebraného výpotku [23]. Množství výpotku, které může být bezpečně odstraněno během pleurální punkce, není přesně známo, obvykle se udává mezi 1,0 a 1,5 litry. Při rychlém odstranění většího množství výpotku (nebo i vzduchu!) může dojít k tzv. reexpanznímu edému plic, za jehož příčinu se považuje zvýšená kapilární permeabilita způsobená mechanickým poškozením během reexpanze nebo ischemií [13]. Podle klinických zkušeností může reexpanzní plicní edém komplikovat 0,5% punkcí, při nichž bylo odstraněno více než 1 000ml [23]. Plicní objemy po punkci masivních výpotků pro dušnost stoupnou asi o třetinu objemu odstraněné tekutiny [9]. Změny PaO2, AaPO2 a velikosti intrapulmonálního zkratu po odebrání v průměru téměř 700ml nebyly prokázány [24].
Hodnocení objemu výpotku není v diagnostice jeho etiologie přínosné. Ačkoli nejčastější příčinou masivního pleurálního výpotku bývá maligní nádorový proces [13], ze samotného objemu výpotku není možné usuzovat na maligní či benigní etiologii [25]. Při posuzování fyzikálních vlastností získané pleurální tekutiny nám její zápach může určit dvě vyvolávající příčiny. Empyémy, především ty vyvolané anaerobními mikroby, se vyznačují hnilobným nepříjemným zápachem, zatímco urinózní zápach signalizuje přítomnost urinotoraxu. Je li tekutina hemoragicky zbarvena, mělo by vždy být provedeno vyšetření hematokritu. Je li jeho hodnota vyšší než 50% hodnoty v periferní krvi, mluvíme o hemotoraxu. Přítomnost krve v pleurálním výpotku je nejčastěji spojena s malignitou, plicní embolizací nebo traumatem. Je li tekutina zkalená, mléčně zbarvená nebo hemoragická, mělo by být provedeno vyšetření supernatantu po centrifugaci. Je li supernatant původně zkaleného výpotku čirý, zkalení bylo způsobeno příměsí buněk nebo detritu, zatímco přetrvává li zakalení, je způsobeno vysokým obsahem lipidů při chylotoraxu nebo pseudochylotoraxu [22].
Získaná pleurální tekutina by vždy měla být odeslána na biochemické vyšetření, jehož výsledky nám (většinou) umožní zodpovědět základní otázku diferenciální diagnostiky – jde o exsudát nebo transsudát? Kritéria, podle kterých je etiologie výpotků posuzována, publikoval Light před téměř 40 lety [26]. Tato kritéria vycházejí z hladin celkových bílkovin a laktátdehydrogenázy (LDH) v séru a v pleurální tekutině. K průkazu exsudátu je potřeba splnit následující limity: poměr hladiny proteinů v pleurální tekutině a v séru je větší než 0,5, poměr hladiny LDH v pleurální tekutině a v séru je větší než 0,6 a hladina LDH v pleurální tekutině je vyšší než 2/3 horní hranice normální hladiny LDH v séru (tab. 2). Senzitivita kritérií v odlišení trans a exsudátů se ve velkých studiích opakovaně pohybovala kolem 98% [27]. Přesnost Lightových kritérií k rozlišení exsudátu a transsudátu je signifikantně vyšší než použití jiných laboratorních kritérií [28], přičemž pokusy o úpravy limitních hodnot nepřinesly zvýšení přesnosti kritérií [29]. Tato kritéria jsou tedy stále základem při rozlišování trans a exsudátů.

Diagnostické rozpaky mohou nastat u nemocných s kardiálním selháváním, u nichž je při použití Lightových kritérií hodnocen výpotek jako exsudát. U části z nich bývá následně prokázána jiná příčina exsudátu, jako např. malignita, u části je nutné vzít do úvahy torakotomii (např. operaci koronárního bypassu) provedenou nanejvýš rok před vznikem výpotku, takže výpotek je možné dát do souvislosti s přetrvávající poruchou lymfatické drenáže hrudní dutiny po operaci, u části nemocných je možné přítomnost exsudátu vysvětlit kontaminací erytrocyty [30]. Zbývá skupina nemocných s tzv. transexsudáty či pseudoexsudáty. U nich je výsledek podmíněn intenzivní diuretickou léčbou, která odčerpáním vody z pleurální tekutiny v ní zvýší obsah proteinů a LDH. Poměr sérové a pleurální LDH může být navíc ovlivněn zlepšením jaterních funkcí spojených se snížením produkce a tím i sérové hladiny LDH. Výpotek charakteru exsudátu tedy může být přičten srdečnímu selhání při splnění těchto podmínek: 1) nemocný je léčen diuretiky, 2) vzestup koncentrace proteinů a LDH a jejich poměru je malý a je vždy spojen s poklesem celkového množství výpotku, 3) v případě izolovaného zvýšení LDH je nutné vzít v úvahu možnost kontaminace pleurální tekutiny erytrocyty, 4) kromě Lightových kritérií by u nemocných užívajících diuretika měl být k odlišení transsudátu a exsudátu použit rozdíl sérové a pleurální hladiny albuminu – je li větší než 12g/l, jedná se o transsudát [31]. Jako další pomocné kritérium je možné použít poměr cholesterolu ve výpotku a v séru (u exsudátů je vyšší než 0,3) a hladinu cholesterolu (u exsudátů vyšší než 1,55 mmol/l) [32].
Snížená hladina glukózy ve výpotku (pod 60mg/dl) je nejčastěji spojena s tuberkulózou, malignitou, revmatoidním onemocněním nebo komplikovaným parapneumonickým výpotkem. Mezi vzácné příčiny této situace patří paragonimiáza, hemotorax, syndrom Churg-Straussové, případně lupusová pleuritida. Zvýšená hladina amyláz v pleurální tekutině je přítomna u pankreatických výpotků, metastazujícího adenokarcinomu nebo u ruptury jícnu. Při akutní pankreatitidě je tvorba výpotku spojena se zánětem pleury, zatímco u chronické pankreatitidy může dojít k vytvoření sinusu odvádějícího pankreatickou tekutinu přes bránici do mediastina a pleurální dutiny. K odlišení zvýšené hladiny amyláz maligního a pankreatického původu může posloužit vyšetření izoenzymů. Při ezofagopleurální píštěli se zvýšení amyláz připisuje spolykaným slinám, které se dostanou do pleurálního prostoru. Chylotorax se vyznačuje vysokou hladinou triglyceridů (nad 110mg/dl), zatímco pseudochylotoraxy vysokou hladinou cholesterolu (nad 200mg/dl). Přítomnost cholesterolových krystalů je diagnostická pro pseudochylotorax [22]. Zvýšená hladina adenozin deaminázy (ADA) a interferonu (IFN) gama v pleurální tekutině je hodnocena jako nález nepřímo podporující diagnózu tuberkulózy. Zvýšení ADA v lymfocytárním výpotku ale nacházíme u celé řady dalších chorob jako revmatoidní artritida, bronchioloalveolární karcinom, mezoteliom, mykoplazmová a chlamydiová pneumonie, infekční mononukleóza a další. Stanovení IFN gama dosahuje přibližně stejné senzitivity a specificity jako stanovení ADA, vzhledem k vyšším nákladům je tato metoda užívána daleko méně [33].
Snížená hodnota pH, které by mělo být v rámci vyšetřování pleurální tekutiny neznámé etiologie stanoveno, je stejně jako snížená hladina glukózy dávána do souvislosti se zvýšeným metabolizmem bakterií a/nebo leukocytů, porušeným prostupem látek přes poškozenou pleurální membránu a uvolňováním složek buněčné stěny následující po fagocytóze bakterií [34]. Snížení pod 7,2, což je hodnota obecně uznávaná jako hraniční, pozorujeme především u empyémů a komplikovaných parapneumonických výpotků, s podstatně nižší frekvencí u výpotků při revmatoidní artritidě, při ruptuře jícnu, tuberkulóze, systémové acidóze, u maligních nebo paramaligních výpotků [9]. Důležitost stanovení pH spočívá v tom, že průkaz snížené hodnoty je považován za jednoznačnou indikaci k zavedení hrudního drénu buď sám o sobě [35], nebo v kombinaci s dalšími kritérii – výpotek v rozsahu nejméně poloviny hemitoraxu, případně výpotek lokulovaný, s prokázaným ztluštěním parietální pleury, pozitivní bakteriologický nález kultivační nebo mikroskopický při barvení dle Grama [14].
V rámci cytologického vyšetření může být v diferenciální diagnostice nápomocné vyšetření diferenciálního rozpočtu. Převaha polymorfonukleárů signalizuje akutní patologický proces – při současné přítomnosti infiltrátu v plicním parenchymu jde nejpravděpodobněji o parapneumonický výpotek, plicní embolizaci nebo rakovinu plic, zatímco absence parenchymatózních infiltrátů hovoří pro plicní embolizaci, virovou infekci, gastrointestinální chorobu, výpotek při azbestóze nebo akutní tuberkulózní pleuritidě. Naproti tomu přítomnost mononukleárů svědčí pro chronický proces charakteru malignity, plicní embolizace, tuberkulózy a hojící se virové pleuritidy; při převaze malých lymfocytů jde nejpravděpodobněji o malignitu a tuberkulózu. Přítomnost více než jen několika málo mezotelií činí diagnózu tuberkulózy nepravděpodobnou. Výskyt více než 10% eozinofilů je nejčastěji spojen s přítomností vzduchu nebo krve v pleurální dutině, dalšími možnostmi jsou výpotek při azbestóze, paragonimiáze, syndromu Churg-Straussové nebo pleuritida indukovaná léky (např. nitrofurantoin) [22]. Nejčastěji bývá cytologické vyšetření zaměřeno na průkaz nádorových buněk, poněvadž nejsou k dispozici jiná kritéria průkazu (para)maligní etiologie. Např. senzitivita tumormarkerů v diagnostice nádorových výpotků kolísá jen mezi 17 a 30% [36]. Pozitivní výsledek u maligních pleurálních výpotků nacházíme v 62 až 90% [13]. U paramaligních výpotků samozřejmě nádorové buňky v punktátu nejsou přítomny.
Mikrobiologické vyšetření pleurální tekutiny má být provedeno jak mikroskopicky po barvení dle Grama, tak i kultivačně (aerobní a anaerobní kultivace) [22]. Výtěžnost tohoto vyšetření je však obvykle nízká – pozitivní kultivace byly získány jen u 3% kultur a po vyloučení pravděpodobných kontaminací klesl podíl vyšetření s prokázanými patogeny u nemocných s výpotky různé etiologie na 1,4% [37]. Kombinace mikrobiologického, mikroskopického a biochemického vyšetření je používána v diagnostice tuberkulózních výpotků, kdy mikroskopie s nálezem acidorezistentních tyček dosahuje senzitivity 20% a specificity 100%, stanovení adenozindeaminázy 50 a 50% a provedení PCR senzitivity 70% a specificity 100% [38]. Pozitivita kultivací se u tuberkulózních výpotků pohybuje mezi 13 a 65% [20], vyšetření pomocí PCR dosahuje i u kultivačně negativních výpotku až 30–60% pozitivity [33].
Především v diagnostice maligního postižení pleury (ale také tuberkulózy a dalších afekcí) je v řadě případů přínosné získání vzorku pohrudnice k histologickému vyšetření. Přínos naslepo, bez ultrazvukové či CT kontroly prováděné pleurální biopsie, je poměrně nízký – pohybuje se kolem 38% [39]. Při zvýšení počtu vzorků na 5–10 je možné zvýšit senzitivitu metody na 62% [40]. Mnohem lepších výsledků je dosahováno při torakoskopii. Zatímco videoasistovaná torakoskopie (VATS) je chirurgický výkon prováděný na operačním sále v celkové anestezii s ventilací jedné plíce obvykle z terapeutických důvodů, tzv. lékařská (medicínská) torakoskopie je prováděna pneumology v lokální anestezii na endoskopickém sálku většinou z diagnostických důvodů. Její indikací je především výpotek, dále pneumotorax, chemická pleurodéza a další [41]. Výtěžnost této metody dosahuje 81–95% [13,40].
Pečlivým vyšetřením pleurální tekutiny a korelací s dalšími klinickými parametry je možné dojít k definitivní nebo pravděpodobné diagnóze u většiny pacientů. Zůstává ale skupina nemocných, u nichž se nepodaří příčinu tvorby výpotku stanovit. Podíl těchto idiopatických pleuritid v jednotlivých souborech kolísá v širokém rozmezí, od 1 do 13,5% [10,42]. Základním požadavkem u těchto nemocných je vyloučení především maligní etiologie; neprokázané tuberkulózní výpotky, které v minulosti představovaly nejzávažnější diagnostický problém, jsou v našich podmínkách vzhledem ke zlepšující se epidemiologické situaci méně časté. Nemocní s dosud neprokázanou příčinou pleurálního výpotku a s rentgenologicky zjištěnou patologií v plicním parenchymu nebo s výpotkem provázeným hemoptýzou by měli být vyšetřeni bronchoskopicky [20]. Je li u nemocného přítomen jen pleurální výpotek, nedoprovázený patologickým procesem v plicním parenchymu, je doporučováno opakovat diagnostickou pleurální punkci a současně provést biopsii pleury, nejlépe cílenou pomocí medicínské torakoskopie [20,41]. Nedojde li se ani tímto podrobným vyšetřením za použití intervenčních metod k diagnostickému závěru, je možné tyto nemocné, u nichž tvorba výpotku odezněla, nadále jen sledovat. Klinická zkušenost ukazuje, že u většiny nemocných, u nichž bylo onemocnění uzavřeno jako idiopatické, zůstává příčina neobjasněna i při dlouhodobém sledování [42].
Poděkování
Za zapůjčení obrazové dokumentace děkuji prof. MUDr. Pavlovi Eliášovi, CSc. z Radiologické kliniky Fakultní nemocnice Hradec Králové.
Doručeno do redakce 24. 7. 2009
Přijato po recenzi 3. 10. 2009
doc. MUDr. František Salajka, CSc.
Plicní klinika LF UK a FN Hradec Králové
salajka@fnhk.cz
Zdroje
1. Zocchi L. Physiology and patophysiology od pleural fluid turnover. Eur Respir J 2002; 20 : 1545–1558.
2. Miserocchi G. Physiology and patophysiology of pleural fluid turnover. Eur Respir J 1997; 10 : 219–225.
3. Noppen M, De Waele M, Li R et al. Volume and cellular content of normal pleural fluid in humans examined by pleural lavage. Am J Respir Crit Care Med 2000; 162 : 1023–1026.
4. Antony VB. Immunological mechanisms in pleural disease. Eur Respir J 2003; 21 : 539–544.
5. Hamm H, Light RW. The pleura: the outer space of pulmonary medicine. Eur Respir J 1997; 10 : 2–3.
6. Kinasewitz GT. Transudative effusions. Eur Respir J 1997; 10 : 714–718.
7. Wiener-Kronish JP, Matthay MA, Callen PW et al. Relationship of pleural effusions to pulmonary hemodynamics in patients with congestive heart failure. Am Rev Respir Dis 1985; 132 : 1253–1256.
8. Idell S, Girard W, Koenig KB et al. Abnormalities of pathways of fibrin turnover in the human pleural space. Am Rev Respir Dis 1991; 144 : 187–194.
9. Bartter T, Santarelli R, Akers SM et al. The evaluation of pleural effusion. Chest 1994; 106 : 1209–1214.
10. Marel M, Šťastný B, Melínová L et al. Diagnosis of pleural effusions. Experience with clinical studies, 1986 to 1990. Chest 1995; 107 : 1598–1603.
11. Porcel JM, Vives M. Etiology and pleural fluid characteristics of large and massive effusions. Chest 2003; 124 : 978–983.
12. Antony VB, Loddenkemper R, Astoul P et al. Management of malignant pleural effusions. Eur Respir J 2001; 18 : 402–419.
13. Antony VB, Loddenkemper R, Astoul P et al. Management of malignant pleural effusions. Am J Respir Crit Care Med 2000; 162 : 1987–2001.
14. Colice GL, Curtis A, Deslauriers J et al for the American College of Chest Physicians Parapneumonic Effusions Panel. Medical and surgical treatment of parapneumonic effusions: an evidence‑based guideline. Chest 2000; 118 : 1158–1171.
15. Hamm H, Light RW. Parapneumonic effusion and empyema. Eur Respir J 1997; 10 : 1150–1156.
16. Gopi A, Madhavan SM, Sharma SK et al. Diagnosis and treatment of tuberculous pleural effusion in 2006. Chest 2007; 131 : 880–889.
17. Joseph J, Sahn SA. Connective tissue diasease and the pleura. Chest 1993; 104 : 262–270.
18. Hillerdal G. Chylothorax and pseudochylothorax. Eur Respir J 1997; 10 : 1157–1162.
19. Morelock SY, Sahn SA. Drugs and the pleura. Chest 1999; 116 : 212–221.
20. Bartter T, Santarelli R, Akers SM et al. The evaluation of pleural effusion. Chest 1994; 106 : 1209–1214.
21. Fartoukh M, Azoulay E, Galliot R et al. Clinically documented pleural effusions in medical ICU patients: how useful is routine thoracentesis? Chest 2002; 121 : 178–184.
22. Light RW. Diagnostic principles in pleural disease. Eur Respir J 1997; 10 : 476–481.
23. Jones PW, Moyes JP, Rogers JT et al. Ultrasound-guided thoracentesis: is it a safer method? Chest 2003; 123 : 418–423.
24. Agustí AGN, Cardús J, Roca J et al. Ventilation-perfusion mismatch in patients with pleural effusion. Effects of thoracentesis. Am J Respir Crit Care Med 1997; 156 : 1205–1209.
25. Sallach SM, Sallach JA, Vasquez E et al. Volume of pleural fluid required for diagnosis of pleural malignancy. Chest 2002; 122 : 1913–1917.
26. Light RW, MacGregor MI, Luchsinger PC et al. Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med 1972; 77 : 507–513.
27. Roth BJ. Evaluating pleural fluid. Chest 1996; 110 : 7–8.
28. Romero‑Candeira S, Hernández L, Romero‑Brufao S et al. Is it meaningful to use biochemical parameters to discriminate between transudative and exudative pleural effusions? Chest 2002; 122 : 1524–1529.
29. Vives M, Porcel JM, de Vera VMC et al. A study of Light‘s criteria and possible modifications for distinguishing exudative from transudative pleural effusions. Chest 1996; 109 : 1503–1507.
30. Eid AA, Keddissi JI, Samaha M et al. Exudative effusions in congestive heart failure. Chest 2002; 122 : 1518–1523.
31. Mitrouska I, Bouros D. The trans‑exudative pleural effusion. Chest 2002; 122 : 1503–1505.
32. Garrido VV, Sancho JF, Blasco H et al. Diagnosis and treatment of pleural effusion. Arch Bronconeumol 2006; 42 : 349–372.
33. Gopi A, Madhavan SM, Sharma SK et al. Diagnosis and treatment of tuberculous pleural effusion in 2006. Chest 2007; 131 : 880–889.
34. Kouritas VK, Hatzoglou C, Foroulis CN et al. Low glucose level and low pH alter the electrochemical function of human parietal pleura. Eur Respir J 2007; 30 : 354–357.
35. Castro DJ, Nuevo GD, Sueiro A et al. Pleural fluid parameters identifying complicated parapneumonic effusions. Respiration 2005; 72 : 357–364.
36. Porcel JM, Vives M, Esquerda A et al. Use of a panel of tumor markers (carcinoembryonic antigen, cancer antigen 125, carbohydrate antigen 15–3, and cytokeratin 19 fragments) in pleural fluid for the differential diagnosis of benign and malignant effusions. Chest 2004; 126 : 1757–1763.
37. Barnes TW, Olson EJ, Morgenthaler TI et al. Low yield of microbiologic studies on pleural fluid specimens. Chest 2005; 127 : 916–921.
38. Nagesh BS, Sehgal S, Jindal SK et al. Evaluation of polymerase chain reaction for detection of Mycobacterium tuberculosis in pleural fluid. Chest 2001; 119 : 1737–1741.
39. Chakrabarti B, Ryland I, Sheard J et al. The role of Abrams percutaneous pleural biopsy in the Investigation of exudative pleural effusions. Chest 2006; 129 : 1549–1555.
40. McLean AN, Bicknell SR, McAlpine LG et al. Investigation of Pleural Effusion : an evaluation of the new Olympus LTF semiflexible thoracofiberscope and comparison with Abram‘s needle biopsy. Chest 1998; 114 : 150–153.
41. Rodriguez-Panadero F, Janssen JP, Astoul P. Thoracoscopy: general overview and place in the diagnosis and management of pleural effusion. Eur Respir J 2006; 28 : 409–421.
42. Ferrer JS, Muňoz XG, Orriols RM et al. Evolution of idiopathic pleural effusion: a prospective, long‑term follow‑up study. Chest 1996; 109 : 1508–1513.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2009 Číslo 4
-
Všechny články tohoto čísla
- Elektrofyziologie převodní srdeční soustavy ve spirále času
- Plicní arteriální hypertenze
- Plicní embolizace
- Vrozené srdeční vady s plicní hypertenzí
- Plicní hypertenze u chronické obstrukční plicní nemoci
- Pleurální výpotky – etiologie a diagnostika
- Léčba diabetu s ohledem na kardiovaskulární riziko
- Budoucnost léčby dyslipidemií
- Komu zvoní hrana?
- Hotline sessions na 31. evropském kardiologickém kongresu v Barceloně
- Kdo káže vodu a pije víno – Kardiovaskulární riziko v medicínské populaci v projektu
- Vzpomínky kardiologa, který zůstal Čechem i v exilu
- Čechoslovák – kardiolog a vynálezce, který prorazil i v USA
- Galerie autorů
- Rejstřík k ročníku 11 (2009)
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Pleurální výpotky – etiologie a diagnostika
- Plicní embolizace
- Vrozené srdeční vady s plicní hypertenzí
- Plicní hypertenze u chronické obstrukční plicní nemoci
