Trimetazidin v léčbě anginy pectoris a ostatních forem ICHS
Trimetazidine in the treatment of angina pectoris and other forms of IHD
Trimetazidine, piperazine derivative, is practically the only drug from the group of metabolic modulators used in the clinical practice
in the angina pectoris treatment. The principle of the effect of trimetazidine is selective inhibition of enzyme of beta oxidation of fatty acids in mitochondria, 3-ketoacyl-CoA-thiolase (3-KAT). The result is partial inhibition of fatty acids oxidation and stimulation of glucose oxidation. Trimetazidine has demonstrable antianginose effects in monotherapy and in the combined treatment. Former papers have already shown that TMZ has efficacy comparable with classic haemodynamic drugs. Trimetazidine is indicated mainly in the prophylaxis of angina pectoris. However, cytoprotective effects assert in other forms of ischaemic heart disease too and they are not necessarily bound on the occurrence of angina pectoris. Trimetazidine is excellently tolerated and therefore it is suitable in elderly patients, diabetics and polymorbid patients.
Keywords:
trimetazidine – angina pectoris – ischaemic heart disease – metabolic treatment
Autoři:
V. Chaloupka
Vyšlo v časopise:
Kardiol Rev Int Med 2005, 7(1): 17-20
Souhrn
Prakticky jediným, v klinické praxi používaným lékem ze skupiny metabolických modulátorů v léčbě anginy pectoris je trimetazidin (TMZ), derivát piperazinu. Podstatou účinku trimetazidinu je selektivní inhibice enzymu betaoxidace mastných kyselin v mitochondriích 3-ketoacyl-CoA-thiolázy (3-KAT). Výsledem je parciální inhibice oxidace mastných kyselin a stimulace oxidace glukózy. Trimetazidin má prokazatelné antianginózní účinky v monoterapii i v kombinační léčbě. Již dřívější práce ukázaly, že TMZ má srovnatelnou účinnost s klasickými hemodynamickými léky. Trimetazidin je indikován hlavně k profylaxi anginy pectoris. Cytoprotektivní účinky se však uplatňují i u jiných forem ischemické choroby srdeční a nejsou nutně vázané na výskyt anginy pectoris. Trimetazidin je výborně tolerován, a je proto vhodný u starších nemocných, diabetiků a polymorbidních nemocných.
Klíčová slova:
trimetazidin – angina pectoris – ischemická choroba srdeční – metabolická léčba
Farmakologická léčba anginy pectoris
K dlouhodobé farmakologické léčbě nemocných s anginou pectoris (AP) se tradičně používají léky s hemodynamickým účinkem, jako jsou nitráty, betablokátory a antagonisté kalciových kanálů. Všechny tyto léky vedou, byť různými hemodynamickými účinky, k obnovení rovnováhy nabídky a spotřeby kyslíku v ischemickém myokardu. Snižují srdeční práci snížením afteroladu, preloadu, kontraktility nebo srdeční frekvence, nebo zvyšují dodávku kyslíku koronární vazodilatací, redistribucí krve a prodloužením diastoly [1].
Většina lékařů u závažnější AP ordinuje kombinační léčbu, i když některé práce ukázaly, že kombinace hemodynamických léků antianginózní a antiischemický účinek proti monoterapii zvyšuje málo nebo vůbec [2,3]. Samozřejmě je důležité používat vhodné kombinace. Obecně by se měly více využívat betablokátory s dostatečně dlouhodobým účinkem, kardioselektivní, bez vnitřní sympatomimetické aktivity, které jsou nejen velmi účinné v profylaxi ischemie, ale zásadním způsobem také ovlivňují prognózu.
U těžkých forem AP a destabilizaci stavu by samozřejmě měla být provedena koronarografie a podle výsledku koronární angioplastika nebo chirurgická revaskularizace. Ne všichni nemocní jsou však vhodní pro revaskularizační zákrok a je také pravděpodobné, že bude přibývat nemocných, kteří již jednu nebo obě metody absolvovali a další zákrok již není technicky možný. V těchto situacích se budeme muset spolehnout na farmakologickou léčbu.
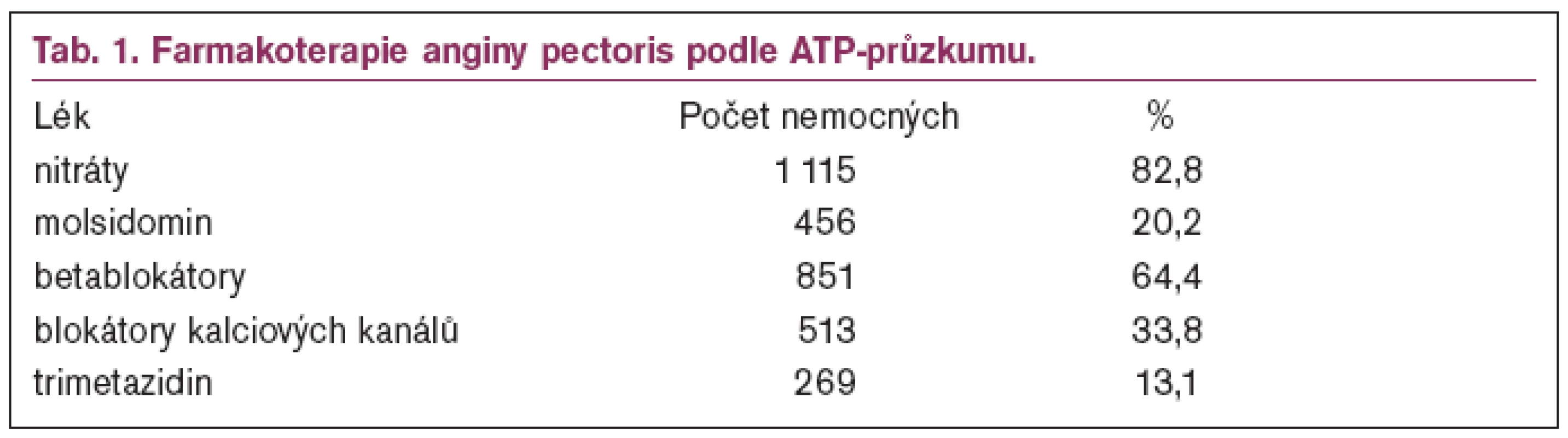
V roce 2001 proběhl v České republice jako součást evropského projektu ATP průzkum (Angina Treatment Patterns Survey), který si kladl za cíl zjistit, jak jsou v Evropě léčeni nemocní s anginou pectoris. Jak ukazuje tabulka, nejčastěji se používá kombinační léčba a nejvíce požívanými léky jsou nitráty (tab. 1). Na 1 nemocného vycházelo v průměru 2,14 antianginózních léků [4].
Ischemie a metabolizmus srdečníbuňky
Na klinice se většinou koncentrujeme na pozdní projevy ischemie jako je bolest, elektrokardiografické nebo echokardiografické změny (obr. 1). Na začátku této řady je však porucha prokrvení s nepoměrem mezi potřebou a nabídkou kyslíku s následnými metabolickými změnami. Ischemie je tedy především metabolický děj, při kterém dochází k narušení normálního energetického metabolizmu srdečních buněk.
Za normálních podmínek jsou primárním zdrojem energie pro srdeční buňku volné mastné kyseliny, které pokrývají 60–90 % potřebné energie pro syntézu adenozintrifosfátu (ATP). Zbytek tvoří oxidace pyruvátu, vznikajícího glykolýzou a oxidací laktátu. Téměř veškerý ATP vzniká oxidativní fosforylací v mitochondriích, pouze mizivé procento vzniká glykolýzou (obr. 2).
Nabídka volných mastných kyselin závisí na jejich koncentraci v krvi, která kolísá mezi 0,1–1,5 mmol/l. Mastné kyseliny vznikají z triglyceridů v tukových buňkách. Inzulin potlačuje tvorbu mastných kyselin, naopak katecholaminy zvyšují hladinu mastných kyselin. Když je vysoká hladina katecholaminů, je i vyšší nabídka energetického substrátu.
V mitochondriích vzniká z mastných kyselin betaoxidací acetyl CoA. Z glukózy vzniká glykolýzou pyruvát nebo se ukládá ve formě glykogenu. Laktát je extrahován z krve a rovněž přeměněn na pyruvát, a dále v mitochondriích oxidován pyruvátdehydrogenázou na acetyl CoA. Důležité je, že oxidace glukózy je silně inhibována oxidací mastných kyselin [5].
Snížená dodávka kyslíku do srdečního svalu vyvolá pokles oxidativní fosforylace v mitochondriích a zvýšenou závislost myokardu na anaerobní glykolýze jako zdroji energie. Stoupá sice vychytávání glukózy, ale její využití je neúplné, zachována je první, anaerobní část metabolizmu a myokard je zdrojem laktátu, který je za normálních okolností schopen sám metabolizovat (obr. 3). Hlavním zdrojem energie jsou tedy mastné kyseliny, i když je jejich metabolizace náročnější na kyslík a jejich vyšší hladina může zhoršit myokardiální ischemii. Jednou z příčin vyšší nabídky mastných kyselin je jejich mobilizace katecholaminy, kterou organizmus reaguje na ischemii.
Za ischemických podmínek se tedy glukóza v myokardu špatně oxiduje na pyruvát, dochází k její konverzi na laktát, a tedy i k přechodu z vychytávání laktátu srdcem na produkci laktátu. Výsledkem je narušení buněčné homeostázy. Snižuje se obsah ATP, dochází k hromadění laktátu a H+, k intracelulární acidóze a poklesu kontrakce. Ischemická tkáň paradoxně dále získává většinu energie (50–70 %) z oxidace mastných kyselin [5,6].
Metabolická léčba ischemie
Myšlenka zasáhnout do metabolizmu a stimulovat glykolýzu není nová. Jednou z možností je stimulace aktivací pyruvátdehydrogenázy podáváním inzulinu s glukózou, což se před léty používalo při léčbě infarktu myokardu.
Prakticky jediným, v klinické praxi používaným lékem ze skupiny metabolických modulátorů, je trimetazidin(TMZ), derivát piperazinu. I když je metabolická léčba stále pokládaná za relativně novou, byl trimetazidin uveden na trh již v roce 1980 a v současnosti je používán ve 46 zemích [7].
Podstatou účinku trimetazidinu je selektivní inhibice enzymu betaoxidace mastných kyselin v mitochondriích 3–ketoacyl–CoA–thiolázy (3–KAT). Výsledem je parciální inhibice oxidace mastných kyselin a stimulace oxidace glukózy [8].
Cytoprotektivní účinky TMZ chrání proti důsledkům hypoxie a ischemie. Trimetazidin brání poklesu intracelulární koncentrace ATP, zajišťuje správnou funkci iontových pump a pomáhá zachovat buněčnou homeostázu. Experimentálně bylo prokázáno, že trimetazidin významně inhibuje oxidaci mastných kyselin a stimuluje oxidaci glukózy. Oxidací mastných kyselin vzniká sice více ATP, ale oxidace glukózy je energeticky výhodnější. Pro buňku je ale zásadní snížení acidózy, které nejspíše vysvětluje kardioprotektivní účinky trimetazidinu. Trimetazidin nemá žádné hemodynamické účinky, neovlivňuje tedy hodnoty krevního tlaku a tepové frekvence ani v klidu, ani při zátěži [8,9].


Trimetazidin v léčbě anginypectoris
Trimetazidin má prokazatelné antianginózní účinky v monoterapii i v kombinační léčbě u nemocných se stabilní anginou pectoris. Již dřívější práce ukázaly, že TMZ má srovnatelnou účinnost s klasickými hemodynamickými léky. Například ve studii TEMS (Trimetazidine European Multicenter Study) se TMZ (3x 20 mg) porovnával s propranololem (3x 40 mg). Obě látky snižovaly srovnatelně počet anginózních záchvatů a při zátěžové elektrokardiografii prodloužily celkovou dobu tolerované zátěže i čas k dosažení depresí úseku ST o 1 mm. Celkovou ischemickou zátěž posuzovanou ambulantním monitorováním EKG snížil trimetazidin významně více. U TMZ byl poloviční výskyt nežádoucích účinků, které vedly k přerušení léčby, než u propranololu [10]. V řadě klinických studií potvrdil trimetazidin vyšší klinický přínos v kombinaci s hemodynamickým lékem, než je tomu u vzájemné kombinace 2 nebo 3 hemodynamických léků [11,12]. V kombinaci s betablokátorem prodloužil trimetazidin statisticky významněji dobu do vzniku 1mm depresí úseku ST a čas do nástupu stenokardií při zátěži než kombinace betablokátor + nitrát [13].
Největší z provedených studií představuje studie TRIMPOL II, která zkoušela účinnost trimetazidinu u 426 nemocných s námahovou AP léčených metoprololem 100 mg denně. Jednalo se o multicentrickou, dvojitě slepou studii kontrolovanou placebem, jejímž cílem bylo porovnat účinnost léčby AP kombinovanou léčbou metoprolol a trimetazidin proti léčbě metoprolol a placebo. Při srovnání se samotným metoprololem zlepšilo přidání TMZ významně toleranci zátěže při zátěžové elektrokardiografii, čas dosažení 1mm deprese ST, čas do objevení stenokardie, maximální deprese ST i klinickou symptomatologii [14].
V současné době máme k dispozici i klinické výsledky s TMZ v České republice. Do společných českých a slovenských studií TRIKET I a II bylo zařazeno 320 nemocných se stabilní námahovou AP, kteří měli pozitivní zátěžový test a byli nedostatečně léčeni konvenčním antianginózním lékem. K této léčbě byl přidán trimetazidin v dávce 3x 20 mg denně. Výsledky byly hodnoceny po 12 týdnech léčby a porovnávaly se s hodnotami před zahájením léčby. Průměrná doba zátěže se prodloužila o 61 sekund (11,7 %), celková vykonaná práce se zvýšila o 21,4 % a čas do vzniku 1mm deprese úseku ST se prodloužil o 36,6 %. Čas do nástupu stenokardie se při zátěži prodloužil o 54 %. Počet anginózních záchvatů týdně klesl ze 4,0 na 1,6. Trimetazidin byl velmi dobře tolerován [15].
Podobně byla koncipována další česko – slovenská studie u starších nemocných – TIGER. Autoři zařadili 120 seniorů průměrného věku 70 let s chronickou stabilní AP. Přidání trimetazidinu ke stávající terapii na 12 týdnů vedlo k významnému zlepšení klinického stavu. Doba ergometrické zátěže se prodloužila o 52 sekund a současně se významně zlepšila celková dosažená práce. Čas do vzniku 1mm deprese ST se prodloužil o 41 sekund a počet anginózních záchvatů týdně klesl z 5,5 na 2,2. U 32 % nemocných anginózní bolesti zcela vymizely [16].
Problematikou efektu léčby trimetazidinem u starších nemocných s AP a sníženou funkcí LK se zabývali v nedávno publikované práci Vitale et al [17]. V randomizované studii přidávali k běžné léčbě těchto nemocných trimetazidin nebo placebo po dobu 6 měsíců. Na konci studie zjistili v trimetazidinové skupině nejen snížení počtu anginózních záchvatů a nižší spotřebu nitrátů, ale i zlepšení echokardiografických ukazatelů, především ejekční frakce a indexu hybnosti stěn LK na rozdíl od skupiny placebové. V léčené skupině zjistili také snížení hodnot enddiastolického a endsystolického objemu a také zlepšení diastolické funkce LK. Zlepšení systolické funkce může být ve vztahu k efektivnějšímu využití glukózy v chronicky hypoperfundovaném myokardu. Pozoruhodný je jistě pozitivní vliv na remodelaci LK, který se dá rovněž vysvětlit antiischemickým účinkem; udávají ho i jiní autoři [18,19]. Není třeba zdůrazňovat, že systolická funkce a remodelace LK mají velký vliv na dlouhodobou prognózu i u starších nemocných. Za pozoruhodné lze pokládat i zlepšení diastolické funkce, protože u starších nemocných se s poruchou plnění LK běžně setkáváme v důsledku snížené poddajnosti LK.
Většina dosavadních prací testovala trimetazidin IR (3x 20 mg denně). V současné době je k dispozici trimetazidin MR (modified release) s dávkováním 2x 35 mg denně. Je dokumentován přetrvávající efekt déle než 12 hodin po poslední dávce [20]. Jednalo se o multicentrickou, radomizovanou, dvojitě zaslepenou, placebem kontrolovanou studii u 167 nemocných se stabilní AP. K 6měsíční léčbě atenololem 50 mg byl přidán trimetazidin MR (2x 35mg) nebo placebo. V trimetazidinové skupině došlo ke statisticky významnému prodloužení doby do vzniku 1mm deprese ST i doby do začátku stenokardií při zátěžové elektrokardiografii. Trimetazidin MR byl velmi dobře tolerován. K podobným závěrům dospěli i jiní autoři [21].
Použití trimetazidinu u jiných forem ischemické choroby srdeční
Trimetazidin je indikován hlavně k profylaxi anginy pectoris. Cytoprotektivní účinky se však uplatňují i u jiných forem ischemické choroby srdeční (ICHS) a nejsou nutně vázané na výskyt AP. V dvojitě slepé, placebem kontrolované studii u 38 nemocných po infarktu myokardu se sníženou funkcí levé komory srdeční (EF 33 ± 5 %) zjistili autoři zlepšení indexu hybnosti stěn LK při dobutaminové echokardiografii, zlepšení EF a spirometricky zlepšení vrcholové spotřeby kyslíku již po 2měsíční léčbě [22]. Podobně i jiní autoři udávají kardioprotektivní účinek trimetazidinu u srdečního selhání se zlepšením funkce LK. Trimetazidin zpomaluje progresi regionální myokardiální dysfunkce a zlepšuje kontraktilní odpověď [23]. U nemocných s chronickou ICHS, u kterých se zjistí viabilní myokard a nelze u nich provést revaskularizační zákrok, by mohl být trimetazidin lékem volby.
Možným protektivním účinkem trimetazidinu u nemocných léčených heparinem se zabývali Fragasso et al [24]. U nemocných s akutními koronárními syndromy je heparin běžně používán jako antitrombotikum. Je však známo, že heparin zvyšuje koncentraci cirkulujících volných mastných kyselin, což může mít nepříznivý vliv na metabolizmus myokardu, zvláště při ischemii.
Heparin snižuje ischemický práh, pravděpodobně právě zvýšeným uvolňováním volných mastných kyselin mobilizací lipoproteinové lipázy, která hydrolyzuje triglyceridy. U nemocných s angiograficky prokázanou ICHS a zátěžovým testem s pozitivním výsledkem zjistili, že heparin zkracuje dobu do vzniku 1mm deprese ST a prodlužuje dobu do zotavení. Pokud byl před podáním heparinu podán trimetazidin, byla doba do vzniku 1mm deprese a doba do zotavení stejná jako po podání fyziologického roztoku.
Další oblastí, kde se ukazuje použití trimetazidinu jako přínosné, je spojení s ischemicko–reperfuzním poškozením, kdy může trimetazidin poskytnout užitečnou antiischemickou ochranu. V dvojitě slepé, placebem kontrolované studii u nemocných indikovaných k aortokoronárnímu bypassu užívali nemocní v aktivní skupině 3 týdny před operací trimetazidin v dávce 60 mg denně. Autoři sledovali hodnoty troponinu T před operací, za 5 minut po ukončení zákroku a poté po 12, 24 a 48 hod. Hodnoty troponinu byly ve skupině léčené trimetazidinem významně nižší [25].
Stejně tak se ukazuje, že trimetazidin má pozitivní vliv i na ischemické změny během koronární angioplastiky [26]. V této otevřené studii užívali nemocní před PTCA 4 dny trimetazidin opět v dávce 60 mg. Elevace úseku ST během všech inflací balónku byla významně nižší. Nižší byly i maximální změny amplitudy T vlny elektrokardiogramu. Čas od inflace balónku do vzniku stenokardie byl u trimetazidinové skupiny významně delší a významně kratší byl čas do ústupu bolesti po deflaci balónku.
Diabetes mellitus a metabolická léčba
Nemocných s diabetem mellitus (DM) 2. typu rychle přibývá. DM představuje jednu z hlavních rizikových faktorů kardiovaskulární morbidity a mortality [27]. Téměř 75 % nemocných s DM 2. typu a 35 % nemocných s DM 1. typu umírá na kardiovaskulární onemocnění. V porovnání se stejnými věkovými skupinami nediabetiků je kardiovaskulární mortalita u diabetiků 2–4krát častější. Zvýšené riziko ICHS je již u nemocných s mírně zvýšenou hladinou glukózy, která je stále ještě pod prahovými hodnotami pro DM [28]. V nedávno publikovaném průzkumu (The Euro Heart Survey on diabetes and the heart) mělo 31 % nemocných s ICHS diabetes mellitus [29]. To je podstatně více než v předchozích průzkumech [30,31]. Tento průzkum také ukázal, že většina nemocných s ICHS má narušený metabolizmus glukózy. U nemocných s akutní ICHS mělo 36 % nemocných poruchu glukózové regulace a 22 % nově zjištěný DM.
Metabolické změny u DM jsou výsledkem snížené činnosti některých enzymů (acetyl–CoA–karboxyláza, karnitin–palmitoyl–transferáza a pyruvát–dehydrogenáza) vedoucí ke zvýšené hladině volných mastných kyselin s jejich zvýšenou oxidací a inhibicí glukózové oxidace. Za podmínek ischemie srdečního svalu dochází rychleji k přechodu od aerobní glykolýzy k anaerobní glykolýze s následným snížením tvorby energetického substrátu, zvýšené tvorbě laktátu a kyselých metabolitů. Inhibicí oxidace mastných kyselin trimetazidin zlepšuje utilizaci glukózy v klidu i během ischemie.
Příznivý efekt léčby trimetazidinem u diabetiků s ICHS ukázalo několik studií. Ve studii TRIMPOL–1 u diabetiků s AP přidání trimetazidinu k základní léčbě metoprololem významně zlepšilo jak klinické, tak zátěžové ukazatele [32]. U nemocných s ischemickou kardiomyopatií došlo po 6 měsících nejen k zlepšení klinického stavu, ale i ke zlepšení EF a snížení hodnot endotelinu–1 a glykovaného hemoglobinu [19]. Zlepšení EF u diabetiků s ischemickou kardiomyopatií zjistili po 6měsíční léčbě trimetazidinem i Rosano et al. Na rozdíl od placebové skupiny pozorovali i snížení enddiastolického rozměru LK a zlepšení indexu hybnosti LK [33].
Co je z klinického hlediska při léčbě trimetazidinem MR důležité:
- působí na nitrobuněčný metabolizmus a nemá žádné hemodynamické účinky
- má prokázaný antianginózní a antiischemický efekt po celých 24 hodin při dávkování 2x 35 mg denně
- je vhodný jak pro monoterapii tak do kombinační léčby s ostatními léky, protože má prokázaný aditivní efekt, což u kombinace hemodynamicky působících léků nemusí být jisté, a navíc se může zvýšit výskyt vedlejších účinků (bradykardie, pokles TK)
- trimetazidin MR je výborně tolerován, a je proto vhodný u starších nemocných, diabetiků a polymorbidních nemocných.
doc. MUDr. Václav Chaloupka, CSc.
Oddělení funkčního vyšetřování
FN Brno Bohunice
Zdroje
1. Bultas J. Léčba anginy pectoris. Jak dnes, jak zítra? Medicína po promoci 2004; 5 : 14–30.
2. Packer M. Drug Therapy: Combined beta–adrenergic and calcium–entry blockade in angina pectoris. N Engl J Med 1989; 320 : 709–718.
3. Savonitto S, Ardissino D, Egstrup K et al. Combination therapy with metoprolol and nifedepine versus monotherapy in patients with stable angina pectoris. International Multicenter Angina (IMAGE) Study. J Am Coll Cardiol 1996; 27 : 311–316.
4. Hradec M, Chaloupka V, Sachová M. Angina treatment Patterns Survey: Současný stav diagnostiky a léčby nemocných se stabilní anginou pectoris v České republice. Cor Vasa 2003; 45 : 173–180.
5. Lopaschuk GD. Pharmacologic rationale for trimetazidine in the treatment of ischemic heart disease. Am J Cardiovasc Drugs 2003; 3(Suppl I): 21–26.
6. Marzilli M. Cardioprotective effects of trimetazidine: a review. Curr Med Res Opin 2003; 19 : 661–672.
7. Hradec J. Lékové profily. Trimetazidinum. 2003; 13 : 8–75.
8. Kantor P, Lucien A, Kozak R, Lopaschuk G. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long–chain 3–ketoacyl coenzyme A thiolase. Circ Res 2000; 86 : 580–588.
9. Marzilli M, Klein WW. Efficacy and tolerability of trimetazidine in stable angina: a meta–analysis of randomized, double–blind, controlled trials. Cor Art Dis 2003; 14 : 171–179.
10. Detry JM, Sellier P, Pennaforte S et al. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Trimetazidine European Multicenter Study (TEMS) Group. Br J Clin Pharmacol 1994; 37 : 279–288.11. Manchanda SC, Krishnaswami S. Combination treatment with trimetazidine and diltiazem in stable angina pectoris. Heart 1997; 78 : 353–357.
12. Levy S and Group of South of France Investigators. Combination therapy of trimetazidine with diltiazem in patients with coronary artery disease. Am J Cardiol 1995; 76(6): 12B–16B.
13. Michaelides PA, Spiropoulos K, Dimopoulos K et al. Antianginal efficacy of the combination of trimetazidine–propranolol compared with monosorbide dinitrate–propranolol in patients with stable angina. Clin Drug Invest 1997; 13 : 8–14.
14. Szwed H, Sadowski Z, Elikowski W et al. Combination treatment in stable effort angina using trimetazidine and metoprolol. Results of randomized, double–blind, multicentre study (TRIMPOL II). Eur Hear J 2001; 22 : 2267–2274.
15. Hradec J, Filipová J. TRIKET I a II (TRImetazidin v Kombinaci s Existující Terapií) – Výsledky české a slovenské multicentrické studie u 320 nemocných se stabilní námahovou anginou pectoris. Cor Vasa 2001; 43 : 436–442.
16. Kolbel F, BadaV. Trimetazidine in geriatric patients with stable angina pectoris: The Tiger Study. Int J Clin Pract 2003; 57 : 867–870.
17. Vitale C, Wajngaten M, Sposato B et al. Trimetazidine improves left ventricular function and quality of live in elderly patients with coronary artery disease. Eur Heart J 2004; 25 : 1814–1821.
18. Lu C, Dabrowski P, Fragasso G et al. Effects of trimetazidine on ischemic left ventricular dysfunction in patients with coronary artery disease. Am J Cardiol 1998; 82 : 898–901.
19. Fragasso G, Piatti PM, Monti L et al. Short – and long–term beneficial effects of trimetazidine in patients with diabetes and ischemic cardiomyopathy. Am Heart J 2003; 146 : 18–25.
20. Sellier P, Broustet JP. Assessment of anti–ischemic and antianginal effect at trough plasma concentration and safety of trimetazidine MR 35mg in patients with stable angina pectoris. Am J Cardiovasc Drugs 2003; 3 : 361–369.
21. Makolkin VI, Osadchiy K. Trimetazidine modified release in the treatment of stable angina. Clin Drug Invest 2004; 24 : 731–738.
22. Belardinelli R, Purcaro A. Effects of trimetazidine on the contractile response of chronically dysfunctional myocardium to low–dose dobutamine in ischemic cardiomyopathy. Eur Heart J 2001; 23 : 2164–2170.
23. Chierchia SL. Trimetazidine and left ventricular ischaemic dysfunction: an overview of clinical evidence. Eur Heart J 2001; 3(Suppl O): 16–20.
24. Fragasso G, Piatti PM, Monti L et al. Acute effects of heparin administration on the ischemic threshold of patients with coronary artery disease: evaluation of the protective role of the metabolic modulator trimetazidine. J Am Coll Cardiol 2002; 39 : 413–419.
25. Tünerir B, Colak Ö, Alatas Ö et al. Measurement of troponin T to detect cardioprotective effect of trimetazidine during coronary artery bypass grafting. Ann Thorac Surg 1999; 68 : 2173–2176.
26. Polonski L, Dec I, Wojnar R et al. Trimetazidine limits the effects of myocardial ischaemia during percutaneous coronary angioplasty. Curr Med Res Opin 2002; 18(7): 389–396.
27. Haffner SM, Lehto S, Ronnemaa T et al. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998; 339(4): 229–234.
28. Coutinho M, Gerstein HC, Wang Y et al. The relationship between glucose and incident cardiovascular events: a metaregression analysis of published data from 20 studies of 95 783 individuals followed for 12.4 years. Diabetes Care 1999; 22(2): 233–240.
29. Bartnik M, Rydén L, Ferrari R et al. The prevalence of abnormal glucose regulation in patients with coronary artery disease across Europe. The Euro Heart Survey on diabetes and the heart. Eur Heart J 2004; 25(21): 1880–1890.
30. Pyorala K, Lehto S, De Bacquer D et al (On behalf of the EUROASPIRE I and II Groups). Risk factor management in diabetic and non–diabetic patients with coronary heart disease. Findings from the EUROASPIRE I and II surveys. Diabetologia 2004; 47(7): 1257–1265.
31. Hasdai D, Behar S, Wallentin L et al. A prospective survey of the characteristics, treatments and outcomes of patients with acute coronary syndromes in Europe and the Mediterranean basin; The Euro Heart Survey of Acute Coronary Syndromes. Eur Heart J 2002; 23(15): 1190–1201.
32. Szwed H, Sadowski Z, Pachocki R et al. The antiischemic effects and tolerability of trimetazidine in coronary diabetic patients. A substudy from TRIMPOL–1. Cardiovasc Drugs Ther 1999; 13(3): 217–222.
33. Rosano GMC, Vitale C, Sposato B et al. Trimetazidine improves left ventricular function in diabetic patients with coronary artery disease: a double–blind placebo–controlled study. Cardiovasc Diabetol 2003; 2(1): 16–25.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2005 Číslo 1
-
Všechny články tohoto čísla
- Praktické aspekty a novinky ve farmakologické léčbě arytmií
- Trimetazidin v léčbě anginy pectoris a ostatních forem ICHS
- Renesance antialdosteronik v soudobé kardiologii
- Klinické studie ukončené, přednesené nebo publikované v poslední době
- Michael Aschermann et al. Kardiologie. Praha: Galén 2004. 1540 s. ISBN 8072622900
- Doporučení diagnostických a léčebných postupů u arteriální hypertenze – verze 2004
- Srdce v obraze lidových rčení
- Srdeční infarkt a změny počasí – další možné souvislosti
- Aortální stenóza
- Rehabilitace po infarktu myokardu
- Professor Medicinae Internae, Jiří Widimský
- Tomáš Baťa, podpůrce moderních trendů ve zdravotní péči, se zařadil mezi dlouhověké
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Aortální stenóza
- Doporučení diagnostických a léčebných postupů u arteriální hypertenze – verze 2004
- Trimetazidin v léčbě anginy pectoris a ostatních forem ICHS
- Praktické aspekty a novinky ve farmakologické léčbě arytmií