Problematika kardiotoxicity primární léčby pacientek s karcinomem ovaria
Cardiotoxicity of anticancer treatment in patients with ovarian cancer
Objective:
The objective of this study is to point out at the risk of cardiotoxicity of anticancer treatment in ovarian cancer patients.
Patients and Methods:
The study included 55 patients treated for epithelial ovarian cancer newly diagnosed in the period 7/2013–11/2015. Biochemical cardiotoxicity markers (NT-proBNP, cTnT, TnI, CK-MB, MYO, h-FABP, GPBB), echocardiography and electrocardiography were evaluated during primary anticancer treatment.
Results:
Chemotherapy with paclitaxel and carboplatin has an impact on the QT interval and its dispersion. Concentrations of FABP, troponin T and NT-proBNP increased with the total dose of first line cytostatic agents. We found elevated CK-myoglobin (P = 0.051) and troponin T (P = 0.53) especially in ovarian cancer patients after the administration of ten cycles of chemotherapy with paclitaxel and carboplatin and bevacizumab in comparison with ovarian cancer patients receiving standard chemotherapy only.
Conclusion:
Cardiac toxicity is one of the possible adverse events of oncology treatment. It is an interdisciplinary issue requiring close cooperation between the oncologist, cardiologist and specialist in clinical biochemistry. Therefore special attention should be paid to prevent cardiac damage or at least to its early identification and prompt treatment.
Keywords:
ovarian cancer – cardiotoxicity – electrocardiography – biochemical markers – echocardiography
Autoři:
I. Sedláková 1; R. Pudil 2; R. Praus 2; V. Študent 1; J. Špaček 1
Působiště autorů:
Porodnická a gynekologická klinika LF UK a FN Hradec Králové
1; I. interní kardioangiologická klinika LF UK a FN Hradec Králové
2
Vyšlo v časopise:
Kardiol Rev Int Med 2017, 19(1): 14-21
Souhrn
Cíl:
Cílem této práce je upozornit na možnost kardiotoxicity primární léčby u pacientek s karcinomem ovaria.
Metodika:
U 55 pacientek s epiteliálním ovariálním karcinomem nově diagnostikovaným na Porodnické a gynekologické klinice FN HK v období 7/ 2013 – 11/ 2015 jsme hodnotili biochemické markery kardiotoxicity NT-proBNP, cTnT, TnI, CK-MB, MYO, h-FABP, GPBB, echokardiografické parametry a EKG v průběhu primární léčby.
Výsledky:
Chemoterapie ve složení karboplatina/ paklitaxel má vliv na QT interval a jeho disperzi. Hodnoty markerů kardiotoxicity FABP, troponinu T a GPBB se zvýšily po intervalové operaci po 4 cyklech chemoterapie. Hodnoty FABP, troponinu T a NT-proBNP se zvyšovaly s celkovým počtem cyklů chemoterapie 1. linie. Navýšení CK-myoglobinu (p = 0,051) a troponinu T (p = 0,53) jsme pozorovali zejména u pacinetek po deseti cyklech standardní chemoterapie aklitaxel/ karboplatina a biologická léčba (bevacizumab) v porovnání s pacientkami pouze se standardní chemoterapií 1. line bez bevacizumabu.
Závěr:
Kardiotoxicita onkologické léčby je závažnou interdisciplinární problematikou, která vyžaduje úzkou spolupráci onkologa s kardiologem a také klinickým biochemikem. Protinádorová léčba má mnohé nežádoucí účinky na srdce a cévy. Je nutné myslet na nežádoucí účinky protinádorové léčby, cíleně je vyhledávat a takto nemocné pacientky racionálně a odborně léčit.
Klíčová slova:
karcinom ovaria – kardiotoxicita – echokardiografie – markery kardiotoxicity – EKG
Úvod
Karcinom ovaria je nejčastější příčinou úmrtí na gynekologické malignity. Přestože byla léčbě zhoubných nádorů ovaria věnována velká pozornost, výsledky přežití pacientek se za posledních 20 let zlepšily minimálně, a to spíše v důsledku centralizace péče do center [1]. Velkým problémem karcinomu ovaria je jeho pozdní diagnostika. Naprostá většina pacientek přichází s onemocněním v pokročilém stadiu. Chemoterapie 1. linie vede k léčebné odpovědi přibližně u 75 % pacientek s karcinomem ovaria, nicméně pětileté přežití je pouze 20 – 25 % pacientek s pokročilým ovariálním karcinomem [2]. Standardní primární léčba se skládá z chirurgického výkonu a chemoterapie (paklitaxel + karboplatina, event. cisplatina) u naprosté většiny pacientek s karcinomem ovaria. Tento režim byl stanoven jako nejefektivnější dnes již klasickou studií GOG 111 a dále potvrzen studiemi EORTC-GCCG a NOCOVA. V některých případech se dnes přidává k chemoterapii ještě biologická léčba – bevacizumab. Pacientky s primárně inoperabilním nádorem mají neoadjuvantní chemoterapii ve stejném složení paklitaxel/ karboplatina (event. cisplatina), většinou po 4 cyklech následuje intervalová operace („interval debulking surgery“) a poté znovu chemoterapie. Procento pacientek primárně inoperabilních je různé dle jednotlivých onkogynekologických center – rozpětí v ČR je přibližně 40 – 70 % pacientek s pokročilým onemocněním v současné době.
V systémové chemoterapii nádorových onemocnění se standardně využívají v klinických studiích ověřené režimy a statisticky nejúspěšnější terapie je vnímána jako nejlepší léčebný postup. Teprve při selhání léčby 1., event. 2. linie je výběr chemoterapie omezen a volba léčby není standardně určena. Nicméně, ani statisticky nejefektivnější způsob terapie není zárukou úspěšné léčby a vždy existuje podíl případů dané diagnózy, u nichž není dosaženo očekávaného účinku chemoterapie [3]. Chemoterapie je základem systémové léčby karcinomu ovaria. Jakákoli další následná léčba (biologická léčba, imunoterapie) se v současné době pouze „přidává“ k chemoterapii. Čímž se mohou potencovat vedlejší nežádoucí účinky těchto terapií. V současné době nemáme v klinické praxi k dispozici žádnou skutečně cílenou protinádorovou léčbu u pacientek s karcinomem ovaria, která by působila cíleně jenom na nádorové buňky. U všech chemoterapeutických protokolů se setkáváme s řadou nežádoucích účinků, kromě jiného na kardiovaskulární (KV) systém. Všechny protinádorové léky mají za cíl zničení buňky, nicméně tímto cílem se mohou stát i okolní a vzdálené tkáně. Zatímco efekt na rychle proliferující linie buněk nádorové tkáně je znám, obdobně může působit léčba např. myelosupresi nebo vést k toxicitě v trávicím ústrojí [4]. Vzhledem k tomu, že srdce je vitálním orgánem s nevelkou funkční rezervou a značně omezenou regenerační schopností, je kardiotonický efekt terapeutik vždy mimořádně závažnou komplikací. Mezi nejzávažnější KV vedlejší účinky protinádorové léčby patří poškození srdečního svalu, které vede k dočasnému nebo trvalému snížení funkce levé komory (LK). Jako důsledek chemoterapie se dokonce může rozvinout nebo plně projevit ischemická choroba srdeční (ICHS). Časté jsou rovněž změny krevního tlaku (TK) a poruchy jeho autonomní regulace a též změny elektrické aktivity srdeční projevující se jako arytmie či prodloužení QT intervalu [5].
Kardiotoxicita je popsána u celé řady cytostatik a dotýká se i moderní biologické léčby [4]. Kardiotonický efekt je popsán mimo jiné také u taxanů, u biologické léčby a cisplatiny [6], které se v léčbě ovariálního karcinomu běžně používají. Taxany se běžně používají v 1. a dalších liniích chemoterapie u pacientek s pokročilým ovariálním karcinomem. Taxany izolované z kůry stromu tisu (Taxus brevifola) a semisyntetizované z jehličí evropského druhu tisu Taxus baccate patří do skupiny hyperstabilizátorů mikrotubulů. Taxany stabilizují tubulinový řetězec s navázaným guanosindifosfátem, kvůli čemuž mikrotubulus nemá možnost disociovat. Mitóza tedy nemůže být dokončena a zastaví se v metafázi (tzv. frozen mitosis). Toxicita přírodních alkaloidů je vysoká. Hematologická toxicita představuje nejzávažnější problém při terapii tímto druhem cytostatik. Projevuje se především neutropenií a trombocytopenií. Podání léků je též provázeno celým spektrem arytmií a hypotenzí [5]. Taxany jsou používány v kombinaci s jinými cytostatiky, která mají vlastní kardiotonický potenciál. Paklitaxel vyvolává především vznik srdečních arytmií (30 %) a ischemii myokardu (0,1 %) [4]. Již v 90. letech minulého století popsali Rowinsky et al na podkladě analýzy 4 klinických studií výskyt ICHS po podání paklitaxelu. Manifestace ICHS byla popsána v 5 % případů. Nejvíce příhod se vyskytlo 14 dnů po podání cytostatika a ve většině případů se jednalo o nemocné s již přítomnými riziky ICHS [7,8].
Hypertenze zvláště za přítomnosti hypertenzní remodelace srdce je závažným rizikovým faktorem kardiotoxicity, který významně negativně ovlivňuje prognózu onkologického pacienta [9]. Některé nové postupy v léčbě nádorů vedou ke vzniku hypertenze. Jedná se především o preparáty ovlivňující proces angiogeneze. Pravděpodobně snižují hladinu endoteliálního NO, zvyšují hladiny PAI-1 nebo působí stimulací osy renin-angiotenzin-aldosteron [10]. Hypertenze je závažným a častým následkem léčby bevacizumabem. Bevacizumab (Avastin) je v současné době indikován v primární léčbě u pacientek s karcinomem ovaria III. nebo IV. stadia s reziduem větším než 1 cm, což je více než polovina pacientek s pokročilým onemocněním. Bevacizumab je rekombinační humanizovaná monoklonální protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF). VEGF hraje klíčovou roli v procesu angiogeneze, proto je důležitý pro růst a invazi nádorů. VEGF má též dosud ne zcela přesně popsanou úlohu v reakci srdce na poškození, zejména krátkodobou či dlouhodobou ischemii. Bevacizumab blokací aktivity VEGF pravděpodobně narušuje reparační a adaptační mechanizmy srdce, což způsobuje vyšší vulnerabilitu srdce vůči následným inzultům. Antiangiogenním působením tohoto preparátu zřejmě dochází k redukci kapilárního řečiště, které může vést k poškození srdečního svalu s následným srdečním selháváním (SS) [11]. U pacientek s metastazujícím karcinomem prsu léčených bevacizumabem byl zjištěn výskyt závažného SS v 1,6 % [12].
Nelze zapomenout vliv arteriální hypertenze indukované touto protilátkou na srdeční dysfunkci [6]. Incidence byla popsána ve 4 – 35 % případů, přičemž hypertenze III. stadia byla popsána v 11 – 18 %. Asi u 2 % nemocných musela být léčba přerušena pro hypertenzní encefalopatii nebo krvácení do mozku. K vývoji hypertenze dochází zhruba po 4 týdnech léčby [13]. Po přidání bevacizumabu ke standardní chemoterapii dochází ke zvýšení výskytu arteriální trombózy. Analýza pěti randomizovaných studií prokázala výskyt v 3,8 %. Výskyt koronární trombózy je ve studiích popisován u 1,5 – 1,8 %, přičemž k srdečnímu infarktu může dojít kdykoli v průběhu terapie. Věk nad 65 let je v tomto případě závažným rizikovým faktorem [14].
Zvláště u nových protinádorových léků neexistují o kontraindikacích dostatečné informace. Do klinických studií nebyli zařazováni pacienti s KV onemocněním. Informace z preklinických prací jsou nesourodé a nejednoznačné. Proto je nezbytné, aby byly tímto směrem zacíleny preklinické a v návaznosti na ně také klinické studie. Je zřejmé, že protinádorová léčba má mnohé nežádoucí účinky na srdce a cévy [15]. Je nutné na tyto nežádoucí účinky myslet, cíleně je vyhledávat a takto nemocné pacienty racionálně a odborně léčit. Zejména je vhodné být obezřetný u pacientů, kteří trpí KV nemocí již před zahájením chemoterapie [5].
V současnosti se proto kardiotoxicita jednotlivých léků a léčebných postupů intenzivně studuje. V řadě center ve světě vznikly týmy kardiologů a onkologů, které na tomto interdisciplinárním poli hledají optimální podmínky pro vedení onkologické léčby s minimálními následky pro srdce pacienta [16,17]. Standardně se k diagnostice a monitorování kardiotoxicity používá echokardiografické (ECHO) vyšetření, které umožňuje neinvazivní hodnocení srdeční funkce [18]. Výhodou ECHO vyšetření je, že jde o standardně používanou metodu k hodnocení kardiotoxicity onkologické léčby. Jsou definována kritéria kardiotoxicity na ECHO vyšetření, která nutí k modifikaci, popř. i ukončení léčby [19]. Nicméně diagnostika a kvantifikace kardiotoxicity vyžaduje vedle echokardiografie i podrobný laboratorní a klinický pohled. V poslední době se do popředí zájmu dostávají biochemické markery poškození myokardu, zejména natriuretické peptidy a srdeční troponiny. Natriuretické peptidy – axiální natriuretický peptid (ANP), brain natriuretický peptid (BNP) a NT-proBNP (N-terminální pro brain natriuretický peptid) – jsou produkovány myokardem v důsledku napětí stěny a tlakového přetížení [20]. BNP/ NT-proBNP je produkován zejména v komorách. V kardiologii se dnes běžně používají k diagnostice SS [21]. Pomocí BNP je možné odhalit nemocné s klinicky a ECHO nezjištěnými známkami SS [22]. Použitelností natriuretických peptidů jako markerů kardiotoxicity onkologické léčby se zabývalo několik poměrně malých studií. Výsledky naznačují, že natriuretické peptidy by mohly být užitečné pro detekci klinické i subklinické kardiotoxicity [23 – 26] i jako ukazatele pozdní kardiotoxicity po vysokodávkované chemoterapii a transplantaci krvetvorných buněk [27,28]. Zatím však chybí definitivní klinické vyhodnocení [18].
Cílem této práce je upozornit na riziko možných vedlejších účinků ve smyslu kardiotoxicity u pacientek s karcinomem ovaria. Proto jsme v rámci grantu IGA MZ ČR NT 14107 pilotně sledovali markery kardiotoxicity, echokardiografické parametry a EKG v průběhu primární léčby pacientek s karcinomem ovaria.
Soubor pacientek a metodika
Soubor pacientek
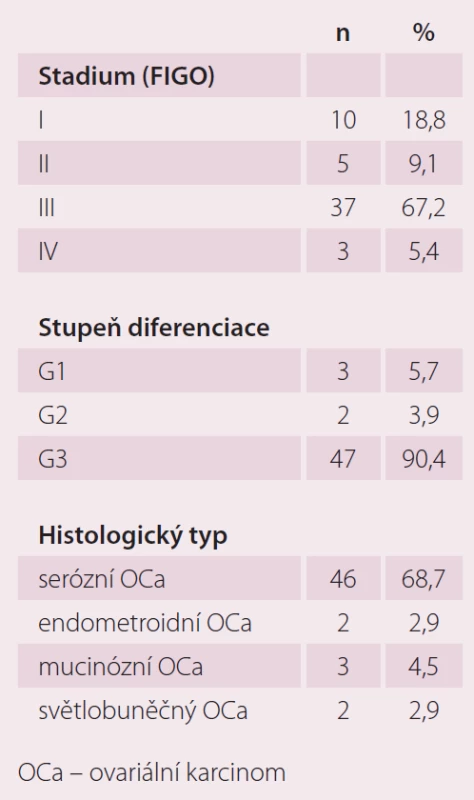
Hodnotili jsme vzorky pro jednotlivé biochemické markery kardiotoxicity u 55 pacientek s epiteliálním ovariálním karcinomem nově diagnostikovaných na Porodnické a gynekologické klinice FN HK v období 7/ 2013 – 11/ 2015. Průměrný věk testovaných pacientek byl 61,0 let. Stadium bylo stanoveno dle FIGO klasifikace (International Federation of Obstetrics and Gynecology). Histopatologický typ ovariálního karcinomu byl stanoven dle WHO klasifikace (World Health Organization). Pacientky s jinými histologickými typy karcinomu ani borderline tumory jsme do této práce nezahrnuli. Bližší charakteristika souboru viz tab. 1.
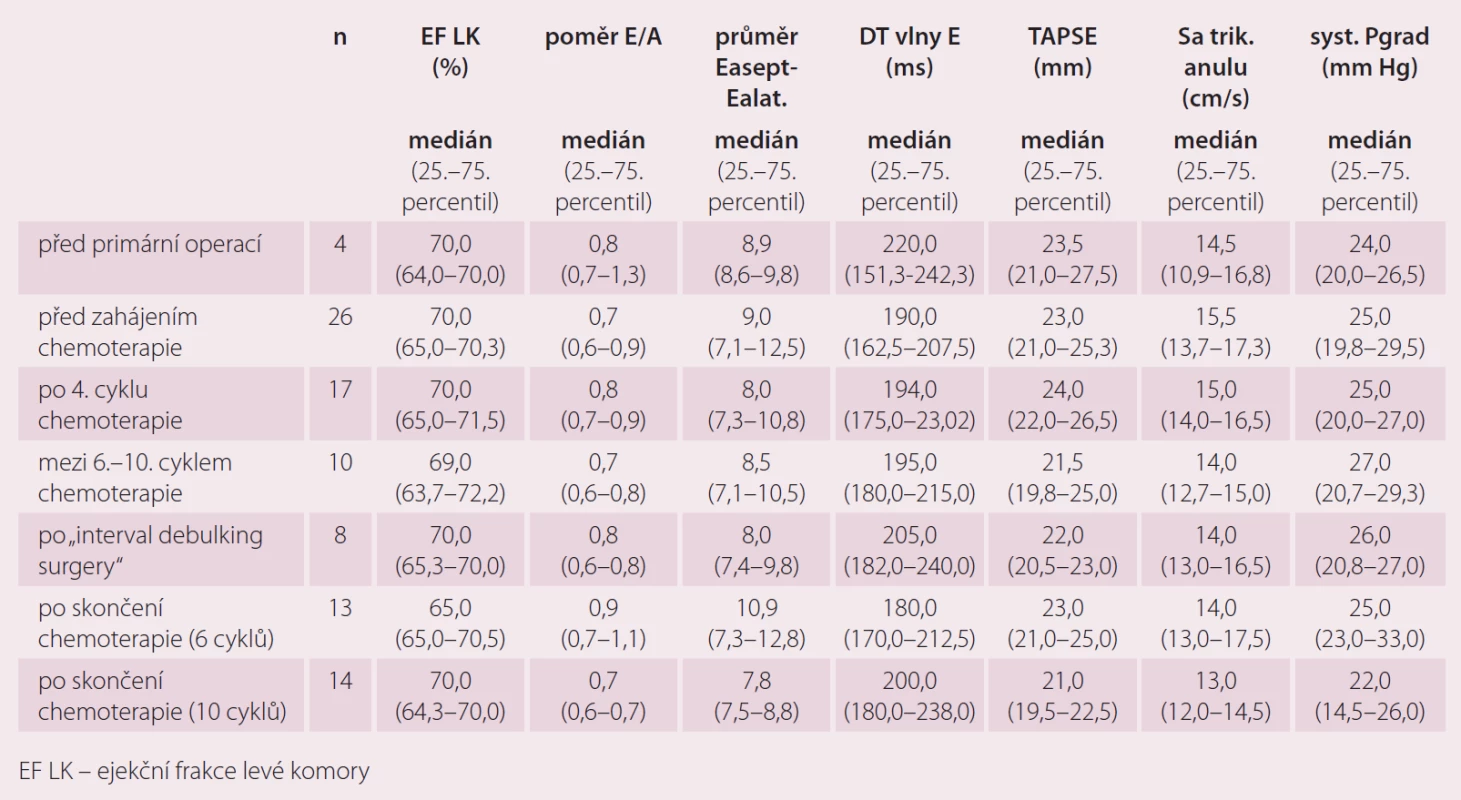
U pacientek s karcinomem ovaria jsme markery kardiotoxicity, ECHO a EKG srdce hodnotili před primární operací (n = 35), před zahájením chemoterapie 1. linie (n = 35), po 4. cyklu chemoterapie 1. linie (n = 19), pokud pacientky měly intervalovou operaci, tak po interval debulking surgery” (n = 9), po skončení chemoterapie 1. linie (6 cyklů) (n = 14), po skončení chemoterapie 1. linie (10 cyklů) (n = 14).
Metodika
Z biochemických markerů jsme stanovovali plazmatické koncentrace NT-proBNP, cTnT (kardiální troponin T), TnI (kardiální troponin I) a CK-MB mass (MB izoenzym kreatinkinázy), MYO (myoglobin), H-FABP (srdeční typ proteinu vázajícího mastné kyseliny), GPBB (BB izoenzym glykogenfosforylázy). Odběry žilní krve byly provedeny do zkumavek s EDTA. Krev byla centrifugována, plazma stažena, ihned zamražena a skladována při – 27 °C do doby stanovení. Koncentrace GPBB byla stanovena pomocí metody ELISA na přístroji PowerWave XS, Biotek. Metoda funguje na bázi vysoko specifické interakce mezi antigenem a protilátkou.
TnI – koncentrace troponinu I v krevním séru byla stanovena komerčním kitem od firmy Abbott na přístroji Architect i 1000SR. Principem měření je metoda CMIA (chemiluminiscenční imunoanalýza na mikročásticích). TnT, NT-proBNP, CK-MB, myoglobin, H-FABP – byly naměřeny na přístroji Cobas 8 000 (Roche) s použitím komerčních kitů firmy Roche. Výjimkou bylo stanovení koncentrace H-FABP, u kterého byl použit komerčně dostupný kit od firmy Randox.
Echokardiografické vyšetření bylo provedeno na přístroji Vivid 7 (GE) zkušeným echokardiografistou. Ve studii byla hodnocena:
- systolická a diastolická funkce LK – ejekční frakce (EF LK) (%). EF LK byla stanovena metodou podle Teichholze. E vlna (cm/s), A vlna (c/ms), poměr E/ A, DT vlny E (ms), Ea septální (cm/ s), Aa septální (cm/ s), Ea laterální (cm/ s), Aa laterální (cm/ s), Sa laterální (cm/ s), průměr Ea septální - Ea laterální;
- systolická funkce pravé komory – TAPSE (mm), Sa trikusp. anulu (cm/ s);
- hodnocení plicní hypertenze – syst. pgrad na trikuspidální chlopni (mm Hg);
- rozměry – LK – diastola (mm), LK – systola (mm), levá síň velikost (PLAX) (mm), PK – velikost projekce PLAX (mm).
Statistické zpracování
Pro vyhodnocení kvalitativních dat byl použit χ2 test nezávislosti v kontingenční tabulce, případně Fisherův exaktní test. Vzhledem k tomu, že byla u většiny případů zamítnuta normalita, použili jsme pro hodnocení kvantitativních dat medián (Med) a pro stanovení míry rozptylu jsme využili 95% interval spolehlivosti (Confidence Interval – CI). Pro porovnání dvou skupin jsme použili dvouvýběrový t-test, v případě nenormálně rozložených dat jsme použili neparametrický Mann-Whitney test, případně Kolmogorov-Smirnov test. Za statisticky významnou jsme zvolili hladinu významnosti p < 0,05.
Výsledky
Možnosti elektrokardiogramu v diagnostice kardiotoxicity – vliv terapie ovariálního karcinomu na některé echokardiografické parametry (tab. 2)
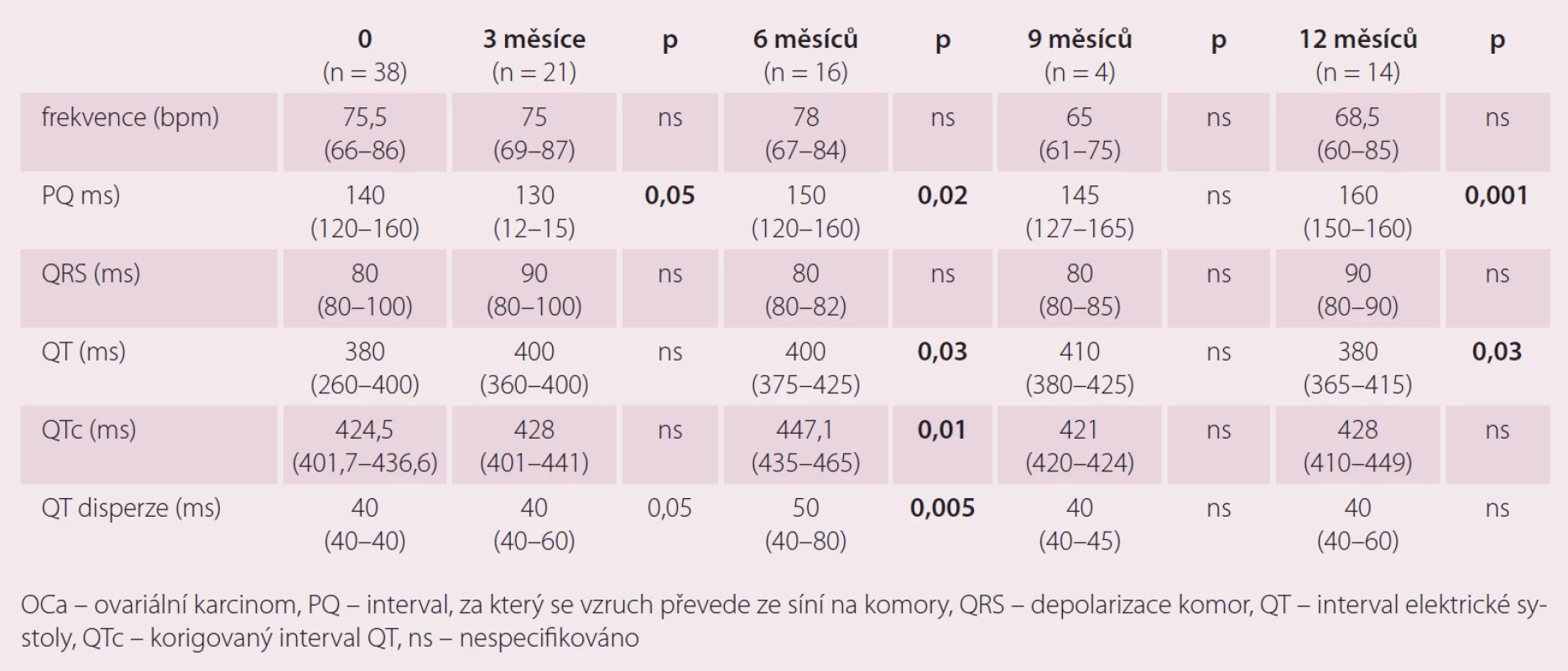
I přes relativně malý počet pacientek vyplývá z výsledků nárůst délky QT a QTc intervalu a disperze QT především v době 6 měsíců od zařazení do studie, s ukončením terapie a s časovým odstupem dochází opět k úpravě hodnot těchto parametrů. Ukazuje se tedy, že tyto změny byly reverzibilní. Uvedené výsledky ukazují na vliv podané chemoterapie na QT interval a jeho disperzi. Tento nález lze považovat za projev kardiotoxicity. Vzhledem ke známé skutečnosti, že oba parametry jsou považovány za možný prediktor výskytu komorových arytmií, může standardní 12svodové EKG sloužit jako vhodný nástroj k detekci potenciálně rizikových pacientek. Během studie jsme zaznamenali změny PQ intervalu, které měly v průběhu sledování bifazický průběh, pokles ve 3. měsíci a následný trend k vzestupu do konce sledování. Výraznější změny TK jsme v našem souboru nepozorovali. Poměrně malý počet probandek v jednotlivých měřeních však neumožňuje provést podrobnější analýzu.
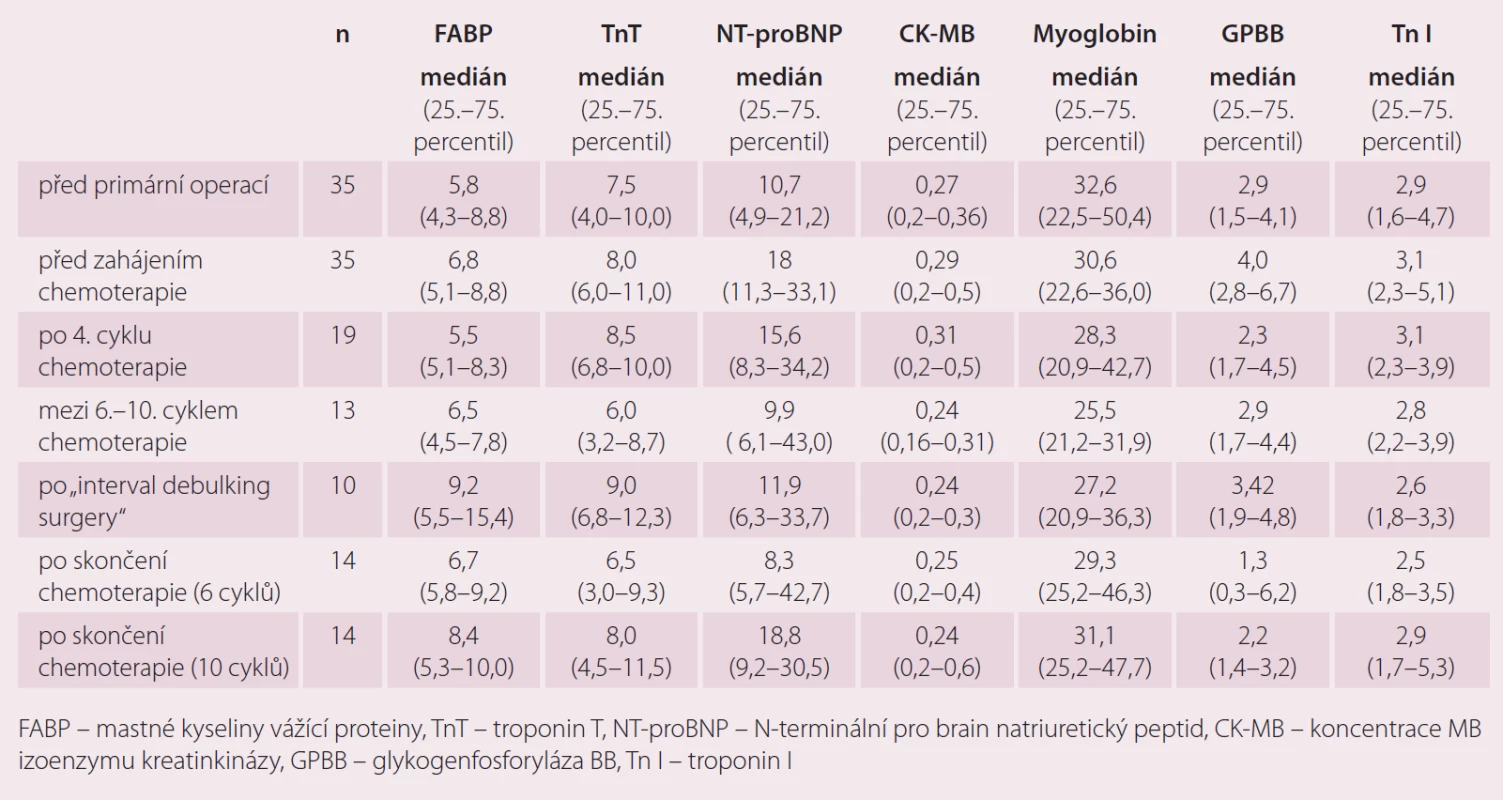
Markery kardiotoxicity v průběhu primární léčby pacientek s karcinomem ovaria
Ze sledovaných markerů kardiotoxicity došlo k navýšení FABP zejména po intervalové operaci po čtyřech cyklech chemoterapie 1. linie a pak následně po skončení chemoterapie 1. linie, a to zejména u pacientek, které dostaly v rámci 1. linie 10 cyklů kombinace karboplatina/ paklitaxel. U troponinu T jsme pozorovali nárůst zejména po intervalové operaci po předchozích 4 cyklech chemoterapie a po skončení chemoterapie s 10 cykly. Poměrně velký nárůst NT-proBNP jsme zaznamenali po primární operaci, po 4. cyklu chemoterapie a následně pak po 10 cyklech chemoterapie. Výraznější změny CK-MB v závislosti na podání chemoterapie jsme u pacientek s karcinomem ovaria nepozorovali. Plazmatické hodnoty myoglobinu byly bez výraznějších změn v závislosti na podání následné léčby u pacientek s karcinomem ovaria. Nárůst plazmatických hodnot GPBB jsme pozorovali zejména po primární operaci a po intervalové operaci po čtyřech cyklech chemoterapie (tab. 3).
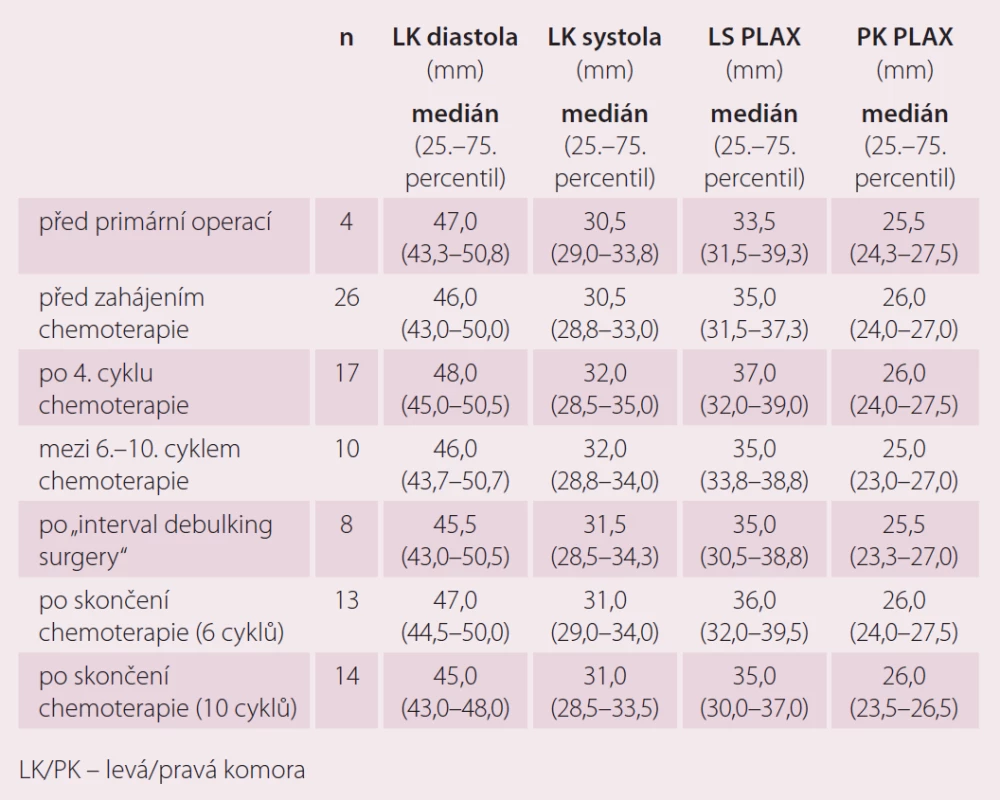
Echokardiografické markery v průběhu primární léčby pacientek s karcinomem ovaria
U echokardiografických parametrů jsme zatím výraznější rozdíly hodnot nezaznamenali (tab. 4 a 5). Pravděpodobně je to zkresleno tím, že jsme prováděli pouze porovnání celkové a ne párové porovnání jednotlivých vyšetření, pro které zatím nemáme dostatek sourodých dat. Párové porovnání bude pro tyto výsledky zásadní.
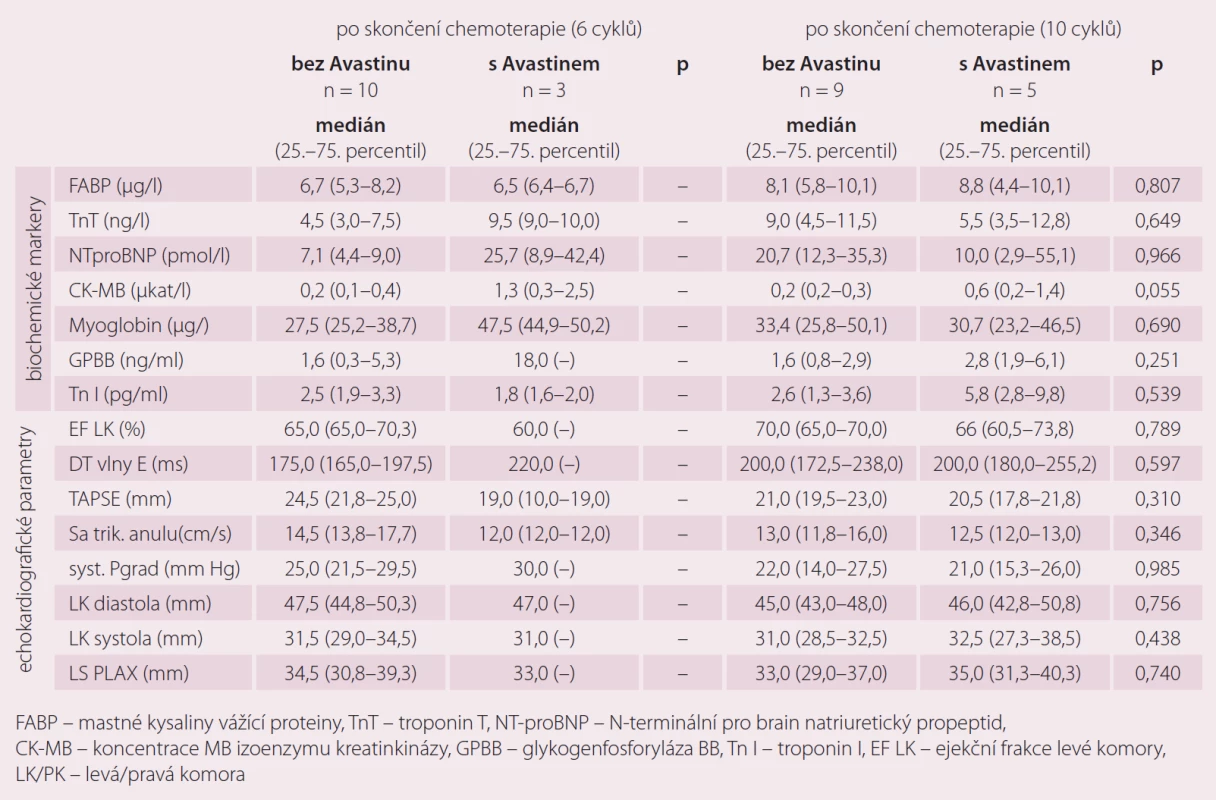
U malé skupiny pacientek s karcinomem ovaria jsme porovnávali zatím pouze orientačně markery kardiotoxicity u pacientek s chemoterapií 1. linie bez bevacizumabu (n = 9) a pacientek s chemoterapií a zároveň biologickou léčbou bevacizumabem spolu od 2. cyklu chemoterapie (n = 5). I přes malý počet pacientek v této části jsme zaznamenali statisticky významné rozdíly (p = 0,051) v hodnotách CK-myoglobinu po skončení chemoterapie 6 cyklů a po skončení chemoterapie 10 cyklů. Výraznou změnu, i když ne statisticky významnou (p = 0,53), jsme zaznamenali také u troponinu I. Jeho navýšení jsme pozorovali zejména u pacinetk po deseti cyklech standardní chemoterapie paklitaxel/ karboplatina a biologická léčba (bevacizumab) v porovnání s pacientkami pouze se standardní chemoterapii 1. linie bez bevacizumabu (tab. 6).
Diskuze
Protinádorová chemoterapie zaznamenala v minulých desetiletích významný rozvoj. Původně byla pouze doplňkovou léčbou, ale postupně nabývala významu standardní léčebné metody a stala se rovnocennou léčbě chirurgické a radioterapii. V posledních letech význam chemoterapie ještě stoupl, protože velká část pacientek začíná v primární léčbě neoadjuvantní chemoterapií a teprve po 4 cyklech chemoterapie je operována. Pak opět následuje chemoterapie. Současná chemoterapie je založena převážně na empirických zkušenostech a generalizaci výsledků rozsáhlých klinických studií, aniž by respektovala individualitu nemocného a biologickou odlišnost každého nádoru. Je více než pravděpodobné, že zohlednění faktorů individuality a možnosti jejich posouzení může do značné míry optimalizovat výběr protinádorových farmak i jejich dávky, což ve svých důsledcích příznivě ovlivní terapeutický efekt a sníží riziko nežádoucích účinků [16]. Účinek cytostatik není přísně specifický pro nádorové buňky, ale působí toxicky i na normální buňky. Užití chemoterapie s kurativním záměrem je téměř vždy spojeno s balancováním mezi snahou potlačit nádorové bujení na straně jedné a nepoškodit nežádoucími účinky už tak dost nemocného pacienta na straně druhé.
Kardiotoxicita je závažnou komplikací onkologické léčby. K monitorování kardiotoxicity se standardně užívá ECHO a EKG vyšetření. Podle literárních údajů se může chemoterapie (především antracykliny, ale i řada dalších látek) projevit některými změnami EKG. Doposud byla popsána řada změn, které jsou považovány za projevy kardiotoxicity. Patří mezi ně výskyt extrasystol (supraventrikulárních i komorových), arytmie (fibrilace síní, komorové arytmie), změny repolarizace či změny v délce QRS komplexu a QTc intervalu. Některé z těchto změn jsou významné a mají i prognostický význam. Patří mezi ně délka QT intervalu korigovaná na srdeční frekvenci (QTc) a disperze QT intervalu hodnocená jako rozdíl mezi nejdelším a nejkratším trváním QT intervalu (QTd). Prodloužení délky QTc a zvýšení hodnoty disperze QT intervalu jsou považovány za prediktory rizika vzniku maligních arytmií. Některé experimentální studie prokázaly, že chemoterapie může ovlivnit také PQ interval. Proto jsme se na tyto parametry v naší studii zaměřili.
Dle našich výsledků má chemoterapie ve složení karboplatina/ paklitaxel vliv na QT interval a jeho disperzi. Tento nález lze považovat za projev kardiotoxicity. Tento parametr je považován za možný prediktor výskytu komorových arytmií. 12svodové EKG může sloužit jako vhodný nástroj k detekci potenciálně rizikových pacientek. I z tohoto důvodu by se všem pacientkám před zahájením a pak v průběhu chemoterapie 1. linie a pravděpodobně i dalších linií chemoterapie mělo provést min. 12svodové EKG, abychom vytipovali pacientky rizikové z hlediska kardiotoxicity. Tyto potenciálně rizikové pacientky by si zcela jistě zasloužily péči kardiologa i přesto, že mají prognosticky tak nepříznivé onemocnění, jako je karcinom ovaria.
Významnější rozdíly v ECHO parametrech jsme zatím v našem souboru neprokázali. Domníváme se, že zejména ve sledování těchto parametrů je nutné párové porovnání dat, které jsme zatím z důvodu malého počtu zpárovaných vyšetření nemohli provést. Výhodou ECHO vyšetření je, že jde o standardně používanou metodu k hodnocení kardiotoxicity onkologické léčby. Bylo prokázáno, že onkologická léčba obsahující antracykliny vede ke změnám ECHO parametrů v čase a incidence těchto změn narůstá s dávkou antracyklinů [19].
V poslední době jsou studovány i biochemické markery, zejména natriuretické peptidy a srdeční troponiny. Použitelnost natriuretických peptidů (ANP, BNP, NT-proBNP) jako markerů kardiotoxicity onkologické léčby byla studována v několika studiích z poslední doby. Výsledky těchto studií naznačují, že natriuretické peptidy by mohly být přínosné pro detekci klinické i subklinické kardiotoxicity i jako ukazatele pozdní kardiotoxicity po vysokodávkované chemoterapii [18,27,28]. Zatím však chybí definitivní klinické vyhodnocení a natriuretické peptidy se rutinně v této indikaci nepoužívají. U kombinace cytostatik karboplatina/ paklitaxel, která se standardně užívá v chemoterapii 1. linie a dalších liniích u pacientek s karcinomem ovaria, se zatím kardiotoxicita významně nesledovala.
Z našich výsledků vyplývá nárůst části markerů kardiotoxicity jednak po intervalové operaci a dále pak po skončení chemoterapie. FABP a NT-proBNP se ukazují jako nejcitlivější markery kardiotoxicity ze všech námi sledovaných parametrů kardiotoxicity. Jejich nárůst po skončení chemoterapie tedy může být prvním impulzem poškození KV systému. Zajímavé je, že k nárůstu těchto markerů došlo po skončení chemoterapie 1. linie, ale pouze pokud pacientky dostaly v rámci 1. linie celkem 10 cyklů chemoterapie ve složení paklitaxel/ karboplatina. Pokud měly pacientky v rámci 1. linie chemoterapie celkem 6 cyklů chemoterapie, výraznější nárůst hodnot FABP ani NT-proBNP jsme nepozorovali. Je tedy možné, že s narůstajícím počtem cyklů chemoterapie ve složení paklitaxel/ karboplatina může narůstat i kardiotoxicita dané léčby. Při párovém porovnání markerů kardiotoxicity došlo ke změnám více sledovaných parametrů zejména v období mezi 6. až 10. aplikací chemoterapie 1. linie. Což by mohlo potvrzovat nárůst toxicity chemoterapie s nabývajícím počtem cyklů. Standardně dostávají pacientky s karcinomem ovaria 6 cyklů chemoterapie 1. linie ve složení karboplatina a paklitaxel. Pokud začínají neoadjuvantní chemoterapií následovanou intervalovou operací, pak mají celkem 10 cyklů chemoterapie 1. linie. Větší počet cyklů již v dřívějších studiích neprokázal zvýšení léčebného efektu.
Zajímavým výsledkem je také, že hodnoty některých markerů kardiotoxicity se poměrně výrazně zvýšily po intervalové operaci. Intervalová operace se provádí většinou po 4 cyklech chemoterapie 1. linie u pacientek s primárně inoperabilním nádorem. Vzhledem k tomu, že je těchto pacientek 40 – 70 % s pokročilým karcinomem ovaria v závislosti na jednotlivých onkogynekologických centrech v ČR, měl by nás i tento efekt zajímat. Protože je možné, že efekt kardiotoxicity chemoterapie by se mohl potencovat chirurgickým výkonem, event. vlivem celkové anestezie. Pokud by se naše domněnky potvrdily, mohlo by to vést k preferenci postupu primární operace a pak chemoterapie. Pro potvrzení nebo vyloučení našich závěrů je třeba dalších studií na větším souboru pacientek.
V současné době nemůžeme spolehlivě posoudit skutečné následky podávání chemoterapie na KV systém léčených žen. My jsme v této práci pilotně hodnotili pouze pacientky, které dostávaly 1. linii chemoterapie, nehodnotili jsme kardiotoxicitu u pacientek s karcinomem ovaria léčených standardně několika liniemi chemoterapie, a tedy různými cytostatiky a různými režimy. Pokročilý karcinom ovaria není v současné době kurabilní nádor. Naprostá většina pacientek sice dobře zareaguje na primární léčbu – dosáhne remise onemocnění, ale u naprosté většiny pacientek se objeví recidiva. Nejsou výjimkou pacientky, které remise onemocnění po skončení primární léčby ani nedosáhnou. Při objevení se recidivy či nedosáhnutí remise onemocnění zahajujeme 2. linii a následně pak další linie chemoterapie. Od 2. linie chemoterapie a výše hovoříme o paliativní chemoterapii v případě pacientek s karcinomem ovaria. Typická pacientka s karcinomem ovaria dostává několik linií chemoterapie. Vyjímkou nejsou ženy s 5 liniemi chemoterapie – tedy několik různých cytostatických režimů. Přitom v současné době nesledujeme ani vedlejší efekt jednotlivých cytostatik. Nezanedbatelný bude jistě efekt „střádajících se vedlejších účinků“ s jednotlivými podanými dalšími cytostatiky. Vzhledem k tomu, že většina pacientek s pokročilým ovariálním karcinomem má velmi špatnou prognózu, málokdo v současné době skutečně řeší a vůbec se zamýšlí nad možností „poškození“ pacientky stávající chemoterapií. V současnosti se velmi dbá na kvalitu života onkologických pacientů. Pacientky určitě díky současným antiemetikům méně zvrací a je jim méně špatně. Ale na druhé straně nejsou cíleně vyhledávány a sledovány pacientky, kterým může v dalších liniích chemoterapie možná i dost ublížit z hlediska vedlejších účinků chemoterapie. Alespoň pacientky s hypertenzí či jiným KV onemocněním by měly být sledovány v kardiologické ambulanci a měly by mít minimálně EKG před zahájením chemoterapie.
Pacientky s karcinomem ovaria s hypertenzí jsou často sledovány pouze u praktického lékaře a nejsou sledovány v kardiologických ambulancích. Ani tyto pacientky nemají před zahájením chemoterapie alespoň základní vyšetření, jakým je EKG. Otázkou je, jak to vidí kardiologové, pokud začneme posílat do specializovaných kardiologických poraden pacientky s tak prognosticky závažným onemocněním, které ale mají v danou chvíli ještě velmi dobrou kvalitu života. Problémem také je, že v posledních letech už se ani u pacientek s karcinomem ovaria, které zemřou v nemocnici, neprovádí pitva. Důvod úmrtí je primární onemocnění – karcinom ovaria. Ve skutečnosti však vůbec neznáme reálný stav jejich KV systému.
Závěr
Kardiotoxicita onkologické léčby je závažnou interdisciplinární problematikou, která vyžaduje úzkou spolupráci onkologa s kardiologem a také klinickým biochemikem. Vzhledem k nutnosti podání cytostatik u pacientek s karcinomem ovaria se nelze nevyhnout těmto nežádoucím účinkům, vždy je ale potřeba přistupovat k jednotlivým pacientkám individuálně, úzce spolupracovat s internistou-kardiologem a v případě objevení se těchto komplikací vhodně onkologickou léčbu upravit nebo zastavit. Je třeba si uvědomit, že kardiotoxicita způsobená protinádorovou léčbou může nejen ovlivnit kvalitu života nemocného, ale i podstatně zkrátit jeho dobu přežívání.
Tato práce byla podpořena výzkumným záměrem IGA MZ ČR NT 14107.
Doručeno do redakce: 11. 2. 2017
Přijato po recenzi: 23. 2. 2017
doc. MU Dr. Iva Sedláková, Ph.D.
www.fnhk.cz
iva.sedlakova@fnhk.cz
Zdroje
1. Cibula D, Petruželka L a kol. Onkogynekologie. 1. vyd. Praha: Grada Publishing 2009 : 614.
2. Talač R, Žaloudík J, Hajdúch M et al. Hodnocení lékové rezistence in vitro a její klinické implikace. Klin Onkol 2000; 13(Speciál2): 2 – 3.
3. Michalová E, Poprach A, Němečková I et al. Predikce citlivosti nádorových buněk k chemoterapeutikům ex vivo – úskalí a limitace vlastní metody. Klin Onkol 2008; 21(3): 93 – 97.
4. Elbl L. Kardiotoxicita protinádorové léčby. Postgraduál Med 2011; 13(7): 799 – 806.
5. Dufek D, Stračina T, Nováková M. Kardiovaskulární nežádoucí účinky protinádorových léčiv. Onkologie 2014; 8(6): 264 – 268.
6. Poprach A, Petráková K, Vyskočil J et al. Kardiotoxicita léků používaných v onkologii. Klin Onkol 2008; 21(5): 288 – 293.
7. Rowinski EK, McGuire WP, Guarnieri T et al. Cardiac disturbances during the administrativ of taxol. J Clin Oncol 1991; 9(9): 1704 – 1712.
8. Arbuck SG, Strauss H, Rowinski E et al. A reassessment of cardiac toxicity associated with taxol. J Natl Cancer Inst Monogr 1993; 15 : 117 – 130.
9. Ray A, Ray S, Koner BC. Hypertension, cancer and angiogenesis: relevant epidemiological and pharmacological aspects. Indian J Pharmacol 2004; 36(6): 341 – 347.
10. Kamba T, McDonald DM. Mechanisms of adverse effects of anti-VEGF therapy for cancer. Br J Cancer 2007; 96(12): 1788 – 1795.
11. D’Adamo DR, Anderson SE, Albritton K et al. Phase II study of doxorubicin and bevacizumab for patient with metastatic soft-tissue sarcomas. J Clin Oncol 2005; 23(28): 7135 – 7142.
12. Choueiri TK, Mayer EL, Je Y et al. Congestive heart silure risk in patients with breast cancer treated with bevacizumab. J Clin Oncol 2011; 29(6): 632 – 638. doi: 10.1200/ JCO.2010.31.9129.
13. Chu TF, Rupnick MA, Kerkela R et al. Cardiotoxicity associated with thyrosine kinase inhibitor sunitinib. Lancet 2007; 370(9604): 2011 – 2019.
14. Scappaticci FA, Skillings JR, Holden SN et al. Arterial thromboembolic events in patients with metastatic carcinoma treated with chemotherapy and bevacizumab. J Natl Cancer Inst 2007; 99(16): 1232 – 1239.
15. Elbl L, Hrstková H, Chaloupka V et al. Poškození srdce protinádorovou léčbou. 1. vyd. Praha: Grada Publishing 2002 : 156.
16. Cardinale D. A new frontier: cardio-oncology. Cardiologia 1996; 41(9): 887 – 881.
17. Yeh ET, Bickford CL. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis, and management. J Am Coll Cardiol 2009; 53(24): 2231 – 2247. doi: 10.1016/ j.jacc.2009.02.050.
18. Horáček JM, Pudil R, Tichý M et al. Využití biochemických markerů při hodnocení akutní a chronické kardiotoxicity antracyklinů u hematologických pacientů. Klin Biochem Metab 2007; 15(1): 43 – 49.
19. Elbl L, Hrstková H, Chaloupka V et al. Diagnostické možnosti pozdních následků kardiotonické chemoterapie antracykliny. Vnitř Lék 2002; 48(10): 981 – 988.
20. Yasue H, Yoshimura M, Sumida H et al. Localization and mechanism of secretion of B-type natriuretic peptide in comparison with those of A-type natriuretic peptide in normal subjects and patients with heart silure. Circulation 1994; 90(1): 195 – 203.
21. Remme WJ, Swedberg K. Guidelines for the diagnosis and treatment of chronic heart silure. Eur Heart J 2001; 22(17): 1527 – 1560.
22. Jabor A, Pavlisová M, Kluh T et al. Stanovení natriuretických peptidů umožňuje predikci srdečního selhávání. Klin Biochem Metab 1999; 7(28): 44 – 48.
23. Bauch M, Ester A, Kimura B et al. Atrial natriuretic peptide as a marker for doxorubicin-induced cardiotoxic effects. Cancer 1992; 69(6): 1492 – 1497.
24. Suzuki T, Hayashi D, Yamazaki T et al. Elevated B-type natriuretic peptide levels after anthracyclines administrativ. Am Heart J 1998; 136(2): 362 – 363.
25. Nousiainen T, Jantunen E, Vanninen E et al. Acute neurohumoral and cardiovascular effects of idarubicin in leukemia patients. Eur J Haematol 1998; 61(5): 347 – 353.
26. Okumura H, Iuchi K, Yoshida T et al. Brain natriuretic peptide is a predictor of anthracyclines-induced cardiotoxicity. Acta Haematol 2000; 104(4): 158 – 163.
27. Sandri MT, Salvatici M, Cardinale D et al. N-terminal pro B-type natriuretic peptide after high-dose chemotherapy: a marker predictive of cardiac dysfunction? Clin Chem 2005; 51(8): 1405 – 1410.
28. Niwa N, Watanabe E, Hamaguchi M et al. Early and late elevation of plasma atrial and brain natriuretic peptides in patients after bone marrow transplantation. Ann Hematol 2001; 80(8): 460 – 465.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2017 Číslo 1
-
Všechny články tohoto čísla
- Kardiotoxicita protinádorových léčiv v experimentu
- Problematika kardiotoxicity primární léčby pacientek s karcinomem ovaria
- Pozdní následky kardiotoxicity
- Kardiotoxicita – současná doporučení
- Kardiotoxicita u hematoonkologických pacientov
- Rivaroxaban – farmakologický profil
- Edoxaban – farmakologický profil
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Moderní antitrombotická léčba po AKS – využíváme ji dostatečně?
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Betablokátory v registru chronického srdečního selhání FAR NHL
- Kardiotoxicita – základní pojmy a mechanizmy
- Manuál ambulantního specialisty-kardiologa
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Rivaroxaban – farmakologický profil
- Pozdní následky kardiotoxicity
