Kardiotoxicita u hematoonkologických pacientov
Cardiotoxicity in haemato-oncological patients
Novel therapeutic approaches have led to an improvement in the survival of patients with haematologic malignancies, however, this success often leads to unexpected acute, chronic and late adverse cardiovascular events. In the last decade, anti-cancer therapy-induced cardiotoxicity is associated mainly with targeted therapy, immunomodulatory agents, proteasome inhibitors and more recently also with immunotherapy. These treatment methods may be associated with left ventricular dysfunction, heart failure, coronary artery disease, including acute coronary syndrome, arterial hypertension, thromboembolic complications, peripheral artery disease, pulmonary hypertension, valvular defects as well as arrhythmias, occurring simultaneously with the treatment and rarely also after its termination. This mini-review presents a brief overview of cardiovascular issues induced by haemato-oncological therapy and discusses the pathomechanisms of cardiotoxicity and new clinical data regarding novel therapeutics.
Keywords:
targeted therapy – immunomodulatory drugs – proteasome inhibitors – immunotherapy – radiotherapy – cardiovascular complications
Autoři:
B. Mladosievičová
Působiště autorů:
Oddelenie klinickej patofyziológie, LF UK v Bratislave
Vyšlo v časopise:
Kardiol Rev Int Med 2017, 19(1): 34-38
Souhrn
Nové terapeutické postupy zlepšili kurabilitu hematologických malignít, avšak často za cenu neočakávaných nepriaznivých akútnych, chronických aj neskorých kardiovaskulárnych účinkov. V ostatnej dekáde súvisia najmä s cielenou liečbou, imunomodulačnými látkami, proteazómovými inhibítormi a celkom nedávno aj s imunoterapiou. Moderná liečba môže počas jej podávania a ojedinele aj po jej ukončení u hematoonkologických pacientov vyvolávať komorovú dysfunkciu, zlyhávanie srdca, ischémiu srdca vrátane akútneho koronárneho syndrómu, tromboembolické komplikácie, periférne artériové ochorenie, pľúcnu hypertenziu, poškodenie chlopní a arytmie. Predkladaný článok je koncipovaný ako stručný prehľad nepriaznivých kardiovaskulárnych účinkov indukovaných liečbou hematologických malignít – zaoberá sa predovšetkým mechanizmami účinku na kardiovaskulárny systém, novými klinickými dátami so zameraním na najmodernejšiu liečbu.
Kľúčové slová:
cielená liečba – imunomodulačné látky – proteazómové inhibítory – imunoterapia – rádioterapia – kardiovaskulárne komplikácie
Úvod
Kardiotoxicita liečby hematologických malignít je nesmierne dynamický problém. V hematoonkológii je v súčasnosti používaných viacero liekov, ktoré znamenali prelom v prognóze – ako napr. monoklonová protilátka rituximab v liečbe lymfómov, tyrozínkinázový inhibítor imatinib v liečbe chronickej myeloidnej leukémie. V ostatnej dekáde prispelo k predĺženiu odpovede na liečbu u mnohých pacientov aj zavedenie nových farmák a ich kombinácií. K pokrokom v liečbe hematoonkologických ochorení prispievajú okrem klasických cytostatík (napr. doxorubicínu, daunorubicínu, cyklofosfamidu) aj moderné monoklonové protilátky a kinázové inhibítory, imunomodulačné látky, proteazómové inhibítory a celkom nedávno aj imunoterapia.
Za ostatné roky sa v hematoonkológii počet onkologických pacientov po úspešnej protinádorovej liečbe zvýšil. Týka sa to najmä akútnych leukémií (najmä u detí a mladých dospelých) a niektorých typov lymfómov. Osobitne priaznivá je prognóza pacientov vo včasných štádiách Hodgkinovho lymfómu (HL). U významného počtu pacientov s niektorými hematologickými malignitami však nastáva relaps a toxické komplikácie, a preto existuje stála potreba ďalších, účinnejších a bezpečnejších liečebných postupov. V prípade relapsu alebo rezistencie sa používajú ďalšie chemoterapeutické režimy s následnou transplantáciou krvotvorných kmeňových buniek.
Terapia u hematoonkologických pacientov sa neustále modifikuje aj s cieľom redukcie kardiotoxicity (znížila sa dávka antracyklínov, menia sa liečebné kombinácie a asi od r. 2000 sa redukovala aj rádioterapia (RT) na oblasť srdca – zavedením involved-field RT. Kvalitu RT zvýšilo aj zavedenie tzv. konformnej RT (CRT), ktorá pri trojrozmernom plánovaní (3D-CRT) umožní cielenejšie ožiarenie a redukciu objemu zdravých tkanív. Najnovšia možnosť aplikácie CRT je tzv. rádioterapia s modulovanou intenzitou (intensity modulated radiation therapy – IMRT). Koncepcia frakcionácie tiež viedla k redukcii kardiovaskulárnych (KV) komplikácií.
Pochopenie KV profilu terapie hematologických malignít v súčasnosti je zložité. Mnohé z klasických aj moderných protinádorových farmák môžu poškodzovať srdce, ale aj periférne cievy. U týchto pacientov sa môže objavovať akútna (počas liečby), chronická (v prvom roku po liečbe), neskorá kardiotoxicita (objavujúca sa s odstupom viac ako 1 rok po liečbe). Protinádorová liečba môže exacerbovať aj kardiologické komorbidity. Niektoré z KV komplikácií liečby hematologických malignít sú neočakávané s nejasnou patogenézou (napr. v prípade imunoterapie, tyrozínkinázových a proteazómových inhibítorov).
V nedávno uverejnenom dokumente Európskej kardiologickej spoločnosti s názvom “Position paper on cancer treatments and cardiovascular toxicity” bolo definovaných devät kategórií KV komplikácií navodených protinádorovou liečbou [1]. Patrí k nim ľavokomorová dysfunkcia a zlyhávanie srdca, ischemická choroba srdca (ICHS) vrátane akútneho koronárneho syndrómu, arytmie, artériová hypertenzia, periférne artériové ochorenie a cievna mozgová príhoda, chlopňové chyby, pľúcna hypertenzia, poškodenie perikardu a tromboembolické príhody.
KV komplikácie liečby mnohopočetného myelómu
Mnohopočetný myelóm (MM) je druhá najčastejšia hematologická malignita. Napriek skutočnosti, že proteazómové inhibítory (bortezomib a carfilzomib) a imunomodulačné látky (talidomid, lenalidomid, pomalidomid) nesporne prispeli k pokrokom v jeho liečbe a k zlepšeniu celkového prežívania, problémom sú aj ich kardiologické a vaskulárne komplikácie [2].
V roku 2016 boli uverejnené výsledky prvej porovnávacej štúdie autorov Kistlera et al, ktorí retrospektívne sledovali KV komplikácie (arytmie, zlyhávanie srdca, kardiomyopatiu) u 1 723 pacientov s MM. Medián sledovania bol 9 mesiacov (0–60 mesiacov). Riziko vzniku KV ochorení v tejto skupine bolo signifikantne vyššie ako v skupine 8 615 pacientov bez MM (porovnateľných podľa pohlavia a veku), ktorí boli sledovaní s mediánom 19 mesiacov (0–66 mesiacov.) Pacienti s MM boli liečení kortikosteroidmi a ≥3 farmakami (proteazómovým inhibítorom bortezomibom, imunomodulačnými látkami, alkylačnými látkami alebo antracyklínmi). Riziko arytmií v tejto štúdii bolo vyjadrené ako „hazard ratio“ – HR = 4,1 (95% CI 3,5–4,8), riziko kongestívneho zlyhávania srdca (HR = 2,9; 95% CI 2,2–3,7) a kardiomyopatie (HR = 2,6; 95% CI 1,8–3,8). Incidencia hypertenzie, arteriálnych udalostí a ICHS bola podobná medzi oboma porovnávanými súbormi s MM aj bez neho [3].
Metaanalýza viac ako 3 000 pacientov s MM preukázala, že pacienti liečení samotným talidomidom mali 2,6-násobne vyššie riziko venózneho tromboembolizmu (VTE), kým pri kombinácii talidomidu s dexametazonom bolo toto riziko 8-násobné [4]. Nižší výskyt VTE bol preukázaný v súvislosti s liečbou lenalidomidom a pomalidomidom v klinických trialoch s tromboprofylaxiou [5]. V súvislosti s liečbou bortezomibom sa udáva nižší výskyt VT, a to u 0–5 % pacientov [5]. Niektoré štúdie s bortezomibom preukázali dokonca jeho tromboprotektívny efekt v prevencii VT prostredníctvom zvýšenej endotelovej expresie trombomodulínu cez špecifické transkripčné faktory [6,7].
Pacienti s MM majú aj vyššie arteriálne tromboembolické riziko. Donedávna sa udávalo, že toto riziko môže súvisieť s vyšším vekom pacientov s týmto ochorením. Avšak aj v súbore pacientov vo veku 18–65 rokov s MM bolo toto riziko vyššie (5,6 % s mediánom veku 59 rokov). Relatívne riziko bolo u hypertonikov 11,7 a u pacientov fajčiarov 15,2 [3].
Bortezomib a carfilzomib môžu viesť aj k autonómnej dysfunkcii, kardiomyopatii a riziku hypertenzie, hypotenzie a arytmiám [8]. Nepriaznivé následky liečby MM na KV systém sú uvedené v tab. 1. KV stav okrem liečby u pacientov s MM komplikuje aj AL amyloidóza (z ľahkých reťazcov imunoglobulínov), ktorá môže viesť k rýchloprogredujúcemu zlyhávaniu srdca, komorovým tachyarytmiám, poškodeniu ciev, chlopní a ďalším komplikáciám [9]. (Táto problematika presahuje ciele predkladanej publikácie).
![Potenciálne kardiotoxické látky v liečbe myelómu [3,8–10].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/e11841df9dfff98db1f92d28b799f176.png)
KV komplikácie liečby leukémií s pozitívnym Philadelphia (Ph+) chromozómom
Napriek vynikajúcim výsledkom dosiahnutým s imatinibom v liečbe mnohých pacientov s chronickou myeloidnou leukémiou a akútnou lymfoblastovou leukémiou majú v súčasnosti dôležité miesto aj tyrozínkinázové inhibítory 2. generácie:
- dasatinib (inhibítor molekulových cieľov ABL, mutovaná ABL, KIT, SRC, EGFR, BRAF, PDGFR, DDR1, DDR2),
- nilotinib (inhibítor ABL, ABL mutovaná, ABL2, KIT, DDR1, NQO2)
- ponatinib (inhibítor ABL, ABL mutovaná, VEGFR, FGFR, PDGFR, SRC, KIT, RET, TIE2, FLT3a ďalších receptorov) [8].
Z KV komplikácií u pacientov sú známe najmä pľúcna hypertenzia asociovaná s dasatinibom a poškodenie koronárnych, cerebrálnych a periférnych artérií v súvislosti s nilotinibom a ponatinibom.
Pľúcna artériová hypertenzia (PAH) sa pozoruje približne u 1/10 pacientov liečených dasatinibom [10]. Po liečbe sa klinicky stav upravuje, avšak normalizácia zvýšeného tlaku v a. pulmonalis sa nedosiahne takmer u polovice pacientov. K rizikovým faktorom dasatinibom indukovanej PAH patrí napr. trvanie chronickej myeloidnej leukémie (CML), preexistujúce KV aj autoimunitné ochorenia. Po dasatinibe sa vyskytujú aj vaskulárne komplikácie a predĺžený QTc interval.
Ponatinib a nilotinib niekedy vyvolávajú progresívne artériové okluzívne ochorenie, ktoré sa môže týkať viacerých ciev, predilekčne na dolných končatinách [10,11]. Tieto nepriaznivé účinky môžu pokračovať aj po ukončení podávania týchto inhibítorov (podobne ako pri antracyklínovej kardiotoxicite). Vaskulárna toxicita sa delí na typ I (s ireverzibilným dávkovo závislým štrukturálnym poškodením endotelu) a typ II (s prechodnou endotelovou dysfunkciou). Nilotinib a dasatinib patria k I. typu. Incidencia poškodenia ciev sa v prípade dasatinibu udáva u 1–5 % pacientov, u imatinibu menej ako 1 % [10,11]. U pacientov liečených dasatinibom je problém aj retencia tekutín. O progresii poškodenia ciev nie sú zatiaľ dostupné informácie z klinických sledovaní. Patogenéza je objasnená čiastočne. Známa je skutočnosť, že ABL proteín je potrebný pre viabilitu endotelových buniek. Strata funkcie ABL vedie nielen k nedostatočnej tvorbe nových ciev, ale aj k poškodeniu už existujúcich ciev. ABL je aktivovaný prostredníctvom Tie2 receptora, na ktorý sa viaže angiopoietín 1 (obr. 1). Blokáda tejto signalizácie inhibítorom Tie 2 zhoršuje nedostatok ABL navodený ABL inhibítormi. ABL inhibitory vedú k vazospazmu alebo progresii aterosklerotického procesu bez trombózy (ponatinib a nilotinib inhibujú funkciu trombocytov a ich agregáciu) [11,12]. U imatinibu bola preukázaná iba minimálna kardiotoxicita.
![Ilustrácia dôležitých molekúl vo fungovaní endotelových buniek a v ich komunikácii s pericytmi a hladkou svalovinou. Upravené podľa [10].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/b5c5dc500003a460855712863681e20f.jpg)
Kardiovaskulárne komplikácie liečby chronickej lymfocytovej leukémie
Účinnosť liečby tohto ochorenia zlepšili nové inhibítory ovplyvňujúce dráhu B-bunkového receptora, tzv. BCR inhibítory – ibrutinib (inhibítor Brutonovej tyrozínkinázy) a idelalisib (inhibítor fosfatidylinozitol kinázy delta – PI3Kdelta). Z KV komplikácií je potrebné pri ibrutinibe venovať pozornosť atriálnej fibrilácii [13].
Výsledky randomizovanej multicentrickej štúdie fázy III RESONATE u pacientov s relabovanou/ refraktérnou lymfocytárnou leukémiou (CLL) preukázali u 3 % pacientov liečených ibrutinibom atriálnu fibriláciu 3. a vyššieho stupňa, ktorá si vyžiadala hospitalizáciu alebo intervenciu, prípadne ukončenie liečby. V ramene liečenej ofatumumabom sa táto arytmia neobjavila. Jednalo sa o štúdiu s malým počtom pacientov, ibrutinib bol podávaný dlhšie ako protilátka antiCD20 – ofatumumab (8,6 vs. 4,3 mesiacov) a atriálna fibrilácia sa vyskytla u starších pacientov s rizikovými faktormi. Vzhľadom na to, že monitorovanie KV toxicity nebolo cieľom tejto štúdie, je možné, že výskyt atriálnej fibrilácie (najmä asymptomatickej) môže byť vyšší [8,14,15].
Nepriaznivé KV následky liečby leukémie na KV systém sú uvedené v tab. 2.
![Potenciálne kardiotoxické lieky v liečbe leukémií [1,9,10].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/c88111e75860ade9e59409db5ff8fceb.png)
KV komplikácie liečby lymfómov
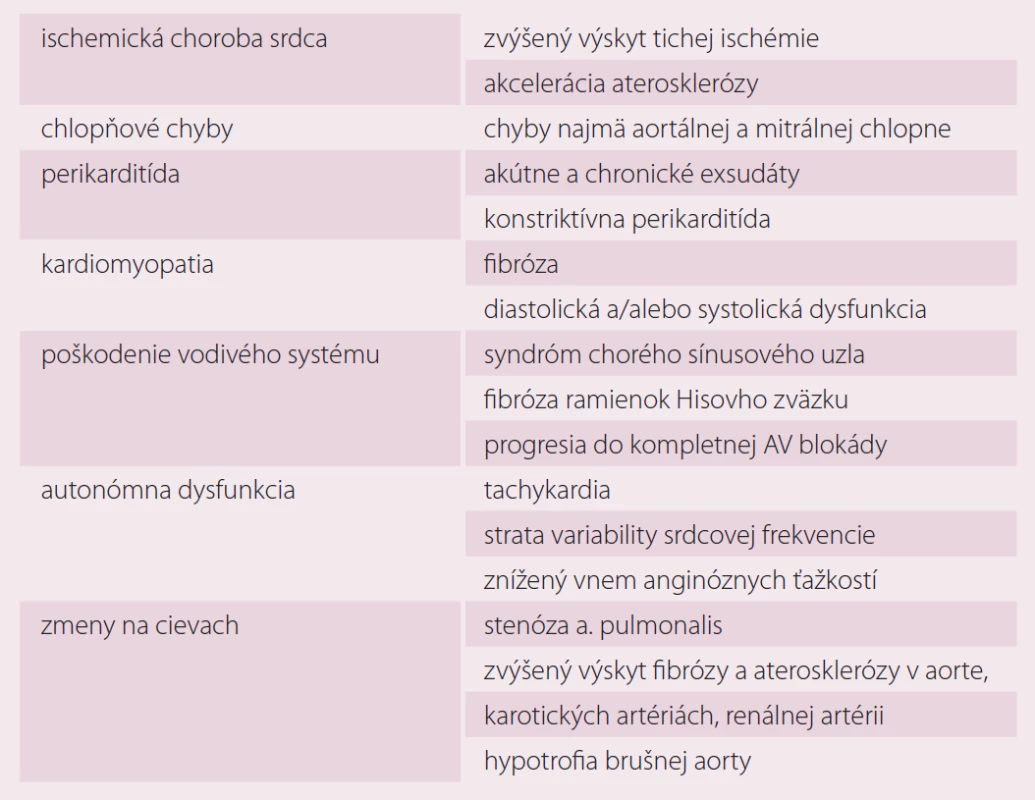
KV komplikácie u pacientov s lymfómami súvisia najmä s liečbou antracyklínmi a rádioterapiou (hlavne po dávkach > 30 Gy, avšak bezpečná celková dávka nie je známa). Patria k nim najmä ICHS, chlopňové chyby a kardiálna dysfunkcia so zlyhávanim srdca alebo bez neho [9,16,17].
Okolo roku 2000 nastal v liečbe pacientov s HL odklon od veľkoobjemového ožiarenia (tzv. extended field) a preferovanie rádioterapie tzv. involved field. Moderné špeciálne ožarovacie techniky umožňujú minimalizáciu poškodenia normálnych tkanív. Rádioterapiou navodené KV poškodenie je hlavne problém u pacientov liečených staršími ožarovacími technikami, keďže môže mať s narastajúcim časom po ukončení liečby progresívny charakter.
Histologicky býva niekedy problematické odlíšiť radiáciou indukované a aterosklerotické poškodenie ciev. Pri postradiačnom poškodení býva výrazne poškodená média, prítomná je strata hladkosvalových buniek a fibróza adventície. RT môže viesť k endotelovej dysfunkcii a predčasnej ateroskleróze, k trombóze aj ruptúre ATS plaku [1]. Pacienti s ICHS po RT nemusia mať žiadnu symptomatológiu (býva u nich tzv. tichá ischémia vzhľadom na autonómnu dysfunkciu navodenú RT). Kumulatívne riziko infarktu myokardu do 30 rokov po liečbe sa udáva 10 % [1]. ICHS sa klinicky prejavuje s odstupom 10–15 rokov po RT.
K najčastejšie poškodeným chlopniam patria aortálna a mitrálna. Približne 70 % pacientov s radiáciou indukovaným poškodením chlopní býva asymptomatických [17]. RT na hrudník poškodzuje najmä pravé Tawarove ramienko. SA a AV uzol býva poškodený v dôsledku arteriolosklerózy. K najzávažnejším poškodeniam patrí kompletná AV blokáda, ktorej výskyt bol opísaný s odstupom niekoľkých mesiacov až 23 rokov po ukončení RT [17]. Zlyhanie srdca po RT nebýva časté. Poškodenie perikardu vyvolané rádioterapiou sa najčastejšie prejavuje ako perikardiálny výpotok s konstriktívnou perikarditídou alebo bez nej. Perikarditída vyvolaná ožiarením môže vzniknúť už počas liečby alebo po mesiacoch až rokoch od liečby.
Antracyklínovej kardiotoxicite sme sa detailne venovali v inej publikácii [9].
Kardiotoxicita rituximabu je nižšia ako u ostatných monoklonových protilátok. Avšak je potrebné jej riziku venovať pozornosť najmä u pacientov s KV komorbiditami, u ktorých môže exacerbovať angina pectoris aj arytmie. Nedávno bol popísaný aj prípad pacienta s Tako-tsubo kardiomyopatiou s prechodnou systolickou dysfunkciou a balónovým tvarom ľavej komory [18]. Pri rituximabe boli preukázané aj tranzitórna endotelová dysfunkcia (typu II) a vznik hypertenzie [10]. Potenciálne KV komplikácie súvisiace s liečbou lymfómov sú uvedené v tab. 3 a 4.
![Potenciálne kardiotoxické látky v liečbe lymfómov [1,9,10, 19–21].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/bae8bb3972bba7452fc88c5b71b2d0a3.png)
Záver
V klinickej praxi je dôležité mať na zreteli potenciálne riziká poškodenia srdca a ciev pred liečbou hematologických malignít, počas nej aj po jej ukončení. Poznanie patogenézy a dynamiky vývoja kardiotoxicity patria k nevyhnutným predpokladom na to, aby bola kardiálna aj vaskulárna toxicita včas rozpoznaná, racionálne monitorovaná a liečená a hlavne, aby bola úspešná jej prevencia. Pozornosť odborníkov v kardiologickej praxi by sa mala zameriavať na modifikovateľné KV rizikové faktory a najmä na tie kardiotoxické komplikácie, ktoré vyžadujú intervenciu alebo majú progresívny charakter. Súhrnne možno uviesť, že aj keď sú nepriaznivé následky hematoonkologickej liečby na srdce a cievy nepopierateľným faktom, stále neexistuje dostatok údajov o ich incidencii a prevalencii v reálnej klinickej praxi. Je pravdepodobné, že ich výskyt bude vyšší ako v klinických štúdiách, v ktorých sú pacienti prísnejšie selektovaní (napr. bez komorbidít, bez rizikových faktorov). Pohľad na KV následky liečby komplikuje aj samotné onkologické ochorenie, ktoré tiež môže prispievať ku poškodeniu KV systému, a kombinácia viacerých potenciálne kardiotoxických liekov a modalít. Zaujímavé je, že vďaka klinickej kardiotoxicite navodenej cielenou liečbou (napr. inhibíciou tyrozínových kináz) lepšie rozumieme fyziológii KV systému a úlohe doteraz málo známych molekúl v srdci a cievach.
Doručeno do redakce: 3. 2. 2017
Přijato po recenzi: 17. 2. 2017
prof. MU Dr. Beata Mladosievičová, CSc.
www. fmed.uniba.sk
beata.mladosievicova@fmed.uniba.sk
Zdroje
1. Zamorano JL, Lancellotti P, Rodriguez Muñoz D et al. ESC Committee for Practice Guidelines (CPG). 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J 2016; 37(36): 2768–2801.
2. Li W, Garcia D, Cornell RF et al. Cardiovascular and thrombotic complications of novel multiple myeloma therapies: a review. JAMA Oncol 2016. doi: 10.1001/ jamaoncol.2016.3350.
3. Kistler KD, Kalman J, Sahni G et al. Incidence and risk of cardiac events in patients with previously treated multiple myeloma versus matched patients without multiple myeloma: an observational, retrospective, cohort study. Clin Lymphoma Myeloma Leuk 2016. pii: S2152-2650(16)30872-2. doi: 10.1016/ j.clml.2016.11.009.
4. El Accaoui RN, Shamseddeen WA, Taher AT. Thalidomide and thrombosis: meta-analysis. Thromb Haemost 2007; 97(6): 1031–1036.
5. Li W, Cornell RF, Lenihan D et al. Cardiovascular complications of novel multiple myeloma treatment. Circulation 2016; 133(9): 908–912. doi: 10.1161/ CIRCULATIONAHA.115.018351.
6. Hiroi T, Deming CB, Zhao H et al. Proteasome inhibitors enhance endothelial thrombomodulin expression via induction of Krüppel-like transcription factors. Arterioscler Thromb Vasc Biol 2009; 29(10): 1587–1593. doi: 10.1161/ ATVBAHA.109.191957.
7. Nayak L, Shi H, Atkins GB et al. The thromboprotective effect of bortezomib is dependent on the transcription factor Kruppel-like factor 2 (KLF2). Blood 2014; 123(24): 3828–3831. doi: 10.1182/ blood-2014-01-547448.
8. Moslehi JJ. Cardiovascular toxic effects of targeted cancer therapies. N Engl J Med 2016; 375(15): 1457–1467.
9. Mladosievičová B a kol. Kardioonkologie. Praha: Grada Publishing 2014.
10. Herrmann J, Yang EH, Iliescu CA et al. Vascular toxicities of cancer therapies: the old and the new-an evolving avenue. Circulation 2016; 133(13): 1272–1289. doi: 10.1161/ CIRCULATIONAHA.115.018347.
11. Herrmann J. Tyrosine kinase inhibitors and vascular toxicity: impetus for a classification system? Curr Oncol Rep 2016; 18(6): 33. doi: 10.1007/ s11912-016-0514-0.
12. Iliescu CA, Grines CL, Herrmann J et al. SCAI Expert consensus statement: Evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory. Catheter Cardiovasc Interv 2016; 87(5): E202–E223. doi: 10.1002/ ccd.26379.
13. Deeks ED. Ibrutinib: A review in chronic lymphocytic leukemia. Drugs 2017; 77(2): 225–236. doi: 10.1007/ s40265-017-0695-3.
14. Byrd JC, Brown JR, O'Brien S et al. RESONATE Investigators. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371(3): 213–223. doi: 10.1056/ NEJMoa1400376.
15. Byrd JC, Hillmen P, James DF. Additional data needed for a better understanding of the potential relationship between atrial fibrillation and ibrutinib. Blood 2015; 125(10): 1673. doi: 10.1182/ blood-2015-01-621466.
16. Cutter DJ, Schaapveld M, Darby SC et al. Risk for valvular heart disease after treatment for hodgkin lymphoma. J Natl Cancer Inst 2015; 107(4): djv008. doi: 10.1093/ jnci/ djv008.
17. Mladosievičová B, Hricák V. Kardiovaskulárne následky rádioterapie onkologického ochorenia – vieme si pomôcť. Kardiol Prax 2015; 13(2): 65–69.
18. Ng KH, Dearden C, Gruber P. Rituximab-induced Takotsubo syndrome: more cardiotoxic than it appears? BMJ Case Rep 2015; 2015. pii: bcr2014208203. doi: 10.1136/ bcr-2014-208203.
19. Heinzerling L, Ott PA, Hodi FS et al. Cardiotoxicity associated with CTLA4 and PD1 blocking immunotherapy. J Immunother Cancer 2016; 4 : 50. doi: 10.1186/ s40425-016-0152-y.
20. Johnson DB, Balko JM, Compton ML et al. Fulminant myocarditis with combination immune checkpoint blockade. N Engl J Med 2016; 375(18): 1749–1755. doi: 10.1056/ NEJMoa1609214.
21. Moslehi JJ, Johnson DB, Sosman JA et al. Myocarditis with immune checkpoint blockade. N Engl J Med 2017; 376(3): 292. doi: 10.1056/ NEJMc1615251.
22. National Comprehensive Cancer Network Guidelines 2015, version 2.2015 Survivorship. Available from: http:/ / www.nccn.org/ professionals/ default.aspx.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2017 Číslo 1
-
Všechny články tohoto čísla
- Kardiotoxicita protinádorových léčiv v experimentu
- Problematika kardiotoxicity primární léčby pacientek s karcinomem ovaria
- Pozdní následky kardiotoxicity
- Kardiotoxicita – současná doporučení
- Kardiotoxicita u hematoonkologických pacientov
- Rivaroxaban – farmakologický profil
- Edoxaban – farmakologický profil
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Moderní antitrombotická léčba po AKS – využíváme ji dostatečně?
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Betablokátory v registru chronického srdečního selhání FAR NHL
- Kardiotoxicita – základní pojmy a mechanizmy
- Manuál ambulantního specialisty-kardiologa
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Rivaroxaban – farmakologický profil
- Pozdní následky kardiotoxicity
