Edoxaban – farmakologický profil
Edoxaban – pharmacological profile
Edoxaban is a direct inhibitor of factor Xa in the coagulation cascade. It reduces the formation of thrombin, prolongs clotting time and reduces the risk of development of blood clots. Its main therapeutic indication is the prevention of stroke and systemic embolism in adult patients with nonvalvular atrial fibrillation and the presence of one or more risk factors such as congestive heart failure, hypertension, age ≥ 75 years, diabetes mellitus, prior stroke or transient ischaemic attack. The efficacy and safety of edoxaban compared to warfarin was presented in the large clinical trial ENGAGE AF-TIMI 48, and in the ENSURE-AF study involving patients with atrial fibrillation undergoing synchronised electrical cardioversion. Another indication for edoxaban is the treatment of deep vein thrombosis, pulmonary embolism and prevention of recurrent vein thrombosis and pulmonary embolism. The study Hokusai-VTE showed that edoxaban is non-inferior to warfarin in the primary efficacy parameter. Regarding safety, there was a significant reduction of clinically relevant bleeding with edoxaban as compared to warfarin.
Keywords:
edoxaban – direct inhibitor of factor Xa – atrial fibrillation – thromboembolic disease – deep vein thrombosis – pulmonary embolism
Autoři:
R. Lábrová 1; K. Lábr 2
Působiště autorů:
Interní kardiologická klinika LF MU a FN Brno
1; I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
2
Vyšlo v časopise:
Kardiol Rev Int Med 2017, 19(1): 45-50
Souhrn
Edoxaban je přímý inhibitor faktoru Xa v koagulační kaskádě. Snižuje tvorbu trombinu, prodlužuje koagulační čas a snižuje riziko vzniku trombu. Jeho hlavní terapeutickou indikací jsou prevence cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní a přítomností jednoho nebo více rizikových faktorů, jako je kongestivní srdeční selhání, hypertenze, věk ≥ 75 let, diabetes mellitus, předchozí cévní mozková příhoda nebo tranzitorní ischemická ataka. Účinnost a bezpečnost edoxabanu ve srovnání s warfarinem byla prezentována ve velké klinické studii ENGAGE AF-TIMI 48, u pacientů s fibrilací síní podstupujících elektrickou kardioverzi ve studii ENSURE-AF. Další indikací podání edoxabanu je léčba hluboké žilní trombózy, plicní embolie a prevence rekurentních žilních trombóz a plicních embolií. Ve studii Hokusai-VTE bylo prokázáno, že edoxaban je non-inferiorní vzhledem k warfarinu v primárním parametru účinnosti. Co se týká bezpečnosti, došlo k významnému snížení klinicky relevantního krvácení u edoxabanu ve srovnání s warfarinem.
Klíčová slova:
edoxaban – inhibitor faktoru Xa – fibrilace síní – tromboembolická nemoc – hluboká žilní trombóza – plicní embolie
Úvod
Žilní tromboembolizmus je třetím nejčastějším kardiovaskulárním (KV) onemocněním po infarktu myokardu (IM) a cévní mozkové příhodě (CMP) [1]. V prevenci tromboembolických příhod se stále častěji místo antagonistů vitaminu K (vitamin K antagonist – VKA) warfarinu používají nová perorální antikoagulancia (NOAC). Podává se přímý inhibitor trombinu dabigatran nebo přímý inhibitor faktoru Xa, což je apixaban nebo rivaroxaban a nyní nově edoxaban. NOAC, pokud se správně užívají, jsou ve srovnání s warfarinem účinnější a bezpečnější, nemají dietní omezení, protože mají méně interakcí nejen s jídlem, ale i s léky, mají předvídatelný účinek, takže se nemusí pravidelně kontrolovat koagulační parametry [2 – 4]. V Evropě je edoxaban pod názvem Lixiana. Jedna potahovaná tableta obsahuje 60 mg edoxabanu jako edoxabanum tosilatum.
Edoxaban – terapeutické indikace
Edoxaban se podává v prevenci CMP a systémové embolie u pacientů s nevalvulární fibrilací síní (NVFS) s jedním nebo více rizikovými faktory, jako je kongestivní srdeční selhání (SS), hypertenze, věk ≥ 75 let, diabetes mellitus, předchozí CMP nebo tranzitorní ischemická ataka (TIA).
Druhou indikací je léčba hluboké žilní trombózy (deep vein thrombosis – DVT), plicní embolie (PE) a prevence rekurentní DVT a PE.
Dávkování
Před zahájením podání přípravku Lixiana je nutné stanovení renálních a jaterních funkcí, a tak vyloučit pacienty v konečném stadiu renálního onemocnění a pacienty s těžkým jaterním postižením, kde je přítomna koagulopatie, a tím se ještě zvyšuje riziko krvácení. Podle postižení renálních nebo jaterních funkcí je potom nutné redukovat dávku edoxabanu.
Prevence CMP a systémové embolie
Doporučená dávka edoxabanu je 60 mg 1× denně. Léčba edoxabanem u pacientů s NVFS má být dlouhodobá.
Léčba DVT, léčba PE a prevence rekurentních DVT a PE
Doporučená dávka edoxabanu je 60 mg 1× denně následující po zahájení léčby parenterálním antikoagulanciem – nejčastěji nízkomolekulárním heparinem (LMWH) podávaným nejméně po dobu 5 dnů. Edoxaban a iniciální parenterální antikoagulancium nemají být podávány současně. Trvání terapie při léčbě DVT a PE (žilní tromboembolické příhody – VTE) a při prevenci rekurentní VTE má být upraveno individuálně po pečlivém vyhodnocení přínosu léčby oproti riziku krvácení. Terapie nejméně 3 měsíce má vycházet ze známých přechodných rizikových faktorů (např. nedávného chirurgického zákroku, traumatu, imobilizace) a terapie trvající delší dobu mají vycházet z trvalých rizikových faktorů nebo idiopatické DVT nebo PE.
Posouzení renální funkce
Stanovuje se výpočtem clearence kreatininu (CrCl v ml/ min), nejlépe měřená podle Cockcrofta-Gaulta.
U pacientů v konečném stadiu renálního onemocnění, kdy je CrCL < 15 ml/ min, nebo u pacientů v dialyzačním programu se použití přípravku Lixiana nedoporučuje.
Při NVFS a VTE se redukuje dávka edoxabanu na 30 mg jednou denně u pacientů s jedním nebo více následujícími klinickými faktory:
- středně závažná nebo závažná porucha funkce ledvin (CrCl 15 – 50 ml/ min),
- nízká tělesná hmotnost ≤ 60 kg,
- souběžné užívání následujících inhibitorů P-glykoproteinu: cyklosporin, dronedaron, erythromycin nebo ketokonazol.
U pacientů s mírnou poruchou funkce ledvin CrCl > 50 – 80 ml/ min se podává Lixiana 60 mg 1× denně.
S větší opatrností se podává Lixiana v dávce 60 mg u pacientů s NVFS a zvýšenou clearence kreatininu. Ve studiích byla tendence u zvyšující se clearence kreatininu ke snižování účinnosti Lixiany.
Porucha funkce jater
Přípravek Lixiana je kontraindikován u pacientů s jaterním onemocněním, které je spojeno s koagulopatií a klinicky relevantním rizikem krvácení. Pokud je těžká porucha funkce jater, tak se použití přípravku Lixiana nedoporučuje.
U pacientů s mírnou až středně těžkou poruchou funkce jater se podává Lixiana v dávce 60 mg s vyšší opatrností. Také u pacientů se zvýšenými hodnotami jaterních enzymů (ALT/ AST > 2× horní limit normálu) nebo celkovým bilirubinem ≥ 1,5× horní limit normálu je nutná opatrnost, protože tito pacienti byli ze studií vyloučeni.
NOAC a laboratorní testy
U pacientů, kteří užívají NOAC, by se měly 1× ročně provádět krevní odběry na stanovení funkce ledvin, jater a hodnot hemoglobinu. Častěji, asi jednou za půl roku, je nutné kontrolovat renální funkce u pacientů ve věku 75 – 80 let nebo jde o křehkou osobu, která je definovaná třemi nebo více kritérii: nechtěný úbytek hmotnosti, vyčerpání udávané pacientem, slabost hodnocená testem stisku ruky, pomalá chůze nebo malá tělesná aktivita. Pokud došlo k poklesu CrCl ≤ 60 ml/min je vhodná kontrola za měsíc. U stavů, kde je podezření na změnu renální funkce v průběhu léčby – hypovolemie, dehydratace nebo dalších přidružených chorob – je nutné krevní odběry na stanovení renální funkce provést hned. Kontrola hemoglobinu či hematokritu se provádí pro detekci okultního krvácení. Při podání edoxabanu i ostatních NOAC ve srovnání s warfarinem bylo zjištěno častější slizniční krvácení (např. epistaxe, gingivální, gastrointestinální, genitourinální) a anémie. Pokud je nevysvětlitelný pokles hemoglobinu nebo krevního tlaku, je nutné pátrat po zdroji krvácení. Pokud se objeví závažné krvácení, podání Lixiany se zastavuje stejně jako u ostatních NOAC.
Každou návštěvu, stejně jako u ostatních NOAC, je nutné zdůrazňovat nutnost compliance pacienta, pátrat po tromboembolických či krvácivých komplikacích či jiných nežádoucích účincích a zkontrolovat současné užívání další medikace.
Ostatní doporučení
Co se týká starších pacientů, pohlaví, současného podávání amiodaronu, chinidinu či verapamilu není nutná redukce dávky Lixiany.
Při současném užívání inhibitorů P-glykoproteinu (P-gp): cyklosporinu, dronedaronu, erythromycinu nebo ketokonazolu se redukuje dávka Lixiany na 30 mg denně. Dávka se redukuje i při tělesné hmotnosti ≤ 60 kg.
Lixiana se podává 1× denně a lze ho podávat s jídlem i bez jídla.
Pokud dojde k vynechání dávky přípravku Lixiana, má se dávka užít okamžitě a pak se má pokračovat následující den užitím jedné dávky podle doporučení. Pacient nemá zdvojnásobovat předepsanou dávku ve stejný den.
Kontraindikace
Mezi kontraindikace patří hypersenzitivita na léčebnou látku, klinicky významné aktivní krvácení, jaterní onemocnění spojené s koagulopatií a klinicky relevantním rizikem krvácení, další léze nebo stavy, které jsou spojené s vysokým rizikem závažného krvácení (např. současné nebo nedávno prodělané ulcerace gastrointestinálního traktu, nedávno prodělané poranění nebo operace mozku, míchy, intrakraniální krvácení), nekontrolovaná těžká hypertenze, souběžná léčba s jinými antikoagulanciemi, s výjimkou převodu z perorální antikoagulační léčby, těhotenství a kojení. Kontraindikován je u mechanické chlopenní náhrady, středně těžké až těžké mitrální stenózy.
Další indikace
Vhodné je podání u mírného a středně těžkého jiného postižení nativní srdeční chlopně, také u těžké aortální stenózy, kdy se většinou provede intervence. Také u pacientů s biologickou chlopní, s výjimkou prvních 3 měsíců po výkonu, po plastice mitrální chlopně s výjimkou prvních 3 – 6 měsíců po výkonu. Jsou vhodné po perkutánní transluminální plastice aortální chlopně (PTAV) a katetrizační implantaci aortální chlopně (TAVI), ale u obou výkonů chybí prospektivní údaje. V některých případech je indikována kombinace s jedním nebo dvěma antiagregancii, ale je nutné zvážit riziko krvácení. Je vhodný u hypertrofické kardiomyopatie, ale také chybí prospektivní údaje, stejně jako u ostatních NOAC [5,6].
Nejsou žádné dostupné údaje o bezpečnosti a účinnosti u dětí a dospívajících do 18 let věku.
Přechod na přípravek Lixiana
U pacientů s NVFS a VTE je nutná nepřetržitá antikoagulační terapie, ale mohou nastat situace, které vyžadují změnu antikoagulační terapie.
Pokud se přechází z warfarinu na edoxaban a mezinárodně normalizovaný poměr (INR) je ≤ 2,5, ukončí se podávání antagonisty vitaminu K a může se začít s podáváním přípravku Lixiana.
V klinických farmakologických studiích užívaly zdravé osoby rivaroxaban v dávce 20 mg 1× denně, dabigatran 150 mg 2× denně nebo apixaban v dávce 5 mg 2× denně. Jestliže se přechází z užívání dabigatranu, rivaroxabanu nebo apixabanu, tak v době, kdy měla být podána další dávka zmíněného perorálního antikoagulancia, se začne podávat Lixiana, s výjimkou situací, kdy se očekávají vyšší než terapeutické koncentrace v plazmě, např. u poruchy renálních funkcí. U těchto případů je nutné interval prodloužit. Stejné doporučení platí i pro LMWH. V době, kdy měla být podána další dávka LMWH, se užije Lixiana. LMWH a Lixiana se nemají podávat současně. Infuze s nefrakcionovaným heparinem (UFM) se vysazuje 4 hod před podáním Lixiany.
Přechod z přípravku Lixiana
Pokud převádíme pacienta z Lixiany na warfarin, tak se podává chronická dávka warfarinu s redukovanou dávkou Lixiany. Pokud pacient užíval Lixianu 60 mg, tak snížíme na 30 mg, pokud užíval 30 mg snížíme na 15 mg 1× denně při současném podáním warfarinu. Při zahájení podávání warfarinu se neužívá vyšší dávka warfarinu k rychlému dosažení INR v terapeutickém rozmezí. Jakmile je dosaženo stabilní hodnoty INR ≥ 2,0, podávání přípravku Lixiana se ukončuje. Doporučuje se důsledně monitorovat INR v 1. měsíci do dosažení stabilních hodnot, tzn. 3 po sobě následující hodnoty INR by měly být mezi 2 – 3. Pokud se přechází z Lixiany na jiný NOAC nebo LMWH, tak se ukončuje podání Lixiany v době, kdy měla být podána další dávka, a zahájí se podání jiného NOAC nebo LMWH.
Farmakodynamické vlastnosti
Mechanizmus účinku
Edoxaban je vysoce selektivní, přímý a reverzibilní inhibitor faktoru Xa serinové proteázy nacházející se v závěrečné společné části koagulační kaskády [7]. Edoxaban inhibuje volný faktor Xa a aktivitu protrombinázy. Inhibice faktoru Xa snižuje tvorbu trombinu, prodlužuje koagulační čas a snižuje riziko vzniku trombu.
Farmakodynamické účinky
Edoxaban vykazuje rychlý nástup účinků do 1 – 2 hod, což odpovídá maximální expozici edoxabanu (Cmax). Farmakodynamické účinky stanovené analýzou anti-FXa aktivity jsou předvídatelné a korelují s dávkou a koncentrací edoxabanu. Edoxaban inhibicí faktoru Xa prodlužuje koagulační čas, např. protrombinový čas (PT), INR a aktivovaný parciální tromboplastinový čas (aPTT). Tyto změny v koagulačních testech jsou malé a podléhají vysokému stupni variability a nelze je použít ke sledování antikoagulačního účinku edoxabanu.
I když léčba edoxabanem nevyžaduje rutinní monitorování koagulačních testů, je možné v určitých rizikových situacích jeho účinek odhadnout pomocí kalibrované kvantitativní analýzy anti-FXa aktivity. Využívá se především u krvácivých komplikací, před urgentním chirurgickým zákrokem nebo při předávkování edoxabanem.
Farmakokinetické vlastnosti
Edoxaban se absorbuje převážně v horní části zažívacího traktu. Proto léčivé přípravky nebo chorobné stavy, které zrychlují vyprazdňování žaludku a motilitu střev, mohou snižovat jeho rozpouštění a absorpci.
Edoxaban se absorbuje s maximální plazmatickou koncentrací do 1 – 2 hod a ustálené koncentrace je dosaženo do 3 dnů. Biologická dostupnost je 62 %. Může se podávat s jídlem nebo bez jídla a jeho vstřebávání není ovlivněno podáním inhibitorů protonové pumpy. Má bezproblémovou snášenlivost v gastrointestinálním traktu. Vazba na plazmatické bílkoviny in vitro je asi 55 %. V plazmě je edoxaban převážně v nezměněné formě. Edoxaban má tři aktivní metabolity, metabolizuje hydrolýzou, konjugací nebo oxidací enzymem CYP3A4/ 5. Metabolizmus v játrech za účasti CYP3A4 je minimální, tvoří pod 4 % vylučování.
U zdravých jedinců se celková clearence odhaduje na 22 (±3) l/ h. Přibližně 50 % se vyloučí ledvinami, druhá polovina je metabolizována a vylučována biliární/ intestinální cestou. Poločas vylučování je 10 – 14 hod. Vždy je nutné sledovat možné lékové interakce a ovlivnění farmakokinetiky NOAC.
Klinická účinnost a bezpečnost
Studie ENGAGE AF-TIMI 48
Klinickou účinnost a bezpečnost edoxabanu ve srovnání s warfarinem u pacientů s NVFS sledovala velká studie ENGAGE AF-TIMI 48, u níž byl v ČR národním koordinátorem prof. MU Dr. Jindřich Špinar, CSc., FESC [4,8]. Studie byla multicentrická, randomizovaná, dvojitě zaslepená. Na celém světě bylo zařazeno 21 105 pacientů s průměrným CHADS2 skóre 2,8. Pacienti byli rozděleni do tří skupin: edoxaban 60 mg 1× denně, edoxaban 30 mg 1× denně, warfarin. Pokud byl přítomen jeden nebo více rizikových faktorů jako středně závažná porucha funkce ledvin (CrCl 30 – 50 ml/ min), tělesná hmotnost ≤ 60 kg nebo současná medikace specifických inhibitorů P-gp (verapamil, chinidin, dronedaron), byla dávka edoxabanu redukována na 30 mg 1× denně. Průměrná délka sledování byla 2,8 roku.
Obě dávky edoxabanu 30 mg a 60 mg podávané 1× denně byly ve srovnání s warfarinem non-inferiorní v primárním cíli – v prevenci CMP a systémové embolie.
Roční výskyt primárního cílového ukazatele byl 1,5 % při léčbě warfarinem, 1,18 % při podání 60 mg edoxabanu (p < 0,001 pro non-inferioritu) a 1,61 % při 30 mg edoxabanu (p = 0,005 pro non-inferioritu) (tab. 1). Podání edoxabanu bylo spojeno s výrazně nižší mírou krvácení. Roční výskyt krvácení byl u pacientů na warfarinu 3,43 %, při podání 60 mg edoxabanu 2,75 % (p < 0,001 pro non-inferioritu), 1,61 % (p < 0,001 pro non-inferioritu) při nižší dávce edoxabanu (tab. 2). Podání edoxabanu v obou dávkách snížilo úmrtí z jakýchkoli i KV příčin ve srovnání s warfarinem. Studie ENGAGE AF-TIMI 48 prokázala, že obě dávky edoxabanu jsou nejen účinnější, ale i bezpečnější než warfarin.
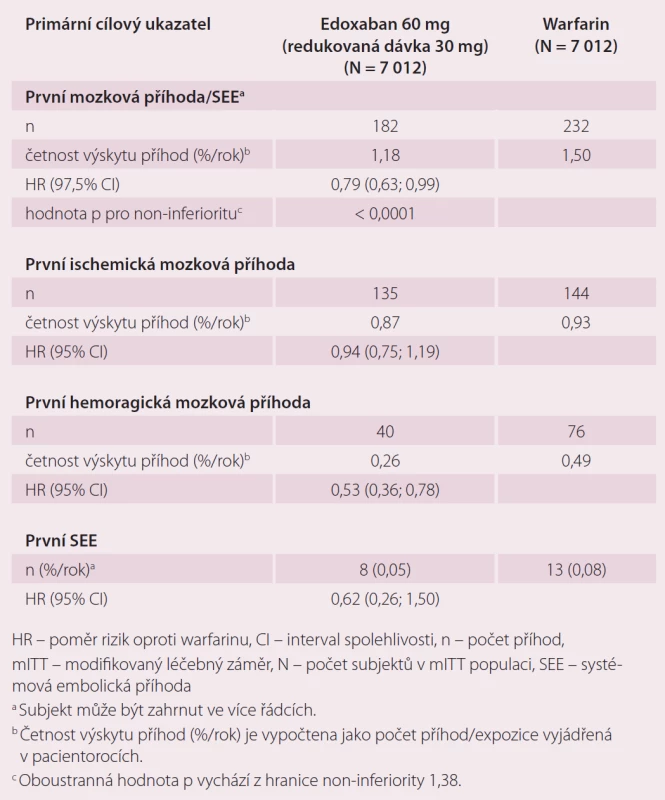
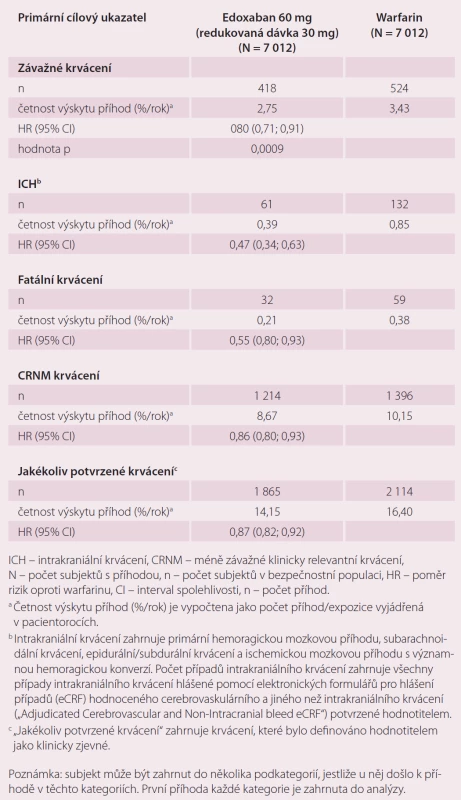
Studie ENSURE-AF
Studie ENSURE-AF je multicentrická, prospektivní, otevřená klinická studie, která srovnávala 60 mg edoxabanu se strategií enoxaparin-warfarin u nemocných s NVFS podstupujících elektrickou kardioverzi [9]. Dávka edoxabanu byla redukována na 30 mg denně, pokud byly přítomny rizikové faktory stejně jako ve studii ENGAGE AF-TIMI 48. Celkem bylo zařazeno 2 119 nemocných s průměrným CHA2DS2-VASc 2,6. Pacienti indikovaní k elektrické kardioverzi byli dle rozhodnutí zkoušejícího zařazeni k časné nebo odložené kardioverzi. Před časnou kardioverzí byla provedena transezofageální echokardiografie (TEE) a odložená kardioverze byla nejméně po třítýdenní antikoagulaci. Pacienti potom byli v obou skupinách randomizováni do terapie edoxabanem nebo enoxaparinem-warfarinem. Primární složený cílový ukazatel sestával z CMP, systémové embolizace, IM a mortality z KV příčin. Primární bezpečnostní cíl bylo velké krvácení nebo klinicky významné krvácení po alespoň jedné dávce léku. Sledování trvalo 28 dní při podávání medikace a dalších 30 dní jako bezpečnostní interval. Primární cílový ukazatel se vyskytl u 5 (< 1 %) nemocných léčených edoxabanem a u 11 (1 %) léčených enoxaparinem a warfarinem (NS). Primární bezpečnostní cílový ukazatel se vyskytl u 16 (1 %) pacientů léčených edoxabanem a u 11 (1 %) léčených enoxaparinem a warfarinem. Výsledky nebyly závislé na tom, zda se jednalo o časnou, kontrolovanou TEE nebo odloženou kardioverzi. Studie ENSURE-AF je největší prospektivní randomizovanou klinickou studií s antikoagulační léčbou u elektrické kardioverze pro NVFS. Prokazuje bezpečnost i účinnost edoxabanu ve srovnání s enoxaparinem a warfarinem při elektrické kardioverzi NVFS.
Studie Hokusai-VTE
Druhou velkou indikací edoxabanu je léčba a prevence rekurentní DVT a PE. Ve studii Hokusai-VTE byla srovnávána účinnost a bezpečnost edoxabanu v dávce 60 mg 1 × denně, které předcházelo podání enoxaparinu nebo UFM oproti warfarinu, který byl překryt podáním heparinu do dosažení účinného INR [10]. Celková doba léčby byla 3 – 12 měsíců, délka podání antikoagulace byla určena zkoušejícím podle klinických parametrů pacienta. Stejně jako u studie ENGAGE AF-TIMI 48, pokud byl přítomen jeden nebo více rizikových faktorů jako středně závažná porucha funkce ledvin (CrCl 30 – 50 ml/ min), tělesná hmotnost ≤ 60 kg nebo současná medikace specifických inhibitorů P-gp, byla dávka edoxabanu redukována na 30 mg jednou denně. Celkem bylo do studie zařazeno 8 292 pacientů. Primárním cílem účinnosti byla rekurence symptomatické VTE definovaná jako soubor rekurentní symptomatické DVT, symptomatické PE bez fatálních následků a PE s fatálními následky v průběhu ročního sledování ve studii. Roční výskyt primárního cíle byl 3,2 % u pacientů s edoxabanem a 3,5 % pacientů léčených warfarinem (p < 0,001 pro non-inferioritu). V účinnosti rekurence DVT a PE byla prokázána non-inferiorita edoxabanu vůči warfarinu (tab. 3). Primárním bezpečnostním cílem bylo klinicky relevantní krvácení, které bylo definované jako závažné krvácení nebo méně závažné klinicky relevantní krvácení (CRNM). Došlo k významnému snížení rizika krvácení v průběhu ročního sledování ve prospěch edoxabanu při srovnání s warfarinem, a to 8,5 vs. 10,3 % (p = 0,004 pro superioritu) (tab. 4). Edoxaban je účinnější a bezpečnější ve srovnání s warfarinem i v indikaci DVT a PE.
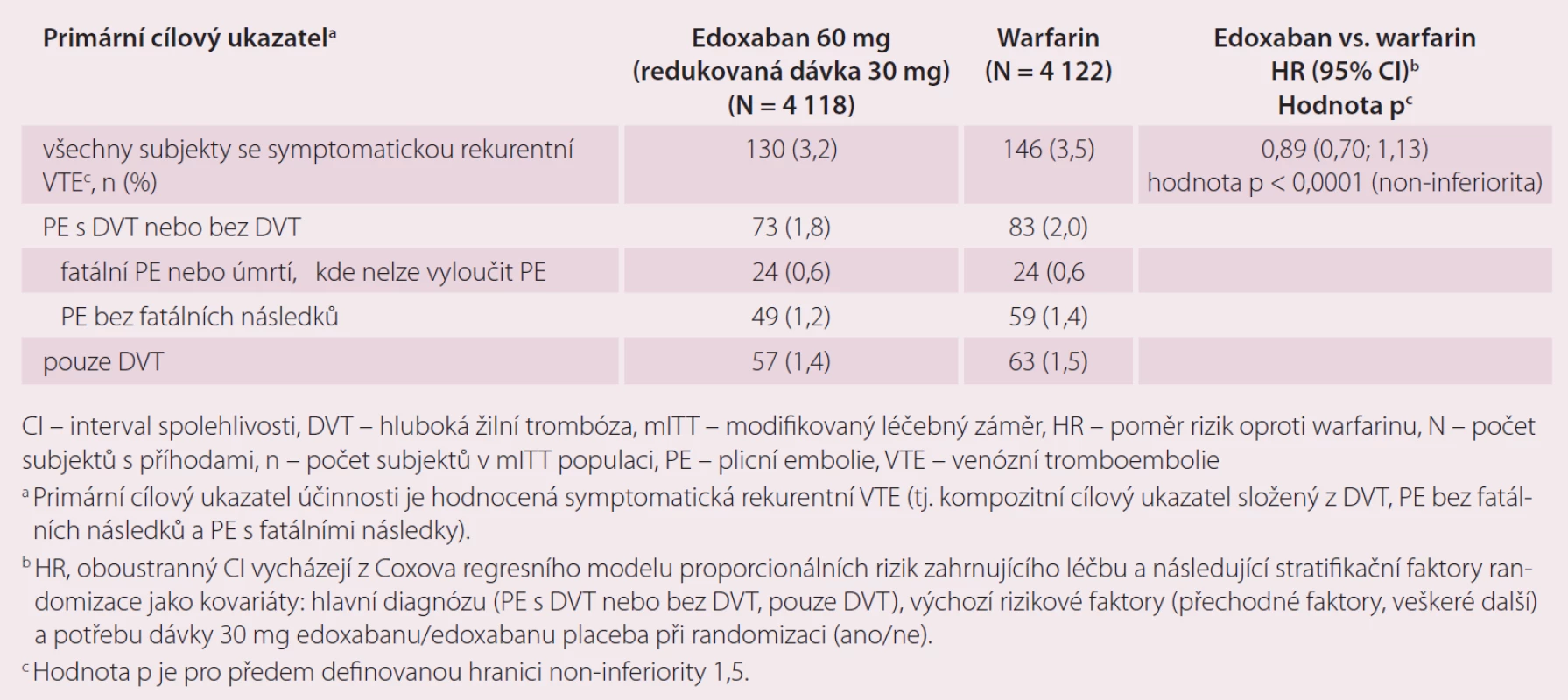
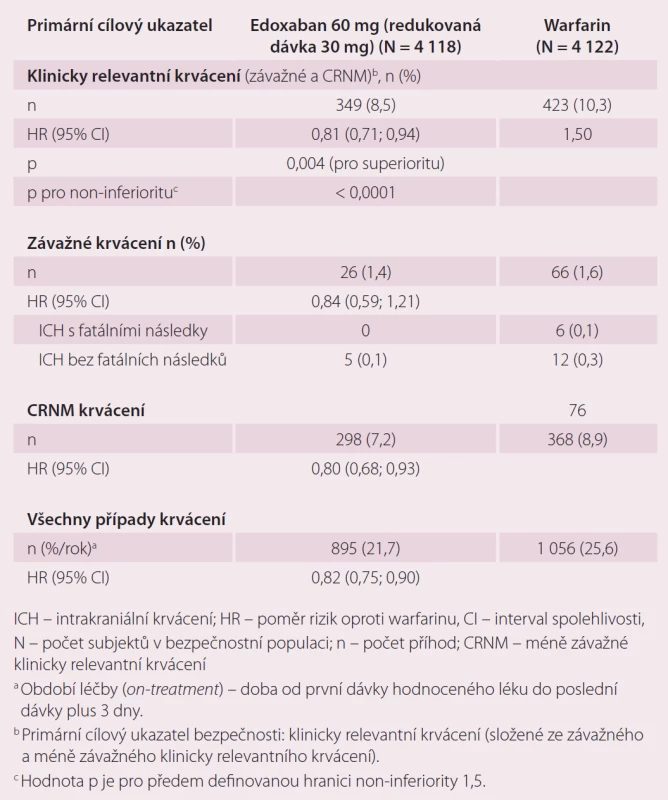
Z nežádoucích účinků ze studií ENGAGE AF-TIMI 48 a Hokusai-VTE jsou: krvácení do měkkých tkání kůže, epistaxe, slizniční krvácení, hematurie či vaginální krvácení. Dále může být přítomna anémie, vyrážka, svědění, nauzea a zhoršení jaterních funkcí.
Závěr
Farmakologické studie s edoxabanem získaly také údaje, co se týká bezpečnosti, toxicity po opakovaném podání, genotoxicity, hodnocení kancerogenního potenciálu nebo fototoxicity a neodhalily žádné zvláštní riziko pro člověka.
Edoxaban je ve svých dvou hlavních indikacích prevence CMP a systémové embolie u pacientů s NVFS a dále při léčbě DVT, PE a prevence jejich rekurence léčbou účinnější a bezpečnější ve srovnání s warfarinem.
V nejbližší době bude k dispozici i v ČR pod názvem Lixiana v 15mg, 30mg, 60mg tabletách.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
Doručeno do redakce: 5. 3. 2017
Přijato po recenzi: 9. 3. 2017
doc. MU Dr. Růžena Lábrová, Ph.D.
www.fnbrno.cz
labrova@seznam.cz
Zdroje
1. Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep vein thrombosis. Lancet 2012; 379(9828): 1835 – 1846. doi: 10.1016/ S0140-6736 (11)61904-1.
2. Lábrová R, Špinar J. Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní. Kardiol Rev Int Med 2016; 18(1): 47 – 51.
3. Špinar J, Lábrová R. Antikoagulační terapie u fibrilace síní. Remedia 2011; 21(2): 168 – 170.
4. Špinar J, Vítovec J. Edoxaban v klinických studiích a klinické praxi. Remedia 2016; 26(4):345 – 348.
5. Čihák R, Haman L, Táborský M. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation: Summary of the document prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58(1): e153 – e174. doi: 10.1016/ j.crvasa.2016.01.006.
6. Heidbuchel H, Verhamme P, Alings P et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015; 17(10): 1467 – 1507. doi: 10.1093/ europace/ euv309.
7. SPC přípravku Lixiana. 2016. Dostupné z: http:/ / www.sukl.cz/ modules/ medication/ detail.php?kod=0210631.
8. Gugliano RP, Ruff CT, Braunwald E et al. The ENGAGE TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369(22): 2093 – 2104. doi: 10.1056/ NEJMoa1310907.
9. Goette A, Merino JL, Ezekowitz MD et al. Edoxaban versus enoxaparin – warfarin in patients undergoing cardioversion of atrial fi brillation (ENSURE-AF): a randomised, open-label, phase 3b trial. Lancet 2016; 388(10055): 1995 – 2003. doi: 10.1016/ S0140-6736(16)31474-X.
10. Büller HR, Décousus H, Grosso MA et al. The Hokusai-VTE investigators. Edoxaban versus warfarin for the treatment of symptomatic venous tromboembolism. N Engl J Med 2013; 369(15): 1406 – 1415. doi: 10.1056/ NEJMoa1306638.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2017 Číslo 1
-
Všechny články tohoto čísla
- Kardiotoxicita protinádorových léčiv v experimentu
- Problematika kardiotoxicity primární léčby pacientek s karcinomem ovaria
- Pozdní následky kardiotoxicity
- Kardiotoxicita – současná doporučení
- Kardiotoxicita u hematoonkologických pacientov
- Rivaroxaban – farmakologický profil
- Edoxaban – farmakologický profil
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Moderní antitrombotická léčba po AKS – využíváme ji dostatečně?
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Betablokátory v registru chronického srdečního selhání FAR NHL
- Kardiotoxicita – základní pojmy a mechanizmy
- Manuál ambulantního specialisty-kardiologa
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Rivaroxaban – farmakologický profil
- Pozdní následky kardiotoxicity
