Zítřky lipidy modifikující terapie – jaké budou?
Lipid-modifying therapies of tomorrow – what will they be like?
The gradual reduction of the risk of atherothrombotic complications using drugs affecting serum lipid levels is now rightly considered to be one of the cardiovascular prevention pillars. Yet a number of patients with a high risk of vascular accidents do not reach the target values for various reasons. The search for new methods of lowering the risk by intervening in the metabolic transformation of serum lipoproteins continues and recently a number of interesting innovations have appeared. Procedures enabled by biotechnology development have been coming to the forefront and drugs preventing apoprotein translation (such as apoB, apo(a)), drugs inhibiting the protein-receptor interaction (such as monoclonal antibodies against PCSK9) or peptides inducing antibody response with similar effects are being clinically tested. In addition, the development of “traditional” methods continues and the established drug groups of statins or fibrates may expand in the future. However, we have to be patient and wait until new drugs unequivocally demonstrate their effects in clinical studies.
Keywords:
lipid-modifying treatment – statins – fibrates – mipomersen – loperamide – antiPCSK9 – CETP inhibitors
Autoři:
M. Vráblík
Vyšlo v časopise:
Kardiol Rev Int Med 2012, 14(3): 172-715
Kategorie:
Antidiabetika a kardiovaskulární riziko, aterogenní dyslipidemie a její lécba
Souhrn
Snižování rizika aterotrombotických komplikací pomocí léčiv ovlivňujících hladiny sérových lipidů dnes právem považujeme za jeden z pilířů kardiovaskulární prevence. Přesto řada nemocných s vysokým rizikem cévních příhod nedosahuje z různých důvodů cílových hodnot. Hledání nových způsobů snížení rizika zásahem do metabolické přeměny sérových lipoproteinů pokračuje a poslední doba přinesla řadu zajímavých novinek. Do popředí se dostávají postupy umožněné rozvojem biotechnologií a ve fázi klinických zkoušek jsou léčiva bránící translaci apoproteinů (např. apoB, apo(a)), inhibující interakci proteinů s receptory (např. monoklonální protilátky proti PCSK-9) nebo peptidy navozující protilátkovou odpověď s podobnými účinky. K tomu dále pokračuje vývoj „tradičními“ cestami a etablované lékové skupiny statinů či fibrátů se mohou v budoucnosti dále rozšiřovat. Musíme ale být trpěliví a vyčkat, než nová léčiva jednoznačně prokážou své účinky v klinických studiích.
Klíčová slova:
lipidy modifikující léčba – statiny – fibráty – mipomersen – lopitamid – antiPCSK-9 – CETP inhibitory
Úvod
Vždy, když se zamýšlíme nad budoucností, pouze více či méně přesně odhadujeme. Není tomu jinak ani v případě pojednání o výhledu v oblasti prevence aterosklerózy a jejích komplikací pomocí léčby ovlivňující koncentrace a vlastnosti aterogenních a antiaterogenních lipidových částic. A přemýšlíme-li o novinkách, nelze opominout tu v nadpisu článku. Lipidy modifikující terapie sice není elegantní ani libozvučný název pro skupinu léčiv, ale tradiční název „hypolipidemika“ už pravděpodobně nestačí. Nové postupy využívající zásahy do metabolizmu lipidů a lipoproteinů k ovlivnění procesu vzniku, rozvoje a stabilizace aterosklerotického plátu zasluhují i nový, výstižnější název. Snad přijdeme na pojmenování lepší, zatím musím čtenáře požádat o shovívavost a protentokrát budu používat tento. Název je ostatně okrajový, důležitější je obsah, který zahrnuje v poslední době stále více novinek. Co se tedy dělo a děje v oblasti vývoje nových léčebných možností dyslipidemie?
Tradiční přístupy – nové možnosti
Za tradiční přístupy k léčbě můžeme označit využití chemických substancí blokujících nebo stimulujících bílkovinné přenašeče, enzymy, receptory apod. Za příklad nám poslouží „staré dobré“ statiny (blokátory enzymu HMG-CoA reduktázy) nebo fibráty (agonisté receptorů PPARalfa). I v rámci těchto lékových skupin najdeme novinky. Novinku poněkud „v letech“ představuje pitavastatin, poslední z rodiny statinů již několik let používaný v klinické praxi v Japonsku a dalších mimoevropských zemích. Co nabízí nového ve srovnání s běžně etablovanými statiny? Ve srovnání s atorvastatinem můžeme očekávat mírně příznivější ovlivnění koncentrací HDL-cholesterolu při srovnatelné kontrole hladin LDL-c [1]. Navíc studie sledující diabetiky 2. typu naznačila možnost příznivého vlivu pitavastatinu na renální funkce [2]. Kdyby nic dalšího, pitavastatin by mohl rozšířit portfolio „silných“ statinů (umožňujících redukci LDL-c o minimálně 40 %), a být tak další možností pro pacienty netolerující současně dostupné přípravky. Zásadní průlom v terapii dyslipidemie od něj ale nečekáme. Podobně je na tom skupina fibrátů – i ta se vyvíjí a modernizuje. Na český trh přichází aktuálně nová léková forma fenofibrátu využívající principy nanotechnologie. Dalším zmenšením částic fenofibrátu se zlepšuje biologická dostupnost a tím i účinnost léčiva, což umožňuje při zachování účinku snížit množství podávané účinné látky. Nezanedbatelný může být také fakt, že nano-fenofibrát lze užívat bez souvislosti s jídlem a tím se zjednodušuje schéma podávání [3]. Pokračuje i hledání nových molekul s vylepšenými vlastnostmi fibrátů a na nedávném 80. kongrese Evropské společnosti pro aterosklerózu byla prezentována data o účincích vysoce účinného a selektivního nového agonisty PPARalfa (zatím s kódem K-877), jehož podávání v experimentu vyvolalo trojnásobný vzestup koncentrací HDL ve srovnání s fenofibrátem [4]. Výzkum pokračuje i v oblasti kombinovaných agonistů nitrojaderných receptorů PPARalfa a gama, tzv. glitazarů. Zatímco první z nich, muraglitazar, ukončil svou cestu z laboratoře ke klinickému využití nezdarem (zvyšoval KV riziko), novější aleglitazar zatím ve své cestě pokračuje a nachází se ve fázi III klinického výzkumu. Jak shrnul nedávný přehled údajů o této molekule, kombinující efekty fibrátů a glitazonů, výsledky dosud provedených sledování se zdají být slibné. Aleglitazar příznivě ovlivňuje všechny složky aterogenní dyslipidemie i parametry glukózového metabolizmu [5]. Na druhé straně nelze než souhlasit s odborníky, kteří vyzývají k opatrnosti a brzdí přílišný optimizmus do doby, než se podaří přínos léčby aleglitazarem jednoznačně prokázat klinickými studiemi.
Inhibice CETP – má ještě budoucnost?
Mezi tradiční (alespoň pokud jde o léčebný princip) můžeme zařadit i jednu z posledních lékových skupin usilujících o proniknutí do oblasti prevence a léčby aterosklerózy – inhibitory cholesteryl ester transfer proteinu (CETP). Tyto látky (označované někdy také jako cetrapiby) snižují aktivitu CETP zodpovědného za přenos triglyceridů a esterů cholesterolu mezi lipoproteinovými částicemi. Hlavním efektem této inhibice je zvýšení koncentrace HDL-cholesterolu až o 140 % a příznivé ovlivnění ostatních lipoproteinů (tab. 1, podle [6]). Velká očekávání a nadšení vystřídalo rozčarování po publikaci výsledků studií s torcetrapibem, který přes výborné ovlivnění hladin sérových lipidů zhoršoval koronární aterosklerózu [7]. Později byly zjištěny nežádoucí účinky torcetrapibu na osu renin--angiotenzin-aldosteron způsobující významný vzestup krevního tlaku, které nesouvisely s primárním mechanizmem účinku (tzv. off-target efekt). Vývoj cetrapibů se nezastavil, pokračoval výzkum molekul s odstraněným nepříznivým vlivem na regulaci krevního tlaku. Jejich přehled uvádí tab. 2. Poučeni z nezdarů s torcetrapibem neponechali producenti jeho následovníků nic náhodě a všechny cetrapiby procházejí velmi komplexním výzkumným programem, který korunují obrovské klinické studie s desítkami tisíc zařazených pacientů. Přesto jsme byli opět překvapeni. Počátkem května tohoto roku byla zastavena studie dal-OUTCOMES s dalcetrapibem. Rozhodnutí motivovaly výsledky interim analýzy studie dal-OUTCOMES sledující vliv dalcetrapibu na výskyt vaskulárních příhod v obrovské kohortě více než 15 000 nemocných s ICHS, která prokázala nulový přínos přidání této nové medikace ke standardní terapii. Překvapení bylo o to větší, že výsledky menších studií dokumentovaných zobrazovacími metodami (dal-PLAQUE, dal-VESSEL) a i vliv dalcetrapibu na parametry lipidového metabolizmu lze hodnotit jako velmi příznivé. Zatím nejsou známy žádné další podrobnosti kromě oznámení, že užívání dalcetrapibu nebylo spojeno s žádnými bezpečnostními signály, a jak uvádí oficiální stanovisko společnosti ROCHE, důvodem byla „absence klinicky významného efektu“ [8]. Zatím nemáme k dispozici žádné další informace a nemá smysl spekulovat o dalších možných důvodech ukončení dalcetrapibového výzkumného programu. Anacetrapib i evacetrapib (lišící se mj. afinitou a silou vazby k CETP od předcházejících neúspěšných molekul) ve vývoji pokračují a výsledky studií REVEAL a ACCELERATE jistě budou očekávány s napětím.
![Efekt inhibitorů CETP na lipidogram (% změna po léčbě) [6].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/4b2ce049293e0b81583a545780b7033a.png)
![Inhibitory CETP a jejich hlavní studie sledující výskyt klinických příhod [14].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/b9087d6d01424e714d0595f618a26391.png)
Přehled tradičních přístupů k léčbě dyslipidemie musí být zakončen zmínkou o inhibitorech mikrozomálního triglyceridy transferujícího proteinu (MTP). MTP zprostředkovává přenos lipidů na apoB, a zodpovídá tak za tvorbu chylomikronů a dalších na TG bohatých částic. Tím ovlivňuje i ostatní lipoproteinové podtřídy vznikající v kaskádě následující metabolické přeměny. Jako i v případech ostatních hypolipidemik je první reprezentant této lékové třídy lopitamid testován ve skupinách osob s familiární hypercholesterolemií (FH). V klinické studii s homozygotními pacienty s FH klesly koncentrace triglyceridů při použití MTP inhibitoru až o 65 % za současného snížení LDL-c o 50 % a apoB o 55 % oproti vstupním hodnotám [9]. Podobně jako některá další nová léčiva i inhibitory MTP mohou mít závažné nežádoucí účinky a jejich použití bude vyhrazeno pro nejtěžší případy familiárních dyslipidemií refrakterních k ostatním postupům (viz dále).
Nové přístupy – biologická léčba dyslipidemie
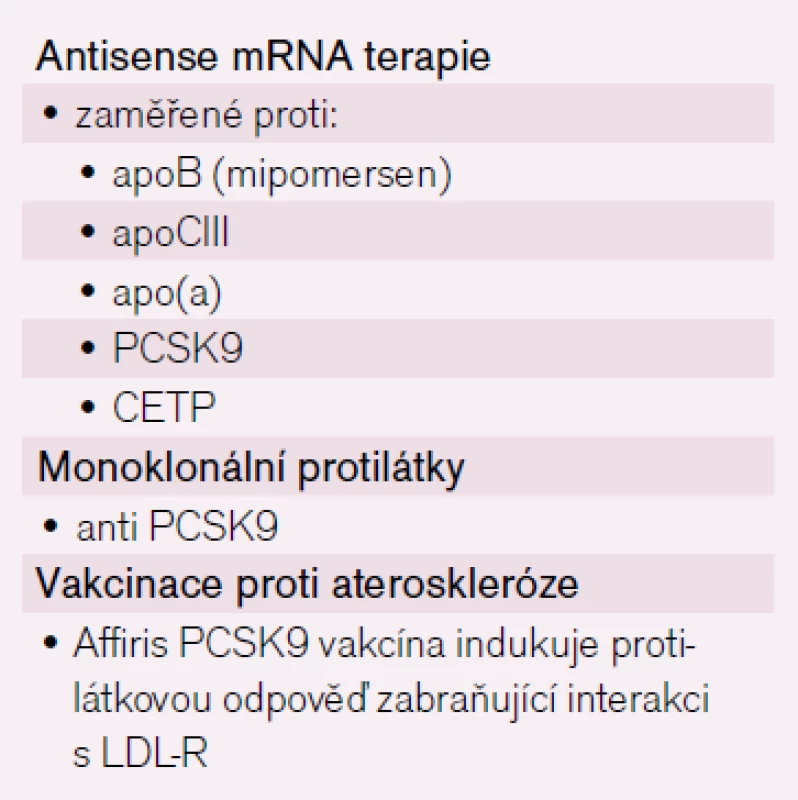
Na stále větší využití léčebných přístupů využívajících tzv. biologické principy léčby si zvykáme již delší dobu. Rozšíření používání monoklonálních protilátek v revmatologii, gastroenterologii, hematologii a mnoha dalších oborech přineslo zásadní změnu prognózy nemocných. Principy biologické léčby pronikají nyní i do oblasti léčby dyslipidemie. V zásadě jde o využití principu tzv. anti-sense terapie, monoklonálních protilátek nebo vakcinace imunogenními peptidy, jak uvádí tab. 3. První dva směry postoupily do III. fáze klinického testování, poslední jmenovaná možnost zatím prochází testováním na laboratorních zvířatech. První experimentální data ukazují, že lze navodit protilátkovou odpověď proti proteinům zvyšujícím hladiny aterogenních lipidů. Kolektiv rakouských autorů prezentoval na posledním sjezdu Evropské společnosti pro aterosklerózu výsledky svých pokusů, v nichž podání imunogenního peptidu navodilo produkci autoprotilátek proti vlastnímu PCSK-9 (viz dále) dostatečnou ke snížení LDL-cholesterolu o 25 % ještě za 38 týdnů po aplikaci třetí dávky séra [10].
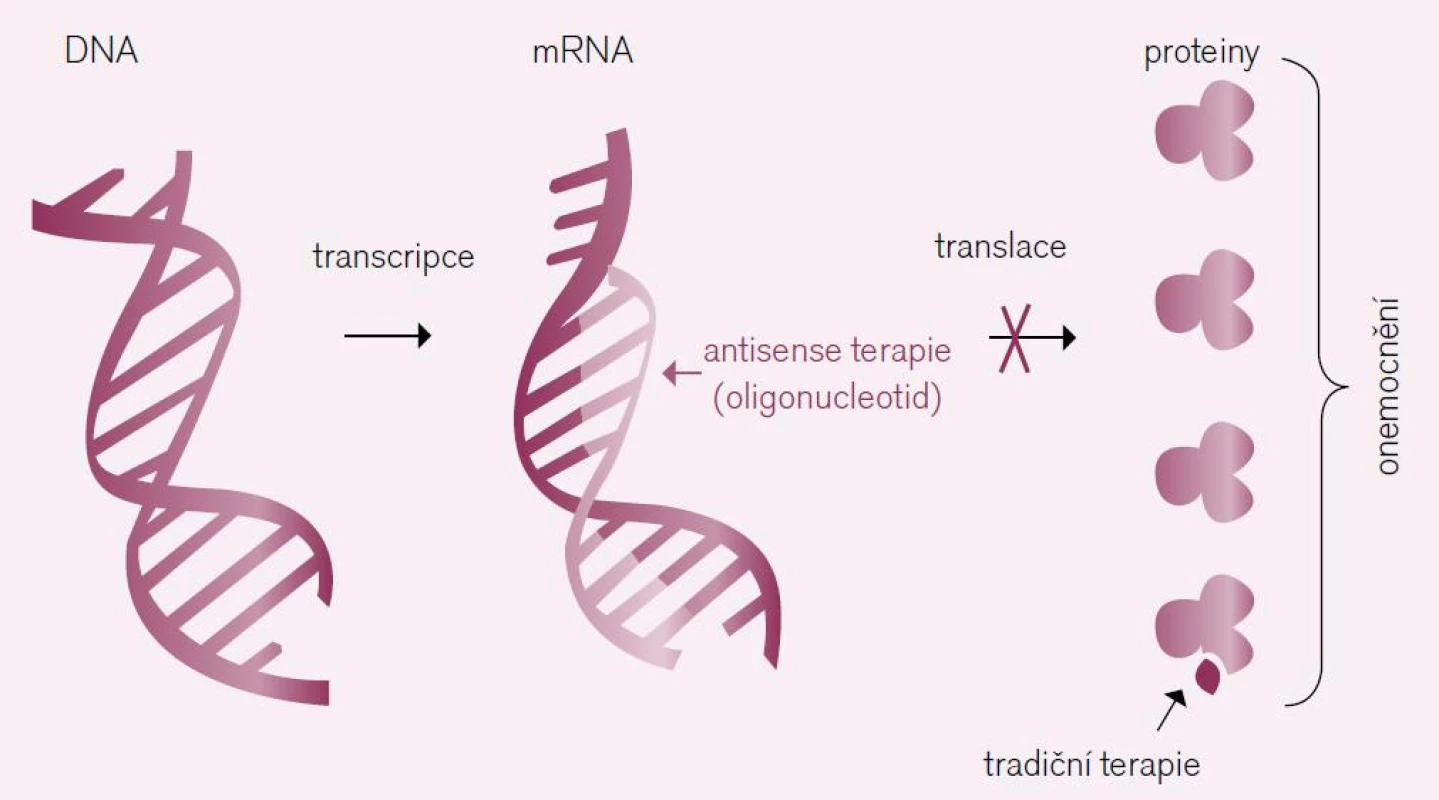
Antisense postupy využívají inhibice translace proteinů důležitých pro produkci aterogenních lipoproteinových částic. Principem je příprava oligonukleotidů komplementárních k úsekům přirozeně se vyskytující mRNA např. pro apoprotein B nebo apoprotein (a). Tyto uměle připravené oligonukleotidy se pak na principu párování RNA bází „nalepí“ na přirozenou mRNA, a zabrání tak translaci proteinu (obr. 1). Tím se sníží produkce lipoproteinů nesoucích příslušný apoprotein. Nejdále ve vývoji postoupil první reprezentant tohoto přístupu mipomersen-anti-sense mRNA snižující produkci apolipoproteinu B. Jak dokumentovaly studie na nemocných s familiární hypercholesterolemií, může tato nová terapeutická možnost přinést léčeným další pokles koncentrací aterogenních lipidů o 50 % nad rámec dosažitelný současnými terapeutickými možnostmi [11].
Jinou možností snížení LDL-c ve fázi klinických zkoušek jsou inhibitory PCSK-9 (proprotein-convertase subtilisin/kexin type 9), proteinu zodpovědného za degradaci receptorů pro LDL částice na povrchu hepatocytu. Tento postup byl objeven při studiu osob s geneticky podmíněnou velmi nízkou hladinou LDL-c. Jako příčina byla zjištěna právě mutace genu pro PCSK-9, která způsobuje zpomalení degradace LDL receptorů s následným snížením hladin LDL-c [12]. Farmaceutický vývoj se nyní snaží napodobit tuto „přírodní“ situaci vývojem specifického inhibitoru. Probíhají klinické zkoušky tří různých monoklonálních protilátek proti PCSK-9 zatím většinou u nemocných s nejtěžšími formami familiárních dyslipidemií, nejčastěji u pacientů s familiární hypercholesterolemií [13]. Nové „biologické“ terapie mají některé společné vlastnosti, které shrnuje tab. 4. Kromě parenterálního podání platí v tabulce uvedené vlastnosti také pro MTP inhibitor lopitamid. Z klinického úhlu pohledu se jako nejvýznamnější jeví nezbytnost jejich dalšího testování, protože zatím chybí údaje o přínosu jejich podávání z hlediska ovlivnění progrese aterosklerózy či výskytu vaskulárních příhod.

Jaké zítřky čekají na lipidy modifikující terapii?
Budoucnost nových lipidy modifikujících léčiv může být zářivá i temná, dnes můžeme s jistotou říci pouze to, že bude zajímavá. Jejich osud spočívá ve výsledcích klinických zkoušek, které nakonec určí, zdali příznivé biochemické změny budou mít předpokládaný dopad na výskyt cévních příhod a riziko aterosklerotických komplikací. Jak jsme ukázali, výzkum v oblasti možností snížení reziduálního kardiovaskulárního rizika prostřednictvím zásahu do lipidového metabolizmu není uzavřenou kapitolou. V očekávání novinek buďme zdrženliví a „rezervovaně optimističtí“ a spolehněme se na osvědčené postupy. Blízká budoucnost použití léčiv ovlivňujících metabolizmus lipoproteinů tak spočívá v použití kombinací stávajících farmak a v důslednějším prosazování správné a včasné indikace vhodné léčby. S tím souvisí i nezbytnost podávání dostatečné dávky umožňující dosažení cílových hodnot. Možná největší rezervu objevíme v prosazování a zlepšování spolupráce s nemocnými. Tímto způsobem velmi pravděpodobně můžeme podstatně zlepšit výsledky kardiovaskulární prevence do doby, než (alespoň některá) nová lipidy modifikující léčiva projdou úspěšně nelehkou cestou klinického hodnocení.
Doručeno do redakce 2. 7. 2012
Přijato po recenzi 31. 7. 2012
doc. MUDr. Michal Vrablík, Ph.D.
Centrum preventivní kardiologie,
3. interní klinika 1. LF UK a VFN, Praha
vrablikm@seznam.cz
Zdroje
1. Yokote K, Bujo H, Hanaoka H et al. Multicenter collaborative randomized parallel group comparative study of pitavastatin and atorvastatin in Japanese hypercholesterolemic patients: collaborative study on hypercholesterolemia drug intervention and their benefits for atherosclerosis prevention (CHIBA study). Atherosclerosis 2008; 201 : 345–352.
2. Kimura K, Shimano H, Yokote K et al. Effects of pitavastatin (LIVALO tablet) on the estimated glomerular filtration rate (eGFR) in hypercholesterolemic patients with chronic kidney disease: sub-analysisofthe LIVALO Effectiveness and Safety (LIVES) study. J Atheroscler Thromb 2010; 17 : 601–609.
3. Sauron R, Wilkins M, Jessent V et al. Absence of food effect with a 145 mg nanoparticle fenofibrate tablet formulation. Int J Clin Pharmacol Ther 2006; 44 : 64–70.
4. Takizawa T, Murakami K, Yano W et al. K-877, a highlypotent and selective PPARaagonist, improves dyslipidemia and atherosclerosis in experimental animal models. Milan: 80th congres EAS 2012.
5. Younk LM, Uhl L, Davis SN. Pharmacokinetics, efficacy and safety of aleglitazar for the treatment of type 2 diabetes with high cardiovascular risk. Expert Opin Drug Metab Toxicol 2011; 7 : 753–763.
6. Cannon CP. High-density lipoprotein cholesterol as the Holy Grail. JAMA 2011; 306 : 2153–2155.
7. Nissen SE, Tardig JC, Nicholls SJ et al. ILLUSTRATE Investigators. Effects of torcetrapib on the progression of coronary atherosclerosis. N Engl J Med 2007; 356 : 1304–1316.
8. Roche, Inc. Roche provides update on Phase III study of dalcetrapib. Press release. May 12, 2012. Dostupné na www.roche.com/media.
9. Cuchel M, Bloedon LT, Szapary PO et al. Inhibition of microsomal triglyceride transfer protein in familial hypercholesterolemia. N Engl J Med 2007; 356 : 148–156.
10. Galabova G, Wanko B, Winsauer G et al. AFFITOPE®-based active immunization targeting PCSK9 for the treatment of atherosclerosis. Milan: 80th Congres EAS 2012.
11. Raal FJ, Santos RD, Blom DJ et al. Mipomersen, anapolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet 2010; 375 : 998–1006.
12. Cohen CJ, Boerwinkle E, Mosley TH Jr et al. Sequence variations in PCSK9, low LDL and protection against coronary heart disease. N Engl J Med 2006; 354 : 1264–1272.
13. Stein E, Mellis S, Yancoupoulos GD et al. Effects of a monoclonal antibody to PCSK9 on LDL cholesterol levels. N Engl J Med 2012; 366 : 1108–1118.
14. Dostupné na www.clinicaltrials.gov, přístup dne 15. 6. 2012.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2012 Číslo 3
-
Všechny články tohoto čísla
- Antidiabetika a kardiovaskulární riziko, dyslipidemie a jejich léčba
- Antidiabetika a kardiovaskulární riziko – dříve a nyní
- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Hypertriglyceridemie a kardiovaskulární riziko
- Reziduální vaskulární riziko a možnosti jeho ovlivnění
- Zítřky lipidy modifikující terapie – jaké budou?
- Náhlá smrt v kardiologii
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
- Léčba levosimendanem: up-date 2012
- Ticagrelor u pacientů s akutním koronárním syndromem
-
Antitrombotica v prevenci cévní mozkové příhody
1. část – Význam protidestičkové léčby - Renální denervace a její postavení v léčbě rezistentní hypertenze
- Co je nového v Evropských doporučeních pro diagnostiku a léčbu srdečního selhání
- Hot-Lines z evropského sjezdu kardiologické společnosti – ESC 2012
- Mitrální stenóza v terminální fázi – kazuistika
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Ticagrelor u pacientů s akutním koronárním syndromem
- Hypertriglyceridemie a kardiovaskulární riziko
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
