Současné možnosti monitorování antitrombotické léčby – nová antitrombotika
Current possibilities of monitoring of antithrombotic therapy – new antithrombotic drugs
Current possibilities of monitoring of antithrombotic therapy – new antithrombotic drugs. Although currently commonly available antithrombotic drugs are effective for the prevention and treatment of thromboembolic disorders, they have several drawbacks. One of the most important of these is necessity of monitoring. In the past decades antithrombotic therapy research has focused on the development of new drugs with predictable pharmacological profile which allow physicians to use these agents without need of routine coagulation monitoring. On the other hand the assays to assess the level of anticoagulation may be of assistance in certain circumstances such as in case of overdose, in patients with therapy failure, in those with hemorrhagic complication or necessity of urgent surgery intervention and last but not least to assess the patient’s compliance. The authors summarise the current approach of laboratory investigation and coagulation assays in patient on antithrombotic therapy with special focussing on new antithrombotic drugs.
Keywords:
laboratory monitoring – new antithrombotic drugs – methods
Autoři:
A. Buliková; J. Zavřelová; M. Matýšková
Působiště autorů:
Oddělení klinické hematologie FN Brno-Bohunice
Vyšlo v časopise:
Kardiol Rev Int Med 2012, 14(2): 97-102
Souhrn
I když jsou současné běžně dostupné protitrombotické léky účinné pro prevenci i léčbu tromboembolických onemocnění, mají řadu nevýhod. Jednou z nejhlavnějších je potřeba monitorování. V posledních desetiletích se výzkum antitrombotické terapie soustředil na vývoj nových léků s předvídatelným farmakologickým profilem, který dovolí lékařům použití těchto přípravků bez potřeby rutinního monitorování. Na druhé straně mohou být metody ke zjištění míry antikoagulace nápomocné v určitých situacích, jako jsou předávkování, u pacientů s léčebným selháním, v případě krvácivé komplikace či je u nich nezbytný urgentní chirurgický výkon a nakonec i k ověření spolupráce pacienta. Autoři shrnují současný přístup k laboratornímu vyšetřování a koagulační metody u nemocných na antitrombotické léčbě se speciálním zaměřením na nová antitrombotika.
Klíčová slova:
laboratorní monitorování – nová antitrombotika – metody
Úvod
Více než padesát let byla antitrombotická léčba, ať již v profylaxi či léčbě trombózy, reprezentována především podáváním nefrakcionovaného heparinu (UFH) a/nebo perorálních inhibitorů vitaminu K, především warfarinu [1]. Tyto léky mají spoustu nevýhod, jejichž přehled uvádí tab. 1 [2]. Jednou z nejvýznamnějších bylo a stále je, že účinnou léčebnou a současně bezpečnou dávku preparátu není možné u konkrétního nemocného stanovit dopředu, a je ji zapotřebí titrovat na základě opakovaného laboratorního vyšetřování. Navíc je nezbytné laboratorní monitorování provádět v průběhu terapie opakovaně, často s potřebnou úpravou dávkování. Dokonce i relativně recentní metaanalýzy upozorňují na skutečnost, že hodnota aktivovaného parciálního tromboplastinového času (aPTT) při léčbě UFH nemá náležitou korelaci s úrovní antikoagulační léčby ani s klinickými výsledky [3], a to přes skutečnost, že monitorování za pomoci aPTT bylo zavedeno před čtyřiceti lety [4]. Každopádně sledování této antitrombotické léčby není náležitě standardizováno, citlivost závisí na typu použité aPTT reagencii a je nezbytné, aby si každá laboratoř nastavila své vlastní léčebné rozmezí [5]. Situace je přece jen odlišná v monitorování léčby dikumarolovými preparáty, které ovlivňují metabolizmus a finální karboxylaci vitamin K dependentních faktorů. Potřeba standardizace v této oblasti byla mnohem naléhavější vzhledem k tomu, že tato léčba je pacienty užívána obvykle delší dobu než UFH a laboratorní monitorování je často zabezpečeno různými laboratořemi, resp. dnes i metodami. To bylo důvodem pro zavedení mezinárodního normalizovaného poměru (International Normalized Ratio INR) u protrombinového času (PT) již bezmála před třiceti lety [6,7]. Tento poměr stírá zásadní rozdíly ve výsledcích mezi jednotlivými používanými laboratorními diagnostiky – tromboplastiny. V současné době je ověřena i metoda jeho stanovení za pomoci tzv. „PT/INR Line“ bez nutnosti užití WHO ISI kalibrace u různých lokálně používaných komerčních tromboplastinů a automatizovaných PT stanovení [8]. Standardní monitorování hodnoty PT INR v průběhu léčby vitamin K inhibitory předpokládají odběr ze žíly, vyšetření citrátové plazmy po centrifugaci plné krve v laboratoři se stanovením hodnoty INR, odeslání výsledku ošetřujícímu lékaři a jeho následnou interpretaci, případně úpravu dávky. Současné trendy monitorování stále častěji užívají automatizovaných metod „point-of-care“ testování (POCT), kdy z kapky kapilární krve je stanovena hodnota INR za pomoci testovacího proužku na přenosném POCT koagulometru. Takto je buď ve velmi krátkém čase (pár minut) k dispozici ošetřujícímu lékaři přímo v ordinaci, nebo umožňuje „sebe testování“ a dokonce i řízení antikoagulační léčby samotným edukovaným pacientem. Recentní přehledová sdělení o přesnosti a správnosti takovéhoto testování dokladují jeho akceptovatelné výsledky a klinickou přijatelnost a výhodnost [9].
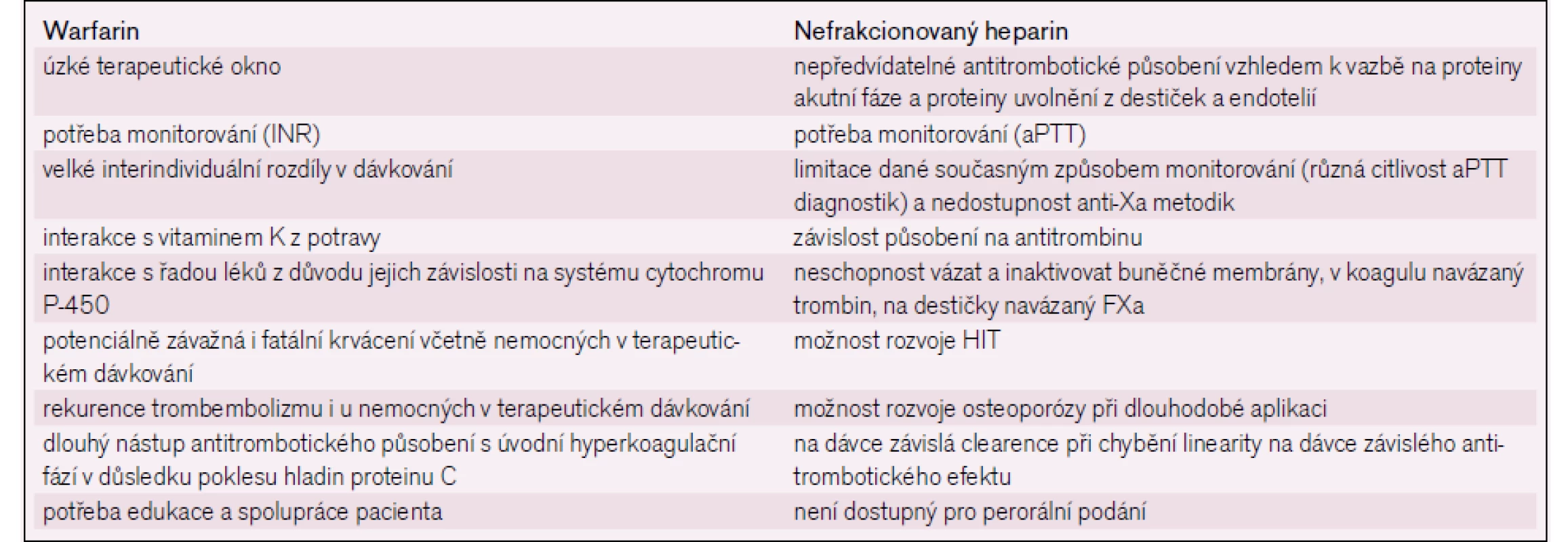
Jedním ze zásadních hybných momentů vývoje nových antitrombotik byla potřeba předvídatelného farmakoterapeutického profilu a tím i zrušení nezbytnosti pravidelného laboratorního sledování. Z tohoto pohledu všechna další rutinně užívaná antitrombotika již od 80. let minulého století v zásadě takovéto pravidelné monitorování ve smyslu zjištění laboratorní hodnoty k optimalizaci dávkového režimu s cílem zvýšit účinnost a/nebo bezpečnost nezbytně nevyžadují. Tato situace v antitrombotické terapii byla zahájena již érou nízkomolekulárních heparinů (low molecular weight heparins – LMWHs), pokračovala pentasacharidy a v současné době se týká nových, ale již běžně dostupných perorálních antitrombotik zaměřených proti faktoru Xa (tzv. xabany) či proti trombinu [10]. Zcela jinou skutečností je potřeba klinických lékařů laboratorně ohodnotit nastavení antitrombotické léčby u nemocného, u nějž zavedená terapie selhala, u pacienta, který má krvácivé komplikace či je u něj nezbytný urgentní chirurgický výkon, nebo v případech, kdy z důvodů dalších orgánových postižení můžeme předpokládat potíže s antitrombotickou léčbou. V neposlední řadě je zapotřebí dát klinikům možnost kontroly spolupráce pacienta na terapii. Tento přístup ke sledování léčby má ovšem zcela jiná pravidla než klasické monitorování, neboť většinou nemá za výsledek pouhou úpravu dávkování léku, jak je tomu u původních antitrombotik typu UFH či warfarinu. Je důležité určit, za jakých okolností, které nemocné, kterými laboratorními metodami vyšetřit, a to včetně stanovení načasování doby odběru krve na laboratorní vyšetření. Jen za těchto okolností může být výsledek laboratorního vyhodnocení antitrombotické terapie pro klinika přínosné.
Nízkomolekulární hepariny
Nízkomolekulární hepariny zahájily novou éru antitrombotické léčby na počátku 90. let minulého století a umožnily zavedení ambulantní léčby trombózy [11]. Již od jejich počátečního širšího uvedení do běžné praxe vyvstala otázka [12], zda je nutno monitorovat účinek léků, u nichž byl prokázán pozitivní výsledek podání bez ohledu na to, že žádné laboratorní testování při jejich zavádění neproběhlo. Výsledkem analýzy Borneua bylo, že naprostá většina takto léčených nemocných žádné sledování nepotřebuje. V roce 1998 bylo dáno v USA první oficiální doporučení [13] ke sledování léčby LMWH u určitých skupin pacientů; mezi ně patřili nemocní se zřetelnou nadváhou či podváhou, děti, těhotné ženy a pacienti s ledvinnou nedostatečností. Debata o potřebě a možnostech sledování účinku nízkomolekulárních heparinů pokračuje řadu let [14–15]. Indikace je zvažována i v některých případech, kdy je riziko antitrombotického efektu či krvácivých komplikací obtížně předpověditelné. Nemocní z těchto skupin byli totiž ze všech klinických sledování, která obvykle prokazovala efekt léčby nezávislý na laboratorním sledování, vyřazeni [16].
K monitorování účinku LMWH se používá stanovení anti-Xa [17] nejčastěji chromogenní metodou. Klinické vyhodnocení výsledku však má své limitace, na které musí být brán zřetel. Mezi tyto patří zejména následující skutečnosti:
- Hladiny anti-Xa aktivity nejsou dobrým prediktorem antitrombotického účinku. Jistá část protitrombotického vlivu je zprostředkována anti-trombinovým působením. Navíc se může uplatnit i uvolnění inhibitoru cesty tkáňového faktoru (tzv. TFPI) z cévní stěny.
- Hladiny anti-Xa aktivity nejsou ani dobrým prediktorem rizika krvácení. I když se předpokládá, že laboratorně dokladované předávkování pacienta LMWH bude provázeno vyšší tendencí ke krvácení, klinická studie tuto skutečnost nepotvrdila [18] a riziko krvácení souvisí častěji s věkem nemocného a s jeho celkovým klinickým stavem, případně s podávanou dávkou preparátu [15–18].
- Stanovení anti-Xa je metodou špatně standardizovanou. Nízkomolekulární hepariny jsou heterogenní skupinou léků, které se vzájemně odlišují nejen molekulovou hmotností, anti-Xa/anti-IIa poměrem (pro přehled viz tab. 2) [19], ale i farmakokinetikou a biologickým působením, jako jsou například interakce s růstovými faktory a jinými cytokiny, interakce s cévní stěnou a buněčnými elementy v cévním řečišti. Rutinní vyšetření anti-Xa aktivity běžně používá tzv. WHO Standard pro LMWH, který však byl vybrán jako „průměrný“, jak co se týče molekulových hmotností, tak antikoagulačních vlastností s poměrem anti-Xa//anti-IIa okolo 2,5. Opakovaně bylo doloženo, že takto provedené stanovení dává významně variabilní výsledky nejen mezi jednotlivými preparáty nízkomolekulárních heparinů [20], mezi originálními preparáty a jejich generiky [21], ale dokonce i mezi různými šaržemi téhož preparátu [22]. Z tohoto důvodu je dáno doporučení, aby si každá laboratoř provedla kalibraci a postavila standard na ten preparát, který je v daném zdravotním zařízení používán [17], a to zejména u preparátů, které mají vysoký anti-Xa/anti-IIa poměr [15,17,19].
![Základní charakteristiky dostupných preparátů nízkomolekulárních heparinů [19].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/a00ccffd7bc752efdf07f69f475b5415.png)
Standardní monitorování LMWH předpokládá subkutánní aplikaci a odběr v časovém rozmezí za 3–4 hod po podání. Nastavení profylaktických a léčebných hodnot se může lišit podle typu preparátu, podle důvodu antitrombotické terapie, resp. i rizika krvácení. Zcela odlišný typ monitorování podání LMWH odráží potřeby léčby a/nebo i adjustované vysoké profylaxe trombózy u dětí, kdy je často nezbytné a klinicky výhodné intravenózní podání nízkomolekulárních heparinů. V těchto případech se sledování léčby řídí odlišnou farmakokinetikou v dětském věku, jiným metabolizmem při podání léku, jinou nežli běžnou cestou subkutánní aplikace a pravidelné zjišťování hladin anti-Xa aktivity se blíží klasickému pojetí monitorování tak, jak jej známe z éry nefrakcionovaného heparinu [23].
Pentasacharidy
Syntetické pentasacharidy potencují aktivitu antitrombinu podobně jako LMWH. Vážou se přímo na pentasacharidové vazebné místo, což vede k ireverzibilní konformační změně antitrombinu s expozicí argininového rezidua, která se váže na Xa, čímž jej inaktivuje. Pentasacharid se pak uvolní a může se vázat s další molekulou antitrombinu. Z těchto pentasacharidů je pro klinickou praxi dostupný fondaparinux (Arixtra), který je možné použít jak k profylaxi pro pacienty s vysokým rizikem žilního tromboembolizmu (v ortopedii, chirurgii, ale i interní medicíně), tak i k léčbě již vzniklé tromboembolie. Na rozdíl od heparinu a LMWH fondaparinux vykazuje pouze mono-terapeutickou aktivitu nazývanou anti-Xa působení a nevykazuje jiné léčebné aktivity heparinu, jako jsou uvolňování TFPI, anti-IIa, protifibrinolytické a protizánětlivé působení [24].
Tento lék neovlivňuje základní koagulační testy, jako jsou aPTT, PT či trombinový čas (trombin time – TT). K monitorování hladiny léku v případě potřeby mohou být použity pouze anti-Xa metody [25] – chromogenní anti-Xa metoda, případně tzv. HepTest nebo jiné koagulační metody anti-Xa stanovení. V praxi se nejčastěji používají chromogenní anti-Xa metody s použitím komerčních na daný lék vztažených kalibrátorů a kontrol s udanou koncentrací fondaparinuxu v µg/ml. Kalibrační křivka je lineární v rozsahu koncentrací od 0 do 1,5 µg/ml. Léčebné rozmezí není bohužel pro daný lék jasně doporučeno, nicméně při profylaktickém dávkování 2,5 mg/den jsou očekávány hladiny 0,2–0,4 µg/ml, při běžné léčebné dávce 7,5 mg/den hladiny 0,5–1,5 µg/ml.
Přímé perorální inhibitory faktoru Xa („xabany“)
Tyto léky jsou namířeny jak proti volnému aktivovanému faktoru X (FXa), tak i proti FXa vázanému v protrombináze. Mají předvídatelný farmakologický profil, jsou tedy podávány ve fixních dávkách daných příbalovým letákem a SPC k přípravku. Z těchto preparátů jsou v České republice registrovány jednak apixaban (Eliquis) k prevenci venózního tromboembolizmu u dospělých s elektivní náhradou kyčelního nebo kolenního kloubu (SPC 18. 5. 2011), a jednak rivaroxaban (Xarelto), který, mimo předchozí indikaci, schválila od 9. 12. 2011 Evropská léková agentura (EMA) i pro prevenci cévní mozkové příhody a systémové embolizace u pacientů s nevalvulární fibrilací síní, pro léčbu hluboké žilní trombózy a prevenci recidivující hluboké žilní trombózy a plicní embolie. Z tohoto důvodu se dá v nejbližších měsících očekávat jejich širší využívání v klinické praxi. Řada dalších preparátů stejného anti-Xa působení je v pozdních fázích klinického zkoušení (např. betrixaban, darexaban, edoxaban, razaxaban a další).
Zkušenosti z rozšíření indikací z relativně krátkodobého podávání v období ortopedických výkonů k dlouhodobému užívání u interních indikací byly přece jen provázeny jistým nárůstem krvácivých komplikací (např. [26]), což vedlo řadu pracovních skupin k intenzivnímu výzkumu v oblasti možností sledování antitrombotického potenciálu těchto preparátů, které jinak žádné pravidelné monitorování nevyžadují. Xabany ovlivňují běžné testy koagulace, jejichž přehled podává tab. 3 [27–29]. Nálezy se poněkud liší podle testovaného přípravku; např. darexaban prodlužuje PT mnohem významněji než ostatní testované xabany [29], nebo apixaban ovlivňuje více PT nežli aPTT [30], zatímco u rivaroxabanu je tomu naopak [28]. Výsledky testování se taktéž liší podle použité reagencie [28,31]. Již tyto poznatky vedly k závěru, že běžné koagulační testy nejsou pro vyjádření účinku těchto léků na krevní srážení přínosné. Léčebné ovlivnění základních koagulačních testů je zde nutno ale zmínit z důvodu, že užívání tohoto typu protitrombotické léčby může být jediným důvodem náhodného nálezu prodloužení koagulačního času; situaci lze obvykle snadno vyřešit odložením odběru před dalším podáním, pokud nejde o předávkování. Mezi další laboratorní metody, které mohou být podáváním xabanů ovlivněny, patří i některé způsoby stanovení hladiny antitrombinu, rezistence k aktivovanému proteinu C a vysoké hladiny rivaroxabanu mohou nepatrně ovlivňovat i stanovení fibrinogenu Clausovou metodou ve smyslu snížení přibližně o 10 % výchozích hodnot [28].
![Ovlivnění základních koagulačních testů novými antitrombotiky [27–29].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/e255e4a5fe4acee684b6ac18b25860a6.png)
Běžné chromogenní metody stanovení anti-Xa aktivity tak, jak jsou rutinně používány k monitorování nepřímých inhibitorů FXa (LMWH, fondaparinux), jsou pro testování hladin xabanů nevhodné [32]. Důvodem je odlišný účinek přímých inhibitorů, které ovlivňují jak volný FXa, tak i ten vázaný v protrombinovém komplexu. Naopak se ukázaly velmi užitečné modifikované anti-Xa chromogenní metody, které užívají specifických kalibrátorů a kontrol s přesně udanou koncentrací preparátu vyjádřenou v ng/ml a jsou v současné době komerčně dostupné pouze pro rivaroxaban. Z kalibrační křivky rivaroxabanu lze pak provádět zjištění hladin léku v širokém rozmezí hodnot mezi 20–660 ng/ml. Při vyšetření zdravých dobrovolníků byly přitom zjišťovány maximální hodnoty 112–184 ng/ml po dávce 10 mg, 111–294 ng/ml po užití 20 mg a průměrná maximální hodnota 318 ng/ml při medikaci 20 mg rivaroxabanu 2krát denně [32]. U nemocných po ortopedických operacích byly nálezy srovnatelné 117 ± 78 ng/ml při medikaci 10 mg denně, bez souvislosti s věkem, pohlavím, tělesnou hmotností a funkcí ledvin [33].
Barret et al [31] testovali chromogenní stanovení anti-Xa aktivity u různých přímých FXa inhibitorů (apixaban, razaxaban, rivaroxaban a BMS-645068) za použití různých komerčních diagnostik a tyto porovnávali se stanovením založeném na PT. Zjistili, že metody založené na PT jsou sice na dávce závislé, ale méně senzitivní, a navíc zřetelně závisí na použitém tromboplastinu. Chromogenní metody stanovení anti-Xa aktivity jsou zřetelně citlivější, i když i zde citlivost mírně kolísá s typem použité firemní reagencie (Rotachrom > Stachrom > Coatest).
Samama et al [32] taktéž testovali globální koagulační test PT pro různé koncentrace rivaroxabanu za použití různých komerčních diagnostik. Zjistili, že vyhodnocení prodloužení PT i INR nejsou použitelné, ale při vyjádření výsledku PT jako koncentrace rivaroxabanu (ng/ml) může být metoda užitečná k měření rivaroxabanu ve vysokých koncentracích, když se předpokládá předávkování. Metoda má nízkou senzitivitu při nízkých koncentracích rivaroxabanu a není doporučována k rutinnímu měření plazmatické koncentrace rivaroxabanu pro vysokou variabilitu metod a nízkou senzitivitu.
Další teoretické možnosti detekce aktivity přímých inhibitorů FXa jsou ředěný test s jedem Russelovy zmije, jednostupňový protrombinázou indukovaný koagulační čas (PiCT) a HepTest; oba poslední zmíněné zejména se zkrácenou dobou inkubace [34]. Tripodi et al [35] navrhuje použití PT a zavedení normalizace analogické stanovením INR u pacientů na antikoagulační léčbě dikumarolovými preparáty. To představuje použít dle WHO standardizovaný postup stanovení citlivosti tromboplastinů ve formě mezinárodního indexu citlivosti (ISI), který je řadu let běžně používán u antagonistů vitaminu K, i pro léčbu xabany, resp. rivaroxabanem. Výhody tohoto postupu autoři spatřují ve skutečnosti, že jednoduché stanovení PT je dostupné každé hemostazeologické laboratoři. Metodika stanovení ISI-rivaroxaban sjednocuje citlivost různých tromboplastinů a umožňuje jistou standardizaci. Nicméně tento postup je možná vhodný a využitelný v případech zjevného či podezřelého předávkování léčby, ale zřejmě málo citlivý k detekci běžných koncentrací rivaroxabanu [32].
Ať již je testování prováděno jakýmkoli způsobem, je vždy nutné brát v úvahu farmakokinetiku preparátu; to znamená maximální nástup maximálního účinku do 3 hod po p. o. aplikaci a poločas 9–15 hod; nepatrně kratší pro apixaban ve srovnání s rivaroxabanem [36].
Perorální přímé inhibitory trombinu
Tento způsob antitrombotické terapie je v současné době představován podáváním dabigatranu (Pradaxa). Tento je dle informací SÚKL schválen pro použití v profylaxi žilního tromboembolizmu v souvislosti s ortopedickými výkony (totální náhrada kyčelního nebo kolenního kloubu), resp. i v indikovaných případech profylaxe cévní mozkové či systémové embolizace u fibrilace síní (SPC z 16. 9. 2011). V porovnání s warfarinem obstál tento preparát i v sekundární profylaxi žilního tromboembolizmu [37]. Bez ohledu na předvídatelný farmakokinetický profil, který umožňuje režim fixního dávkování bez potřeby rutinní monitorace, lze určit situace, bez kterých se stanovení ovlivnění procesů krevního srážení a vyhodnocení metod, které odrážejí úroveň antikoagulační léčby, neobejde. Podobně jako u xabanů mohou být tyto situace navozeny nutností urgentního operačního//invazivního výkonu, přítomností krvácivých či naopak trombotických komplikací, podezřením na nespolupráci nemocného. Dominantně renální vylučování preparátu dává příležitost ke vzniku předávkování tam, kde insuficience renálních funkcí nebyla před podáním/při podání monitorována nebo vznikla náhle v průběhu dlouhodobého podávání preparátu. Všechny tyto situace si vynutí laboratorní vyšetření ke zjištění nastavení úrovně antitrombotické léčby a odhalení rizika trombózy či krvácení. Vzhledem k relativně krátkému poločasu preparátu je důležité vědět, jaký je odstup odběru krve v porovnání s užitím léku. Koagulační časy se zřetelně liší při odběru po 2 hod po medikaci v porovnání s odběry mezi 8 a 12 hod po podání [38]. Vrchol účinku je předpokládán mezi 2 a 4 hod po požití léku.
Základní koagulační testy
Prodloužení aktivovaného parciálního tromboplastinového testu (aPTT) koresponduje s koncentracemi dabigatranu, kdy medián navýšení je u osob užívajících léčebné dávky (150 mg 2krát denně) přibližně okolo 2,0 R, po 12 hod hodnota klesá přibližně na 1,5násobek. Méně než 10 % pacientů má však stále hodnoty testu dvojnásobné. Test se jeví jako relativně necitlivý ke zjištění plazmatických koncentrací preparátu [38]. Každopádně zřetelné prodloužení aPTT při medikaci přímých inhibitorů trombinu by měly být opakovány či konfirmovány s testy jinými (ekarinový srážecí test, ředěný trombinový test aj.). aPTT může být přínosný při normální hodnotě (negativní prediktivní hodnota), která znamená, že je přítomna malá antikoagulační aktivita léku. Hodnoty testu PT/INR přesahují 2,0 obvykle jen v supraterapeutických dávkách [31]. Dabigatran má jen malý vliv na hodnotu PT (INR) v koncentracích, které mají klinický význam [31]. Nicméně dostupná data nejsou jednotná (viz tab. 3). Zvláště citlivý je k dabigatranu trombinový test (TT), který vykazuje na dávce závislou lineární odpověď. Nicméně tato metodika je špatně standardizovaná a pro monitorování hladin je test až příliš citlivý. Může však být účinně použit tam, kde chceme vyloučit, že žádný dabigatran není přítomen v krvi. K posouzení nakolik je pacient naopak předávkován, je však test již málo využitelný.
Speciální testy
Hemoclot® Thrombin Inhibitor (Hyphen BioMed) je senzitivní ředěný TT vyvinutý ke kvantitativnímu stanovení aktivity přímých inhibitorů trombinu v plazmě, který je založen na inhibici definovaných a konstantních koncentrací trombinu. Dává lineární závislost mezi dobou vzniku sraženiny (mezi 30 a 75 s) a koncentrací dabigatranu (0–300 ng/ml). Test může být použit pro jakýkoli přímý inhibitor trombinu. Test je v současné době validován pro dabigatran, hirudin a argatroban.
Ekarinový čas (ecarin clotting time – ECT) je metoda specifická pro generaci trombinu. Hadí jed ekarin specificky aktivuje trombin za vzniku meizotrombinu, nestabilního trombinového prekurzoru. Přímé inhibitory trombinu inhibují aktivitu meizotrombinu a takto ECT zabezpečuje přímé měření aktivity léku, který má povahu přímého inhibitoru trombinu. Při medikaci dabigatranu 2krát 150 mg se hodnoty ECT poměru u zdravých dobrovolníků pohybují mezi 2–4. V tuto chvíli však neexistují komerčně dostupné sety, které by byly standardizovány či validovány pro dabigatran [38].
Závěr
Nová antitrombotika jsou povětšinou léky, jejichž farmakologické vlastnosti umožňují standardní dávkování bez potřeby laboratorního sledování. Nicméně mají jednu podstatnou nevýhodu – nemají žádné specifické antidotum. Z tohoto důvodu se řada autorů zabývá problémem jak řešit krvácení či potřebu urgentního invazivního výkonu u těchto nemocných [39–41]. Vzhledem k relativně krátkému poločasu těchto preparátů je však nutné posoudit i aktuální úroveň antitrombotického působení předtím, než bude zahájena léčba směřující k přerušení jejich účinku; tato je totiž nespecifická, pro nemocného potenciálně nevýhodná a navíc většinou finančně náročná. Laboratorní metody, které účinek podané medikace dokážou cíleně vyhodnotit, jsou z tohoto důvodu pro rozšířené užívání těchto léků naprosto nezbytné.
Doručeno do redakce 14. 3. 2012
Přijato po recenzi 29. 3. 2012
MUDr. Alena Buliková, Ph.D.
RNDr. Jiřina Zavřelová
prim. MUDr. Miloslava Matýšková, CSc.
Oddělení klinické hematologie FN Brno-Bohunice
abulik@fnbrno.cz
Zdroje
1. Bauer KA. Recent progress in anticoagulant therapy: oral direct inhibitor of thrombin and factor Xa. J Thromb Haemaost 2011; 9 (Suppl 1): 12–19.
2. Buliková A, Penka M. Selhání antikoagulační léčby. Vnitř Lék 2006; 52 : 107–118.
3. Vardi M, Laor A, Bitterman H. Activated partial thromboplastin time monitoring in patients receiving unfractionated heparin for venous thromboembolism in relation to clinical outcomes. Thromb Haemost 2009; 102 : 879–886.
4. Basu D, Gallus A, Hirsh J et al. A prospective study of the value of monitoring heparin treatment with the activated partial thromboplastin time. N Engl J Med 1972; 287 : 324–327.
5. Zavřelová J, Smejkal P, Matýšková M et al. Citlivost reagencií aPTT. Dny hemostázy a trombózy Martin 1994, Abstrakta – nečíslováno.
6. World Health Organization Expert Committee on Biological Standardization. Requirements for thromboplastins and plasma used to control oral anticoagulant therapy (Requirements for biological substances no. 30, revised 1982). Thirty-Third report. Annex 3. World Health Organ Tech Rep Ser 1983; 687 : 81–105.
7. Poller L. International normalised ratios (INR) – the first 20 years. J Thromb Haemost 2004; 2 : 849–860.
8. Poller L, Ibrahim S, Kearon M et al. European Action On Anticoagulation. The prothrombin time/international normalized radio (PT/INR) Line: derivation of local INR with commercial thromboplastins and coagulometers – two independent studies. J Thromb Haemost 2011; 9 : 140–148.
9. Christensen TD, Larsent TB. Precision and accuracy of point-of-care testing coagulometers used for self-testing and self-management of oral anticoagulation therapy. J Thromb Haemost 2012; 10 : 251–260.
10. Bounameaux H, Reber G. New oral antithrombotics: a need for laboratory monitoring. Against. J Thromb Haemost 2010; 8 : 627–630.
11. Buller HR, Sohne M, Middeldrop S. Treatment of venous thromboembolism. J Thromb Haemost 2005; 3 : 1554–1560.
12. Borneu B. Low molecular weight heparin therapy: is monitoring needed? Thromb Haemost 1994; 72 : 330–334.
13. Laposata M, Green D, van Cott ENM et al. College of American Pathologist Conference XXXI on laboratory monitoring of anticoagulant therapy. The clinical use and laboratory monitoring of low-molecular-weight heparin, danaparoid, hirudin and related compounds, and argatroban. Arch Pathol Lab Med 1998; 122 : 799–807.
14. Harenberg J. Is laboratory monitoring of low-molecular-weight heparin therapy necessary? Yes. J Thromb Haemost 2004; 2 : 547–550.
15. Bounameaux H, de Moerloose P. Is laboratory monitoring of low-molecular-weight heparin therapy necessary? No. J Thromb Haemost 2004; 2 : 551–554.
16. Greaves M. Control of Anticoagulation Subcommittee of the Scientific and Standardization Committee of the International Society of Thrombosis and Haemostasis. Limitation of the laboratory monitoring of heparin therapy. Scientific and Standardization Committee Communications: on behalf of the Control of Anticoagulation Subcommittee of the Scientific and Standardization Committee of the International Society of Thrombosis and Haemostasis. Thromb Haemost 2002; 87 : 163–164.
17. Baglin T, Barrowcliffe TW, Cohen A et al. British Committee for Standards in Haematology. Guidelines on the use and monitoring of heparin. Br J Haematol 2006; 133 : 19–34.
18. Nieuwenhuis HK, Albada J, Banga JD et al. Identification of risk factors for bleeding during treatment of acute venous thromboembolism with heparin and low molecular weight heparin. Blood 1991 : 78 : 2337–2343.
19. Gray E, Mulloy B, Barrowcliffe TW. Heparin and low-molecular-weight heparin. Thromb Haemost 2008; 99 : 807–818.
20. Ellison J, Thomson AJ, Conkie JA, et al. Thromboprophylaxis following Caesarean Section. A comparison of the antithrombotic properties of three low molecular weight heparins – dalterparin, enoxaparin and tinzaparin. Thromb Haemost 2001; 86 : 1374–1378.
21. Maddaineni JM, Walenga JM, Jeske WP et al. Product individuality of commercially available low-molecular-weight heparins ond their generic versions: therapeutical implications. Clin Appl Thrombosis Hemostasis 2006; 12 : 267–276.
22. Gosselin RC, King JH, Janatpour KA et al. Variability of plasma anti-Xa activities with different lots of enoxaparin. Ann Pharmacother 2004; 38 : 563–568.
23. Fiamoli V, Blatný J, Zapletal O et al. Treatment of deep vein thrombosis with continuous IV infusion of LMWH: A retrospective study in 32 children. Thrombosis 2011, doi: 10.1155/2011/981497.
24. Hirsch J. Fondaparinux. BC Decker Inc., Hamilton 2007.
25. Castellone DD, VanCott EM. Laboratory monitoring of new anticoagulants. Am J Hematol 2010; 85 : 185–187.
26. Galanis T, Thompson L, Palladino M et al. New oral anticoagulants. J Thromb Thrombolysis 2011; 31 : 310–320.
27. Garcia D, Libby E, Crowther MA. The new oral anticoagulants. Blood 2010; 115 : 15–20.
28. Hillarp A, Baghaei F, Fagerberg Blixter I et al. Effects of the oral, direct factor Xa inhibitor rivaroxaban on commonly used coagulation assays. J Thromb Haemost 2011; 9 : 133–139.
29. Funatsu T, Iwatskuki Y, Kaku S. Darexaban had high sensitivity in the prothrombin time clotting test. J Thromb Haemost 2012; prepubl online: doi: 10,1111/j.1538-7836.2021.04655.x
30. Wong PC, Crain EJ, Xin B et al. Apixaban, an oral, direct and highly selective factor Xa inhibitor: in vitro, antihromobotic and andihemostatic studies. J Thromb Haemost 2008; 6 : 820–829.
31. Barrett YC, Wang Z, Frost C et al. Clinical laboratory measurement of direct factor Xa inhibitors. Anti-Xa assay is preferable to prothrombin time assay. Thromb Haemost 2010; 104 : 1263–1271.
32. Samama MM, Contant G, Spiro TE et al. Rivaroxaban Anti-Factor Xa Chromogenic Assay Field Trial Laboratories. Evaluation of the anti-factor Xa chromorgenic assay for the measurement of rivaroxaban plasma concentrations using calibrators and controls. Thromb Haemost 2012; 107 : 379–387.
33. Freyburger G, Macouillard G, Labrouche S et al. Coagulation parameters in patients receiving dabigatranetexilate or rivaroxaban: two observational studies in patients undergoing total hip or total knee replacement. Thromb Res 2011; 127 : 457–465.
34. Samama MM, Martionoli JL, LeFlem L et al. Assessment of laboratory assays to measure rivaroxaban-an oral, direct factor Xa inhibitor. Thromb Haemost 2010; 103 : 815–825.
35. Tripodi A, Chantarangkul V, Guinet C et al. The international normalized ratio calibrated for rivaroxaban has the potential to normalize prothrombin time results for rivaroxaban treated patients: results of an in vitro study. J Thromb Haemost 2011; 9 : 226–228.
36. Gross PL, Weitz JI. New anticoagulants for treatment of venous thromboembolism. Ateriosler Thromb Vasc Biol 2008; 28 : 380–386.
37. Schulman S, Kearon C, Kakkar AK et al. RE-COVER Study Group. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009 10.1056/NEJMoa0906589, downloaded from www.nejm.org December 9, 2009.
38. vanRyn J, Stangier J, Haertter S et al. Dabigatranetexilate – a novel, reversible, oral direct thrombin inhibitor: Interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost 2010; 103 : 1116–1127.
39. Crowther MA, Warkentin TE. Managing bleeding in anticoagulated patients with a focus on novel therapeutic agents. J Thromb Haemost 2009; 7 (Suppl 1): 107–110.
40. Erenberg ES, Kamphuisen PW, Sijpkens MK et al. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate. A randomized, placebo-controlled, crossover study in healthy subjects. Circulation 2011; 124 : 1573–1579.
41. Fukuda T, Honda Y, Kamisato C et al. Reversal of anticoagulatn effects of edoxaban, an oral, direct factor Xa inhibitor, with haemostatic agents. Thromb Haemost 2012; 107 : 253–259.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2012 Číslo 2
-
Všechny články tohoto čísla
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Vorapaxar v klinických studiích
- Čo je vernakalant a kde je jeho miesto v klinickej praxi?
- Eprosartan – duální blokátor AT1 receptorů
- Polypragmazie a oběhové selhání při maligních komorových arytmiích s postižením jaterních funkcí
- Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy
- Galerie autorů
- Máme dnes k dispozici lepší antitrombotika?
- Antiagregační a antikoagulační léčba – základní principy
- Perorální protidestičková léčba u pacientů s akutním koronárním syndromem
- Současné doporučení k antiagregační léčbě v neurologii
- Antikoagulační terapie a fibrilace síní
- Nová perorální antitrombotika v prevenci a léčbě trombembolizmu
- Nová antitrombotika v prevenci pooperační tromboembolické nemoci
- Současné možnosti monitorování antitrombotické léčby – nová antitrombotika
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Antiagregační a antikoagulační léčba – základní principy
- Antikoagulační terapie a fibrilace síní
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Současné doporučení k antiagregační léčbě v neurologii
