Nová antitrombotika v prevenci pooperační tromboembolické nemoci
New antithrombotic drugs in the prophylaxis of postoperative venous thromboembolism
The risk of postoperative venous thromboembolism is substantial, especially in patients undergoing major orthopedic surgery. Low molecular weight heparins have been established as “gold standard” of pharmacological thromboprophylaxis in this group of patients; however, the subcutaneous administration is inconvenient, the effectiveness is dependent on antithrombin level, and they are contraindicated in some cases such as allergy or heparin induced thrombocytopenia. Three new oral anticoagulants have recently been approved for thromboprophylaxis after hip and knee athroplasty – an oral direct thrombin inhibitor dabigatran and two oral direct inhibitors of activated factor X (rivaroxaban and apixaban). Their major benefits are the oral route of administration, relatively wide therapeutic window, and predictable pharmacokinetics. Their major disadvantages are: lack of antidote and contraindication in patients with impairment of renal function (Dabigatran is contraindicated in patients with glomerular filtration < 30 ml/min., rivaroxaban and apixaban are contraindicated in patients with glomerular filtration < 15 ml/min.). The pharmacokinetics of these antithrombotic drugs leads to a low risk of drug interactions; they are limited to P-glycoprotein inhibitors and inducers, which influence the level of dabigatran, drugs inhibiting both P-glycoprotein and CyP 3A4, which increase rivaroxaban and apixaban exposure, and inducers of P-glycoprotein and/or CyP 3A4, which induce reduction of rivaroxaban and apixaban level.
Keywords:
dabigatran – rivaroxaban – apixaban – thromboprophylaxis – hip replacement – knee replacement
Autoři:
P. Kessler
Působiště autorů:
Odd. hematologie a transfuziologie, Nemocnice Pelhřimov, p. o.
Vyšlo v časopise:
Kardiol Rev Int Med 2012, 14(2): 93-96
Souhrn
Riziko pooperační tromboembolické nemoci je významné, zejména u pacientů podstupujících velké ortopedické operace. U této skupiny pacientů jsou považovány za zlatý standard farmakologické tromboprofylaxe nízkomolekulární hepariny, nicméně jejich podkožní podání je nepohodlné, jejich efekt je závislý na hladině antitrombinu a v některých případech, např. při alergii nebo heparinem indukované trombocytopenii, jsou kontraindikovány. Pro tromboprofylaxi po totální endoprotéze kyčelního a kolenního kloubu byla nedávno schválena tři nová antitrombotika – perorální přímý inhibitor trombinu – dabigatran a dva perorální přímé inhibitory aktivovaného faktoru X (rivaroxaban a apixaban). Jejich hlavními výhodami jsou perorální podání, relativně široké terapeutické okno a předvídatelná farmakokinetika. Jejich hlavními nevýhodami jsou: chybění antidota a kontraindikace u pacientů se snížením renálních funkcí (dabigatran je kontraindikován u pacientů s glomerulární filtrací < 30 ml/min, rivaroxaban a apixaban jsou kontraindikovány u pacientů s glomerulární filtrací < 15 ml/min). Farmakokinetika těchto antitrombotik vede k nízkému riziku lékových interakcí, ty jsou limitovány na inhibitory a induktory P-glykoproteinu, které ovlivňují hladinu dabigatranu, léky inhibující současně P-glykoprotein a CYP3A4, které zvyšují expozici rivaroxabanu a apixabanu, a induktory P-glykoproteinu a/nebo CYP3A4, které snižují hladinu rivaroxabanu a apixabanu.
Klíčová slova:
dabigatran – rivaroxaban – apixaban – tromboprofylaxe – náhrada kyčelního kloubu – náhrada kolenního kloubu
Úvod
Každý operační výkon je spojen se dvěma riziky vyplývajícími z poruchy hemostázy – s rizikem krvácení a s rizikem trombózy. Ke krvácení dochází v důsledku narušení cévní integrity samotným chirurgickým výkonem, u velmi rozsáhlých operací spojených s velkými krevními ztrátami se může uplatnit diluční koagulopatie [1]. K poruše krevního srážení v některých případech přispívá také dysfunkce krevních destiček, hypotermie a antikoagulace, např. při operacích s použitím mimotělního oběhu [2].
Na vzniku trombózy v průběhu operace se podílí stáza krve, v některých případech traumatizace cévní stěny. V pooperačním období dochází k reaktivnímu zvýšení hladiny fibrinogenu, faktoru VIII a von Willebrandova faktoru [3], endoteliální dysfunkce může vést ke snížené expresi trombomodulinu s následnou dysfunkcí systému proteinů C a S. Tyto změny přetrvávají po dobu několika dnů až týdnů. Obecně riziko trombózy stoupá s věkem a zvyšuje ho řada dalších faktorů (tab. 1).
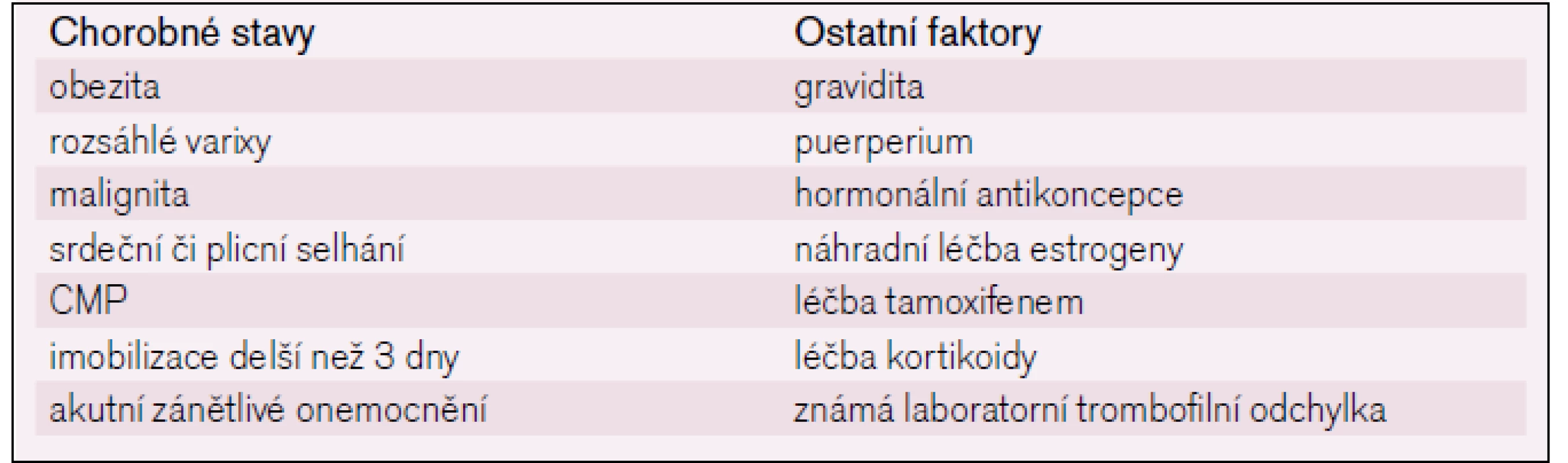
Podle 8. ACCP guidelines [4] je možno operační výkony rozdělit do tří skupin:
- Skupina s nízkým rizikem: Malá operace u mobilního pacienta. Riziko pooperační trombózy je malé a běžně není indikována pooperační farmakologická tromboprofylaxe.
- Skupina se středním rizikem: Většina operačních výkonů. Standardním postupem u této skupiny pacientů je v Evropě podávání nízkomolekulárních heparinů (LMWH) v profylaktické dávce (podle SPC).
- Skupina s vysokým rizikem: a) rozsáhlé operace ortopedické, traumatologické, onkochirurgické, b) operace u pacientů s anamnézou tromboembolické nemoci (TEN). Standardním postupem u této skupiny nemocných je podávání LMWH v profylaktické dávce podle SPC, pokud možno v kombinaci s mechanickými metodami, v řadě případů je farmakologická tromboprofylaxe prodloužená na dobu 4–5 týdnů, možnou alternativou je podávání fondaparinuxu.
Použití LMWH, zejména v prodloužené profylaxi, naráží na několik problémů:
- Nutnost parenterálního podání sice většině pacientů nečiní problém, nicméně představuje určité nepohodlí a u pacientů neschopných naučit se aplikaci může toto být zásadní překážkou, zejména pokud mají špatné rodinné zázemí.
- LMWH jsou nepřímými inhibitory, ke svému účinku potřebují antitrombin; při snížení jeho hladiny je účinnost LMWH nedostatečná.
- Někteří pacienti nemohou aplikovat LMWH z důvodu alergie.
- Zásadní, byť naštěstí nepříliš častý nežádoucí účinek a kontraindikaci LMWH představuje heparinem indukovaná trombocytopenie (HIT).
Warfarin, používaný v protrahované tromboprofylaxi po velkých ortopedických operacích zejména v Severní Americe, má řadu nevýhod – velkou interindividuální variabilitu účinku, nutnost laboratorní monitorace, významné lékové interakce, ovlivnění účinku metabolickými změnami v pooperačním období atd.
Existuje tedy řada důvodů k hledání nových antitrombotik, pokud možno perorálních, se stabilní farmakokinetikou, a tedy bez nutnosti monitorace, s minimem interakcí s léky a potravou, s minimem nežádoucích účinků. Tyto nové léky zasahují dvě stěžejní místa hemokoagulační kaskády – inhibují buď aktivovaný faktor Xa (FXa), nebo trombin. Inhibice je přímá, kompetitivní a jejich účinek je tedy nezávislý na hladině antitrombinu. Jediným u nás dostupným zástupcem perorálních přímých inhibitorů trombinu je dabigatran, představiteli skupiny inhibitorů FXa s ověřenou účinností v klinických studiích III. fáze jsou rivaroxaban a apixaban.
Optimální skupinou pacientů pro testování nových přístupů k profylaxi pooperační TEN jsou pacienti podstupující velké ortopedické operace, protože jde o relativně homogenní skupiny nemocných s vysokým rizikem TEN. Jde především o totální endoprotézu (TEP) kolenního a kyčelního kloubu. První studie II. a III. fáze s antitrombotiky ze skupiny přímých inhibitorů trombinu a FXa byly provedeny právě v této indikaci, studie III. fáze s použitím těchto léků ve všeobecné chirurgii dosud neproběhly. Z toho vyplývá, že tato nová antitrombotika jsou zatím schválena v indikaci profylaxe pooperační TEN pouze u pacientů po TEP kolenního a kyčelního kloubu. Jejich použití u jiných operovaných pacientů přichází v úvahu jen v případech specifické kontraindikace LMWH i fondaparinuxu při respektování všech kontraindikací a zásad režimu podání off-label.
Dabigatran
Jediným u nás dostupným představitelem perorálních přímých inhibitorů trombinu je v současné době dabigatran. Je podáván jako pro-drug dabigatran etexilát, vstřebává se 7,2 % podané látky, poté je esterázami rychle konvertován na účinnou látku dabigatran. Vrcholu plazmatických koncentrací je dosaženo cca za 1,5–2 hod. Cca 30 % látky je navázáno na plazmatické proteiny. Vylučován je dominantně ledvinami, není metabolizován cytochromem P450 [5]. Z toho vyplývají riziko kumulace u pacientů s renální insuficiencí a kontraindikace podání dabigatranu při poklesu glomerulární filtrace (GF) pod 30 ml/min (0,5 ml/s), při GF 30–50 ml//min (0,5–0,83 ml/s) je doporučena redukce dávky. Vzhledem k farmakokinetice nedochází k významným lékovým interakcím s inhibitory nebo induktory cytochromu P450, ale jsou popsány lékové interakce na podkladě inhibice nebo indukce P-glykoproteinu [6].
Léčba inhibitory P-glykoproteinu vede k riziku předávkování dabigatranu. Současná léčba ketokonazolem, itrakonazolem, cyklosporinem a takrolimem je kontraindikována, při současné léčbě amiodaronem nebo verapamilem je doporučena redukce dávky dabigatranu.
Induktory P-glykoproteinu snižují hladinu dabigatranu a tedy i jeho účinnost. K nejvýznamnějším patří rifampicin, karbamazepin, phenytoin a látky obsažené v třezalce tečkované. Pacient léčený rifampicinem, phenytoinem nebo karbamazepinem tedy není vhodný pro léčbu dabigatranem a pacient léčený dabigatranem by neměl pít odvary z třezalky ani užívat žádné výtažky z této byliny.
Ve studii RE-NOVATE [7] byli pacienti podstupující TEP kyčelního kloubu randomizováni k léčbě dabigatranem 220 mg nebo 150 mg 1krát denně nebo enoxaparinem 40 mg denně, účinnost i bezpečnost se statisticky významně nelišily, obdobné výsledky byly dosaženy ve studii RE-MODEL [8] zahrnující pacienty podstupující TEP kolenního kloubu. Ve studii RE-MOBILIZE [9] byly u pacientů po TEP kolenního kloubu tyto dávky dabigatranu porovnány s enoxaparinem v dávkování 2krát denně 30 mg, které je používáno v USA. Toto dávkování enoxaparinu bylo účinnější než 220 a 150 mg dabigatranu. Studie RE-NOVATE II [10] měla podobný protokol jako studie RE-NOVATE, dabigatran byl podáván v jednotné dávce 220 mg denně. Léčba dabigatranem zde vedla ke snížení incidence velké TEN + mortality spojené s TEN.
V profylaxi pooperační trombózy po TEP kolenního nebo kyčelního kloubu je podle SPC dabigatran podáván v dávce 220 mg 1krát denně. 1. dávka (redukovaná na polovinu) by měla být podána 1–4 hod po operaci, pokud nejsou známky abnormálního krvácení. Léčba po TEP kolene by měla trvat 10 dní, po TEP kyčle 28–35 dní. Redukce dávky na 150 mg 1krát denně je doporučena u pacientů starších 75 let, u pacientů s clearance kreatininu 30–50 ml/min (0,5–0,83 ml/s) a u pacientů léčených současně amiodaronem, verapamilem nebo chinidinem.
Při spinální anestezii s traumatickou nebo opakovanou punkcí by neměl být následně dabigatran podán; pokud punkce proběhla nekomplikovaně, neměla by být první dávka dabigatranu podána dříve než 2 hod po vytažení spinálního katetru.
Riziko závažného krvácení není vysoké (1,3 a 1,8 % při dávce 150 a 220 mg denně), nicméně řešení závažného krvácení představuje významný klinický problém, protože zatím neexistuje klinicky ověřené účinné antidotum. V případě velkého krvácení je tedy doporučeno přerušit podávání dabigatranu a vyvinout v první řadě maximální úsilí směřující k lokálnímu stavění krvácení a udržení oběhu, pro převážně renální vylučování dabigatranu je nezbytné udržet dostatečnou diurézu. Další postupy nejsou ověřeny ve studiích, nicméně v laboratorních experimentech se jako účinné jeví podání aktivovaného faktoru VII (NovoSeven), při předávkování dabigatranem na myším modelu intracerebrálního krvácení byl nejúčinnější koncentrát faktorů protrombinového komplexu [11]. Protože dabigatran je jen v omezené míře vázán na bílkoviny, je možno zejména při krvácení provázejícím intoxikaci dabigatranem zkusit hemodialýzu [12].
Rivaroxaban
Rivaroxaban se rychle vstřebává (80–100 % podané dávky), vrcholu plazmatických koncentrací je dosaženo za 2–4 hod po podání. 92–95 % látky je navázáno na plazmatické proteiny, dominantně na albumin. Vylučován je z 1/3 renální cestou, ze 2/3 je metabolizován v játrech cestou cytochromů P450 CYP3A4 a CYP 2J2 a dalšími necytochromálními mechanizmy [13]. K riziku kumulace dochází až při závažné renální insuficienci, kontraindikován je u pacientů s poklesem GF pod 15 ml/min (0,25 ml/s), u pacientů s GF 15–30 ml/min (0,25–0,50 ml/s) je podle SPC doporučena opatrnost.
U pacientů s jaterní insuficiencí provázenou koagulopatií by neměl být rivaroxaban podáván. Vzhledem ke kombinovanému renálnímu vylučování a jaterní biotransformaci je riziko závažných lékových interakcí vedoucích k předávkování rivaroxabanu omezeno na léky inhibující současně CYP3A4 a P-glykoprotein [6]. Pacienti by neměli být léčeni zároveň rivaroxabanem a azolovými antimykotiky (ketokonazol, vorikonazol, itrakonazol) nebo inhibitory proteáz HIV (např. ritonavir).
Při užívání silných induktorů CYP3A4 (rifampicin, phenytoin, karbamazepin, phenobarbital, třezalka) dochází ke snižování hladiny a tedy i účinnosti rivaroxabanu, a je tedy vhodnější zvolit jiné antitrombotikum.
Ve studii Record 1 [14] byli pacienti podstupující TEP kyčelního kloubu randomizováni k léčbě rivaroxabanem 10 mg 1krát denně nebo enoxaparinem 40 mg denně, podávání rivaroxabanu statisticky významně snížilo výskyt všech TEN (definovaných jako TEN + mortalita) i výskyt velké TEN (definované jako proximální žilní trombóza + plicní embolie + mortalita) za cenu statisticky nevýznamného zvýšení výskytu velkého krvácení. Obdobné výsledky byly dosaženy ve studii Record 3 [15] zahrnující pacienty podstupující TEP kolenního kloubu. Ve studii Record 4 [16] byla u pacientů po TEP kolenního kloubu stejná dávka rivaroxabanu porovnána s enoxaparinem v dávkování 2krát denně 30 mg. Rivaroxaban i v tomto porovnání vedl ke statisticky významné redukci rizika všech TEN, výskyt velké TEN byl u pacientů léčených rivaroxabanem statisticky nevýznamně nižší a výskyt velkého krvácení nevýznamně vyšší než u pacientů léčených enoxaparinem.
V profylaxi pooperační trombózy po TEP kolenního nebo kyčelního kloubu je podle SPC rivaroxaban podáván v dávce 10 mg 1krát denně. 1. dávka by měla být podána 6–10 hod po operaci, pokud nejsou známky abnormálního krvácení. Léčba po TEP kolene by měla trvat dva týdny, po TEP kyčle pět týdnů. Dávka je jednotná nezávisle na věku nebo poklesu renálních funkcí, nicméně, při poklesu GF pod 15 ml/min (0,25 ml/s) je léčba rivaroxabanem kontraindikovaná.
Při spinální anestezii s traumatickou nebo opakovanou punkcí by neměl být následně rivaroxaban podán dříve než po 24 hod. Pokud punkce proběhla nekomplikovaně a katetr je ponechán, měl by být vytažen nejdříve za 18 hod od poslední dávky rivaroxabanu a následující podání rivaroxabanu by mělo následovat nejméně 6 hod po vytažení spinálního katetru.
Riziko velkého nebo klinicky relevantního krvácení není vysoké (3,1 %), nicméně řešení závažného krvácení představuje významný klinický problém, protože zatím není k dispozici klinicky ověřené účinné antidotum. V případě velkého krvácení je tedy doporučeno přerušit podávání rivaroxabanu a vyvinout maximální úsilí směřující k lokálnímu stavění krvácení a udržení krevního oběhu. Další postupy nejsou ověřeny ve studiích, nicméně v laboratorních experimentech se jako částečně účinné léky jeví aktivovaný faktoru VII (NovoSeven) a koncentrát faktorů protrombinového komplexu [17]. Protože rivaroxaban je významně vázán na plazmatické bílkoviny, nelze očekávat efekt hemodialýzy a lze jen spekulovat o event. použití plazmaferézy nebo hemoperfuze, zejména při krvácení u pacienta s intoxikací rivaroxabanem.
Apixaban
Po podání se rychle vstřebává cca 50 % podané látky [18], vrcholu plazmatické hladiny je dosaženo za 3–4 hod. Na plazmatické bílkoviny se váže cca v 87 %. 27 % podané látky se vylučuje ledvinami, zbytek je zčásti biotransformován různými cestami, dominantně cytochromem P450 3A4 a vylučován zčásti do žluči, zčásti přímo do střeva.
Riziko kumulace při těžké renální insuficienci a kontraindikace při poklesu GF pod 15 ml/min nebo při jaterním onemocnění s koagulopatií jsou podobné jako u rivaroxabanu, stejně tak riziko lékových interakcí s induktory a inhibitory ovlivňujícími P-glykoprotein a CyP 3A4.
Ve studii ADVANCE-2 [19] byli pacienti podstupující jednostrannou nebo oboustrannou TEP kolenního kloubu randomizováni buď k léčbě apixabanem 2,5 mg 2krát denně, nebo enoxaparinem 40 mg 1krát denně. Léčba apixabanem vedla k významnému snížení výskytu primární události (asymptomatická nebo symptomatická žilní trombóza, nefatální plicní embolie nebo úmrtí) z 24 % na 15 %. Výskyt velkého nebo klinicky relevantního krvácení se nelišil.
Studie ADVANCE-3 [20] byla koncipována podobně jako ADVANCE-2, týkala se pacientů po TEP kyčelního kloubu. Léčba Apixabanem v této studii vedla k redukci výskytu primární události z 3,0 % na 1,9 %, přičemž výskyt velkého nebo klinicky relevantního krvácení byl obdobný (5 % vs 4,8 %).
V profylaxi TEN po TEP kyčelního nebo kolenního kloubu je apixaban podáván v dávce 2,5 mg 2krát denně, 1. dávka by měla být podána 12–24 hod po operaci. Léčba po TEP kolene by měla trvat 10–14 dní, po TEP kyčle 32–38 dní. Dávka je jednotná nezávisle na věku, hmotnosti nebo poklesu renálních funkcí, nicméně, při poklesu GF pod 15 ml/min (0,25 ml/s) je léčba apixabanem kontraindikovaná.
V případě spinální anestezie by měl být apixaban podán nejdříve za 5 hod od vytažení katetru. Spinální anestezie s opakovanou nebo traumatickou punkcí zvyšuje riziko krvácení. Neexistují sice speciální doporučení pro podání apixabanu v těchto případech, nicméně opatrnost je na místě a odložení podání první dávky na dobu nejméně 24 hod od této punkce je odůvodněné.
Výskyt velkého krvácení u pacienta léčeného Apixabanem může představovat obdobný problém jako při léčbě dabigatranem nebo rivaroxabanem, protože zatím není dostupné účinné antidotum.
V případě velkého krvácení je tedy doporučeno přerušit podávání apixabanu a vyvinout maximální úsilí směřující k lokálnímu stavění krvácení a udržení krevního oběhu. I když dosud chybí validní, byť experimentální data, je podle SPC doporučeno u jinak nezastavitelného velkého krvácení u pacienta léčeného apixabanem podat aktivovaný faktor VII (NovoSeven).
Závěr
Nová antitrombotika představují významný přínos pro profylaxi TEN u pacientů po TEP kolenního a kyčelního kloubu a jsou nyní nově zaváděna v dalších indikacích (fibrilace síní, léčba tromboembolické nemoci). Oproti LMWH a warfarinu je jejich podávání jednodušší, nicméně je důležité znát a respektovat kontraindikace a lékové interakce, protože případné předávkování může být u konkrétního pacienta obtížně řešitelné. Další rozšiřování spektra používaných antitrombotik nám umožní lépe individualizovat léčbu podle komorbidit, ostatních užívaných léků a nakonec i preferencí pacienta.
Doručeno do redakce 20. 2. 2012
Přijato po recenzi 15. 3. 2012
prim. MUDr. Petr Kessler
Odd. hematologie a transfuziologie
Nemocnice Pelhřimov, p.o.
pkessler@hospital-pe.cz
Zdroje
1. Spahn DR, Rossaint R. Coagulopathy and blood component transfusion in trauma. Br J Anaesth 2005; 95 : 130–139.
2. Paparella D, Brister SJ, Buchanan MR. Coagulation disorders of cardiopulmonary bypass: a review. Intensive Care Med 2004; 30 : 1873–1881.
3. Grant PJ, Tate GM, Davies JA et al. Intra-operative activation of coagulation – a stimulus to thrombosis mediated by vasopressin? Thromb Haemost 1986; 55 : 104–107.
4. Geerts WH, Bergqvist D, Pineo GF et al. American College of Chest Physicians. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133 (6 Suppl): 381S–453S.
5. Stangier J, Rathgen K, Stähle H et al. The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy male subjects. Br J Clin Pharmacol 2007; 64 : 292–303.
6. Walenga JM, Adiguzel C. Drug and dietary interactions of the new and emerging oral anticoagulants. Int J Clin Pract 2010; 64 : 956–967.
7. Eriksson BI, Dahl OE, Rosencher N et al. RE-NOVATE Study Group. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomised, double-blind, non-inferiority trial. Lancet 2007; 370 : 949–956.
8. Eriksson BI, Dahl OE, Rosencher N et al. Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial. J Thromb Haemost 2007; 5 : 2178–2185.
9. RE-MOBILIZE Writing Committee, Ginsberg JS, Davidson BL, Comp PC et al. Oral thrombin inhibitor dabigatran etexilate vs North American enoxaparin regimen for prevention of venous thromboembolism after knee arthroplasty surgery. J Arthroplasty 2009; 24 : 1–9.
10. Eriksson BI, Dahl OE, Huo MH et al. Oral dabigatran versus enoxaparin for thromboprophylaxis after primary total hip arthroplasty (RE-NOVATE II*). A randomised, double-blind, non-inferiority trial. Thromb Haemost 2011; 105 : 721–729.
11. Zhou W, Schwarting S, Illanes S et al. Hemostatic therapy in experimental intracerebral hemorrhage associated with the direct thrombin inhibitor dabigatran. Stroke 2011; 42 : 3594–3599.
12. Ganetsky M, Babu KM, Salhanick SD et al. Dabigatran: review of pharmacology and management of bleeding complications of this novel oral anticoagulant. J Med Toxicol 2011; 7 : 281–287.
13. Weinz C, Schwartz T, Pleiss U et al. Metabolism and distribution of [14C] BAY 59–7939 – an oral, direct Factor Xa inhibitor – in rat, dog and human. Drug Metab Rev 2004; 36: Abstract 196.
14. Eriksson BI, Borris LC, Friedman RJ et al. RECORD1 Study. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358 : 2765–2775.
15. Lassen MR, Ageno W, Borris LC et al. RECORD3 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008; 358 : 2776–2786.
16. Turpie AG, Lassen MR, Davidson BL, et al. RECORD4 Investigators. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD4): a randomised trial. Lancet 2009; 373 : 1673–1680.
17. Godier A, Miclot A, Le Bonniec B et al. Evaluation of prothrombin complex concentrate and recombinant activated factor VII to reverse rivaroxaban in a rabbit model. Anesthesiology 2012; 116 : 94–102.
18. He K, Luettgen JM, Zhang D et al. Preclinical pharmacokinetics and pharmacodynamics of apixaban, a potent and selective factor Xa inhibitor. Eur J Drug Metab Pharmacokinet 2011; 36 : 129–139.
19. Lassen MR, Raskob GE, Gallus A et al. Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double--blind trial. Lancet 2010; 375 : 807–815.
20. Lassen MR, Gallus A, Raskob GE et al. ADVANCE-3 Investigators. Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. N Engl J Med 2010; 363 : 2487–2498.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2012 Číslo 2
-
Všechny články tohoto čísla
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Vorapaxar v klinických studiích
- Čo je vernakalant a kde je jeho miesto v klinickej praxi?
- Eprosartan – duální blokátor AT1 receptorů
- Polypragmazie a oběhové selhání při maligních komorových arytmiích s postižením jaterních funkcí
- Pacientka po transplantaci srdce s plicní formou invazivní aspergilózy
- Galerie autorů
- Máme dnes k dispozici lepší antitrombotika?
- Antiagregační a antikoagulační léčba – základní principy
- Perorální protidestičková léčba u pacientů s akutním koronárním syndromem
- Současné doporučení k antiagregační léčbě v neurologii
- Antikoagulační terapie a fibrilace síní
- Nová perorální antitrombotika v prevenci a léčbě trombembolizmu
- Nová antitrombotika v prevenci pooperační tromboembolické nemoci
- Současné možnosti monitorování antitrombotické léčby – nová antitrombotika
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Antiagregační a antikoagulační léčba – základní principy
- Antikoagulační terapie a fibrilace síní
- Kam se ubírá současný vývoj léků ovlivňujících krevní srážení?
- Současné doporučení k antiagregační léčbě v neurologii
