Současné možnosti antiagregační léčby u nemocných s diabetem v prevenci komplikací aterosklerózy
Current options for anti-aggregation treatment for the prevention of atherosclerotic complications in diabetic patients
Type II diabetes mellitus (DM) has become one of the major health issues in developed countries. Anti-aggregation treatment forms integral part of pharmacological measures to improve the prognosis of diabetic patients and to postpone the manifestation of macrovascular complications in the first place. Platelet activity has a number of specific pathophysiological features in diabetic patients, and treatment affecting the formation of a white platelet thrombus is of utmost importance for these patients. Current knowledge of the effect of anti-aggregation treatment draws solely on analysis of subgroups of diabetic patients within large clinical studies. The principal problem of current anti-aggregation treatment of diabetic patients is its low efficiency providing protection against acute vascular events to a minor percentage of patients only.
Keywords:
diabetes mellitus – thrombogenesis – ACE inhibitors – beta-blockers – statins – anti-aggregation treatment – thienopyridines
Autoři:
J. Špác
Vyšlo v časopise:
Kardiol Rev Int Med 2006, 8(3): 105-111
Kategorie:
Redakční článek
Souhrn
V rozvinutých zemích se stává diabetes mellitus 2. typu jedním z hlavních zdravotních problémů. Antiagregační léčba je u diabetiků integrální součástí farmakologických opatření s cílem příznivě ovlivnit prognózu nemocných a oddálit projevy hlavně makrovaskulárních komplikací. Aktivita destiček má u diabetiků řadu patofyziologických zvláštností a proto léčba ovlivňující tvorbu bílého destičkového trombu je u diabetiků nesmírně důležitá. Naše znalosti o účinnosti antiagregační léčby jsou získány jen analýzou podskupin nemocných s diabetem u velkých klinických studií. Hlavním problémem současné antiagregační léčby u diabetiků je stále nedostatečná účinnost chránící jen relativně menší část nemocných před vznikem akutní cévní příhody.
Klíčová slova:
diabetes mellitus – trombogeneze - ACE-inhibitory – betablokátory – statiny - antiagregační léčba - thienopyridiny
Úvod
V rozvinutých zemích se stává diabetes mellitus 2. typu (DM2T) jedním z hlavních zdravotních problémů. Očekávané zvýšení jde na vrub zvýšení výskytu DM2T, které tvoří 90-95 % všech případů. Přibližně 75 % všech nemocných s diabetes mellitus (DM) umírá v důsledku kardiovaskulárních příhod z toho 50 % na ischemickou chorobu srdeční (ICHS) a 15 % na cévní mozkové příhody. Porucha glukózového metabolizmu je velmi častá u nemocných s akutními koronárními syndromy, což bylo potvrzeno v nedávné době v analýze Euro Heart Survey on Diabetes and the Heart, která ukázala, že pouze menší část nemocných (asi 32 %) s akutními koronárními syndromy nemá poruchu metabolizmu cukrů a počet nemocných s diabetem v sekundární prevenci ICHS narůstá [6]. Také cévní mozkové příhody jsou u diabetiků 3-5krát častější než u nediabetiků a ischemická choroba dolních končetin je asi 10krát častější než u nediabetické populace. Základem farmakologické léčby ovlivňující prognózu těchto nemocných je správná léčba inzulinové rezistence a hyperglykemie a použití ACE-inhibitorů, betablokátorů, statinů a antiagregační léčby. Aktivita destiček má u diabetiků řadu patofyziologických zvláštností a proto léčba ovlivňující tvorbu bílého destičkového trombu je u diabetiků nesmírně důležitá.
Patofyziologické zvláštnosti trombogeneze u diabetiků
U diabetiků dochází k rychlejší tvorbě destičkového trombu, zvláště při nedostatečné kompenzaci diabetu [36]. Na nepříznivé patogenezi aterotrombózy se u diabetiků podílejí lokální i systémové faktory, endoteliální dysfunkce a nepříznivé složení trombu vedoucí k jeho vulnerabilitě (schéma 1). Složení trombů diabetiků ukazuje na měkké lipidové tromby s vysokým obsahem makrofágů s expresí metaloproteináz a silnou lokální zánětlivou složkou v adventicii a neovaskularizací v oblasti aterosklerotického plátu. Neovaskularizace vede často ke krvácení do plátů a koreluje s výskytem zánětlivé reakce [29]. Koronární tepny u diabetiků podléhají ve větší míře než u nediabetiků také tzv. negativní remodelaci, která způsobuje extrémní zužování jejich lumen [23].

Změny trombocytů
Funkční vlastnosti trombocytu jsou u diabetiků patologicky změněny. Nemocní s diabetes mellitus mají krevní destičky s větším objemem než nediabetici. Střední objem destiček je ukazatelem aktivace destiček, které jsou nadměrně citlivé k účinku agregačních látek. Intracelulární hladina glykemie odráží sérovou hladinu a je spojena s tvorbou superoxidových aniontů O2, sníženou dostupností kysličníku dusnatého NO a poruchou kalciového metabolizmu destiček (schéma 2). Trombocyty cirkulují v aktivovaném stavu v důsledku zvýšené tvorby metabolických produktů kyseliny arachidonové, které se uvolňují z destičkové membrány s následnou nadměrnou tvorbou prostaglandinu F2α (PGF22α) s prozánětlivými účinky a tromboxanu A se silnými agregačními a vazokonstrikčními účinky [21]. U diabetiků se často vyskytuje silná zánětlivá aktivita spojená s nadprodukcí prozánětlivých prostaglandinů a může vést k produkci TXA2 mimo trombocyty s rezistenci na aspirin. Vylučování TXA2 se zvyšuje při hyperglykemii a snižuje při dobré metabolické kompenzaci [7,11]. Při tom dochází u nemocných s DM ke zvýšené oxidaci lipidů a dlouhodobé aktivaci destiček [12]. Je také zvýšená novotvorba destiček. Podobně i trombocyty nemocných s DM2T vykazují zvýšenou agregabilitu prostřednictvím látek nezávislých na prostaglandinech – hlavně prostřednictvím ADP-receptorů a mají zvýšené množství IIb/IIIa-receptorů [35]. Zvýšené množství receptorů IIb/IIIa a zvýšené množství fibrinogenu vedou ke snadnější agregabilitě.

U diabetiků je také vyšší adhezivita monocytů k endotelu a objevuje se narušení adhezivity endotelií k extracelulární matrix [1]. Hyperinzulinemie zvyšuje produkce adhezivních molekul jako VCAM-I. Při hyperglykemii se zvyšuje agregabilita destiček vyvolaná smykovým třením [18]. U diabetiků je v důsledku těchto změn zvýšen výskyt aspirinové a klopidogrelové rezistence, zvláště u nemocných s inzulinovou rezistencí [24].
Systémové a lokální protrombogenní faktory
DM2T s inzulinorezistencí a hyperglykemií je spojen s přítomností prokoagulačního stavu podmíněného zvýšenými hladinami jak systémových, tak i lokálních faktorů (schéma 2).
Ze systémových faktorů se jedná o zvýšení hladin fibrinogenu, von Willenbrandtova faktoru, dále o aktivitu trombinu a faktoru VII, vedoucí k vyšší viskozitě krve (schéma 1). Současně se snižuje aktivita antitrombinu III a proteinu C se současnou nadměrnou produkcí řady lokálních i systémových zánětlivých cytokinů, které se mohou podílet i na vzniku inzulinové rezistence. Z lokálních faktorů je popsána nadměrná produkce zánětlivých cytokinů produkovaných specifickými T-buňkami v důsledku stimulace antigeny makrofágů, vlivem hyperglykemie se zvyšuje TF (tkáňový faktor), jehož aktivace představuje základní prvek při arteriální trombóze. U diabetiků byla popsána zvýšená aktivita řady parametrů zánětlivé aktivity ve srovnání s nediabetickou populací, jako hladina C-reaktivního proteinu hodnoceného vysoce citlivou reakcí (hsCRP), cytokiny, tumor-nekrotizujícího faktoru (TNF), interleukinu (IL) 6, monocytárního proteinu (MCP) 1, rozpustného CD40 ligandu (sCD40L), a metaloproteinázy (MMP), jejich zvýšení odráží vyšší aktivitu onemocnění spojenou s horší prognózou (schéma 3) [8]. Tuková tkáň u obézních osob způsobuje k nadměrnou produkci TNF. Hladina hsCRP může být u diabetiků použita ke stratifikaci rizika vzniku ICHS [27]

Fibrinolytická aktivita je u diabetiků často podstatně snížena hlavně v důsledku působení inhibitorů aktivátoru plazminogenu (PAI-1) a inhibitoru fibrinolýzy aktivovaný trombinem (TAFI – trombin activatable fibrinolysis inhibitor) na fibrinolýzu [5]. Vysoké hladiny PAI-1 a TAFI, které jsou v diabetické populaci často nalézány, mají za následek snížení fibrinolytické aktivity, což usnadňuje formaci trombu a je spojeno s vyšším rizikem ischemické choroby srdeční [31,26]. PAI-1, který má hlavní podíl na inhibici fibrinolýzy, je syntetizován v řadě tkání, ale nejvíce v tukové tkáni, takže je přímý vztah mezi obezitou a hladinou PAI-1. Zvýšená hodnota PAI-1 předpovídá vznik diabetu [15]. Asi 90 % PAI-1 je přenášeno v destičkách. Zdá se, že nejdůležitějším faktorem stimulující syntézu PAI-1 u diabetiků je hyperglykemie a hyperinzulinemie. TAFI, který se podílí menší měrou na porušené fibrinolýze, odstraňuje zbytky argininu a lyzinu z fibrinu, a tak zabraňuje vazbě plazminogenu na povrchu fibrinu a snižuje tvorbu plazminu [38]. Na rozdíl od PAI-1 je syntetizován v jaterní tkáni. Porušený metabolizmus tuků se podílí na zvýšení hladin obou působků. VLDL a hladiny triacylglycerolů významně korelují s plazmatickou hladinou PAI – 1 a hladiny LDL s sérovou hladinou TAFI. Mezi plazmatickou hladinou TAFI a hsCRP existuje u diabetiků přímá úměra, což naznačuje souvislost mezi protrombogenní a prozánětlivou situací u diabetiků.
Také hypertriglyceridemie ovlivňuje některé koagulační faktory, především faktor VII. Pacienti s vyšší koncentrací endogenních lipoproteinových částic mají prokázanou souvislost s vyšší koncentrací inhibitoru aktivátoru plazminogenu typu 1 (PAI-1). Hypertriglyceridemie je dále spojena s poruchami fibrinolýzy. To vše nahrává prokoagulačním a protrombotickým stavům. Snížení hladin lipidů statiny vede k menší kolagenem navozené destičkové agregaci a k poklesu hladin von Willenbrandtova faktoru (vWf).
Významnou roli v navození prokoagulačního stavu má aktivace systému renin-angiotenzin přispívající ke zvýšení hladin PAI-1.
Terapeutické ovlivnění hladin VLDL a normalizace hyperglykemie bez současného zvýšení hladin inzulinu (tj. zlepšením periferní inzulinové rezistence) se zdají být možnými přístupy k ovlivnění hladin PAI – 1 a zlepšení funkce fibrinolytického systému u diabetiků. V řadě prací se proto zkoušel vliv fibrátů na hladiny PAI-1 v plazmě s diskrepantními výsledky a zdá se, že hladinu PAI – 1 neovlivňují ani glitazony [33].

Současný stav antiagregační terapie u nemocných s ICHS a DM
I přes vysoké kardiovaskulární riziko u diabetiků, klinickými studiemi ověřené důkazy o příznivém vlivu antiagregační nebo antikoagulační léčby u diabetiků nejen v primární prevenci, ale i v řadě klinických situací v sekundární prevenci stále chybí. Naše současné znalosti jsou podloženy jen metaanalýzami studií nebo analýzou podskupin diabetiků, kteří tvořili jen část účastníků velkých primárně preventivních klinických studií (ve studii PPP bylo 17 % diabetiků, v ostatních studiích procento diabetiků kolísalo od 2 do 8 % - HOT 8 %, PHS 2 %; BMD 2 %; TPT 2 %). Hodnocení podskupin v klinických studiích nebo znalosti založené na metaanalýzách vždy svádějí k pochybnostem a jejich interpretace může být často ošidná a někdy i rozporuplná, zvláště když jsou podskupiny diabetiků většinou starší, polymorbidnější, mají postiženy periferní arterie s difuzním typem poškození ve srovnání s nediabetiky.
Z experimentálních poznatků a menších klinických studií vyplývá, že zlepšení kardiovaskulární prognózy diabetiků je možno docílit jen intenzivní antiagregační a léčbou a odstraněním podmínek vyvolávající protrombogenní a proaterogenní stav, tj. co nejlepší úpravou hyperglykemie včetně postprandiálních hodnot a zlepšením inzulinové rezistence a lipidového profilu [29]. Samotná léčba hyperglykemie nevede k snížení výskytu komplikací vyplývající z makrovaskulárního postižení. Nadějnou lékovou skupinou se zdají být glitazony, které ovlivňují působením na cAMP a fosfoinositid příznivým způsobem agregaci destiček mechanizmem, který je nezávislým na PPARγ. Destičky jsou bezjaderné buňky, a tedy nemají PPARγ-receptory, ale PPARγ-receptory jsou velmi četně zastoupeny v endotelu cév, hladkých svalových buňkách a makrofázích, kde ovlivňují expresi genů pro řadu zánětlivých působků podílejících se na vývoji ateromatózních plátů a destabilizaci endotelu [37]. Výsledky studie PROACTIV u 5 238 diabetiků s makrovaskulárními komplikacemi léčených 3 roky glitazony přidanými k optimální terapii ukázaly pokles výskytu úmrtí, IM nebo cévní mozkové příhody o 16 % a u podskupiny osob s prodělaným IM se snížilo riziko výskytu druhého IM o 28 %. Ukazuje se, že není jedno, kterým přípravkem a jakým způsobem léčíme hyperglykemii [14]. Klinická studie BARI II bude u 2 600 diabetiků s ICHS při léčbě CABG, PCI a intenzivní farmakologické léčbě testovat použití inzulinové léčby oproti léčbě glitazony při stejném stupni metabolické kompenzace na kardiovaskulární komplikace.
Hlavním problémem současné antiagregační léčby je stále nedostatečná účinnost chránící jen relativně menší část nemocných před vznikem akutní cévní příhody. Doposud používané protidestičkové léky blokující tromboxanovou cestu, ADP-receptory a zvyšující cAMP v destičkách (tab. 2) ponechávají mnoho alternativních cest tvorby trombu neovlivněny a nepostihují hlavní klíčové mechanizmy odpovědné za trombózu.
Při posuzováni účinnosti dlouhodobé chronické antiagregační léčby je problémem výběr nemocných, kterým bude agresivní antiagregační léčba přinášet prospěch. Dosavadní kritéria našeho výběru jsou zatím velmi hrubá a orientační, protože antiagregační léčba je vedena zatím „naslepo“ a o její účinnosti se většinou nepřesvědčujeme. Nevíme, jak antiagregační látka u jednotlivého nemocného blokuje schopnost agregace a zda je dávka používaná u nemocného odpovídající a chrání jej optimálně před vznikem arteriální trombózy. Antiagregační léčbu a její dávkování neumíme dosud dobře individuálně řídit ani z hlediska rizik vedlejších účinků ani z hlediska rizika vzniku trombózy (u kterých nemocných použít vyšší dávku a u kterých nemocných stačí nízká dávka). Možná se ukáže, že monitorace antiagregační léčby, zvláště u velmi rizikových nemocných (např. u diabetiků po intervenčních intravaskulárních zákrocích) může zlepšit výsledky antiagregační léčby.
Ideální antiagregační lék by měl mít spolehlivý účinek, tj. měl by zabraňovat tvorbě trombu již v počátečních fázích a měl by tlumit větší množství aktivačních cest trombocytu s minimem nežádoucích účinků, jednoduchým schématem podávání, rychlým nástupem, delším trváním účinku s možností snadného ukončení léčby (např. před operačním zákrokem) bez vyvolání „rebound fenoménu“. U diabetiků by měla mít tato látka i schopnost tlumit uvolňování zánětlivých cytokinů. V současné době žádný takový přípravek nemáme, a proto se snažíme používat hlavně kombinační terapii menších dávek (vyvolávají menší vedlejší účinky) dvou různými mechanizmy působícími přípravky.
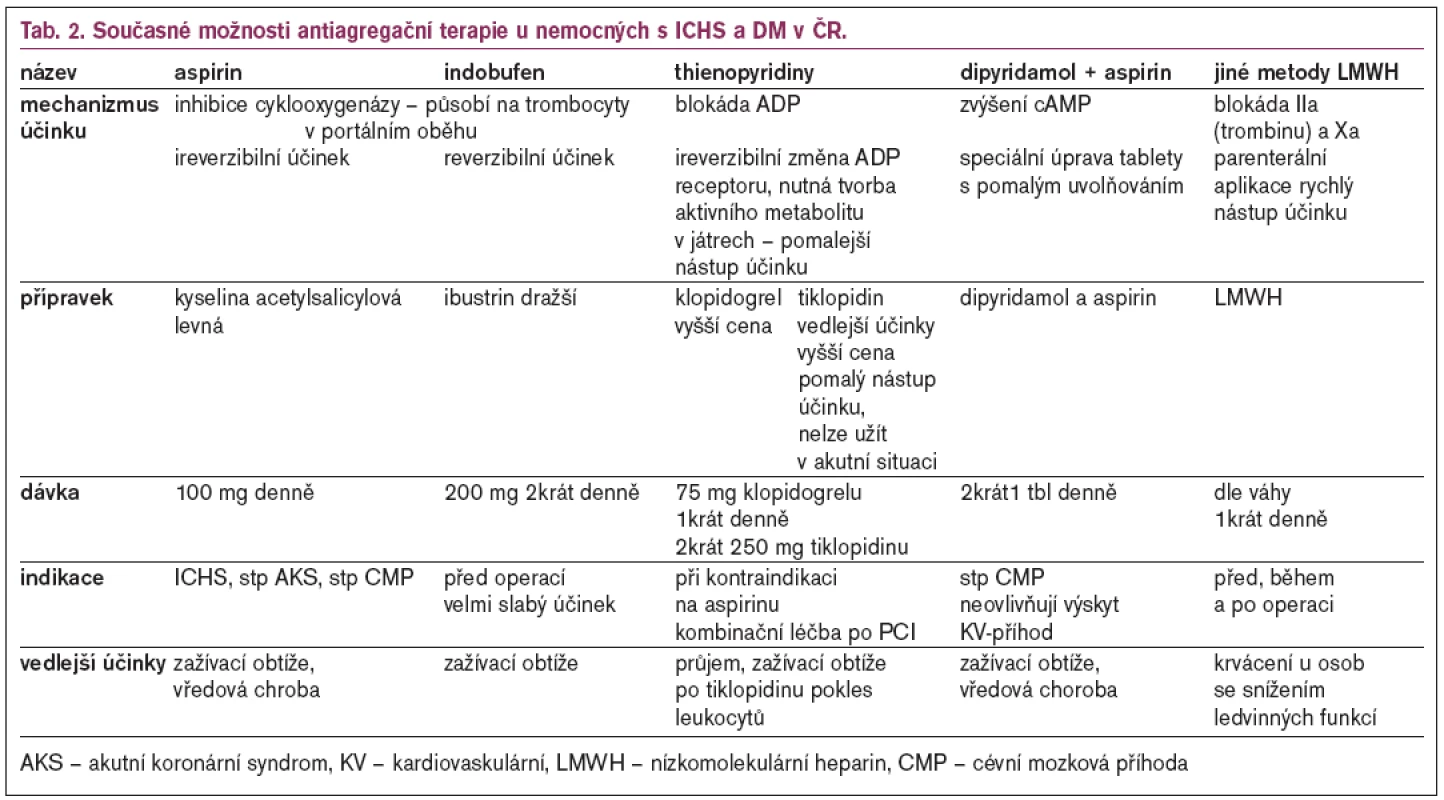
Látky ovlivňující tvorbu tromboxanu u diabetiků
Nejužívanější je ireverzibilní inhibice cykloxygenázy (COX) – nejčastěji kyselinou acetylsalicylovou (ASA - acetylsalicylic acid) ostatní možnosti ovlivnění COX jsou používány méně nebo jen experimentálně. Při srovnání výsledků léčby pomocí ASA u diabetiků ve srovnání s nediabetickou populací dostáváme rozporuplné výsledky týkající se účinnosti antiagregační léčby.
US Physician Health Study byla primárně preventivní studie a zahrnovala nemocné s diabetem, kteří byli léčeni poměrně vyšší dávkou aspirinu 325 mg obden nebo placebem. V celé studii byl pokles relativního rizika 44% a v podskupině diabetiků byl pokles relativního rizika při léčbě aspirinem 39% (absolutní snížení rizika infarktu myokardu z 10,1 na 4 %) [16].
V metaanalýze provedené skupino ACG (Antiplatelet Collaboration Group) bylo zahrnuto 140 studií zkoumajících protidestičkovou léčbu, v nichž bylo 47 000 nemocných, z toho 10 % diabetiků. Výsledky metaanalýzy prokázaly významný přínos terapie pomocí ASA u diabetiků. Incidence kardiovaskulární mortality, IM a cévní mozkové příhody byla 18,5% u nemocných léčených ASA oproti 22,3% u těch, kteří dostávali placebo. Snížení relativního rizika bylo u diabetiků jen 7%, zatímco u nediabetiků bylo snížení rizika podstatně významnější a dosahovalo 22 % [4]. Ve skupině léčené ASA nebyl zaznamenán vyšší počet krvácivých komplikací. Léčba pomocí ASA zabránila u 4/5 rizikových nemocných vzniku závažné trombotické příhody, ale z opačného pohledu měl v průběhu 2leté léčby 1 z 8 léčených vážnou cévní příhodu.
Existuje jediná studie provedená jen u diabetiků – studie ETDRS (Early Treatment Diabetic Retinopathy Study), která ukázala statisticky signifikantní redukci relativního rizika vzniku IM u diabetiků užívajících ASA o 9 % [42]. Studie nebyla přísně vzato primárně preventivní, protože 48 % zúčastněných nemocných mělo anamnézu kardiovaskulárního onemocnění a používalo se neobvykle vysoké dávky aspirinu – 650 mg denně.
Pozitivní výsledky studií s aspirinem u diabetiků tvořily základ pro Doporučení americké diabetologické společnosti v r. 1997, které doporučují nízké dávky aspirinu 81-325 mg jako hlavní strategii v prevenci cévních příhod u všech diabetiků s vysokým kardiovaskulárním rizikem [2]. Praktická aplikace tohoto doporučení je všeobecně relativně nízká – např. v r. 2001 užívalo v USA jen 13 % diabetiků s jedním významným kardiovaskulárním rizikovým faktorem aspirin, v roce 2004 pak užívalo v Kanadě jen 25 % diabetiků antiagregační léčbu a 5 % diabetiků užívalo kombinaci ACE-inhibitorů, statinů a antiagregační léčby; v České republice bylo v roce 2000 léčeno antiagregační léčbou před vznikem AKS jen 40 % diabetiků [40].
Menší účinnost antiagregační léčby u diabetiků potom potvrdily výsledky studie PPP, která při použití dávky 100 mg aspirinu denně i přes nedostatky v metodice ukázala, že u diabetiků léčených nízkou dávkou aspirinu se snižuje relativní riziko kardiovaskulární příhody o 10 % ve srovnání s nemocnými bez diabetu, u nichž bylo toto snížení statisticky významné - 41 % [34].
Oproti tomu ve studii Bezafibrat Infarction Prevention Study (BIPS) byl u nemocných s anamnézou ICHS absolutní zisk léčby aspirinem větší u diabetiků než u nediabetiků – snížení kardiovaskulární mortality o 5 % oproti 2,1 % u nediabetiků a celkové mortality 7,8 % oproti 4,1 % [20].
Současné poznatky, založené na výsledcích několika studií, hovoří pro zahájení antiagregační terapie aspirinem u nemocných s DM a větším množstvím rizikových faktorů ICHS. Není zatím prokázáno žádnými studiemi, že by podávání ASA u asymptomatických osob bez rizikového profilu přinášelo jednoznačný prospěch. Přes jednoznačné důkazy o příznivém, byť limitovaném, účinku léčby aspirinem u diabetiků a údajů o potřebě zvýšit počet léčených rizikových pacientů zůstává aspirin u diabetiků suboptimálním antitrombotickým lékem. Bylo by laciným optimizmem očekávat, že samotný aspirin blokádou jednoho z mechanizmů působícím trombózu může zabránit vzniku cévních příhod u nemocných s DM.
Jaká má být dávka ASA u diabetiků ? Má být dávkovací schéma u diabetiků stejné jako u nemocných bez diabetes mellitus? Neměli by užívat nemocní s DM a současnými dalšími riziky ICHS vyšší dávky aspirinu než 100 mg ? Všechny tyto otázky jsou zatím nezodpovězené a pro odpověď na ně nemáme ověřená klinická data. V současné době také probíhají jen menší studie zaměřené na problematiku antiagregační léčby u diabetu, např. studie POPADAD (Prevention of Progression of Asymptomatic Diabetic Arterial Disease) srovnávající léčbu aspirinem oproti placebu u 1200 diabetiků bez ICHS (ale se snížením indexem paže-kotník), nicméně tyto projekty mají malý počet nemocných, aby odpověděli na obecné otázky účinnosti a bezpečnosti dlouhodobé antiagregační léčby u DM z hlediska medicíny založené na důkazech.
U diabetiků bylo popisováno při používání vysokých dávek aspirinu zlepšení fibrinolytických schopností – vysoké dávky aspirinu blokují uvolňování PAI-1 z trombocytárních granulí do oběhu, ale při vyšších dávkách aspirinu než 150 mg narůstá výskyt vedlejších účinků, hlavně krvácení z GIT a mozkových krvácení, které jsou závislé na dávce. Výskyt vedlejších krvácivých a jiných komplikací omezuje použití antiagregačních látek u řady rizikových nemocných zvláště při zvyšování dávek. Problémem je i u DM častá přítomností retence dusíkatých látek. Je známo, že aspirin zvyšuje výskyt krvácení u nemocných s poškozenou funkcí ledvin a zvyšuje pravděpodobnost krvácení z GIT. Aspirin také může u nemocných s nefropatií zvláště při použití vyšších dávek zhoršovat renální funkce negativním ovlivněním produkce renálních prostaglandinů.
U nemocných s DM mohou být výskyt rezistence k aspirinu hojnější, protože trombocyty diabetiků mohou být aktivovány řadou rozličných mechanizmů, které vedou i přes léčbu aspirinem k opakovaným trombotickým příhodám. Pojem aspirinové rezistence se používá k vyjádření klinické neúčinnosti léčby anebo k vyjádření neúčinné laboratorně měřené inhibice aktivace a agregace destiček po podání aspirinu. V klinických studiích se popisuje v závislosti na metodě stanovení široká variabilita výskytu aspirinové rezistence od 5-40 % a výskyt u diabetiků je vyšší, někdy až 2násobný než v nediabetické populaci [3,41,10]. Zdá se, že výskyt aspirinové rezistence se zvyšuje s nízkou dávkou aspirinu. Příčin této nižší účinnosti u diabetiků může být několik:
Aktivace destiček může probíhat různými mechanizmy nezávisle na blokování účinku prostaglandinů – prekurzory tromboxanu mohou být uvolňovány poškozeným endotelem a aktivovanými makrofágy v důsledku zvýšené chronické zánětlivé stimulace u diabetiků [19].
Zvýšená aktivita zánětlivých parametrů a adhezivních molekul u diabetiků .
Nižší míra odezvy na léčbu ASA často souvisí s hypercholesterolemií nemocného [17], přitom dyslipidemie se vyskytuje u více než 30 % nemocných s DM.Nižší účinnost antiagregační léčby byla popsána i u nemocných se zvýšeným cholesterolem ve studiích PHS (Physicians’ Health Study) [39].
Menší účinnost antiagregační léčby u osob s hodnotami TKs >145mm Hg [28].
Existují a klinicky jsou testovány nové deriváty blokující tromboxanovou cestu, jako např. picotamid, který má duální účinek na blokování tromboxanového systému – blokuje syntézu tromboxanu A2 a blokuje receptory pro TXA2 a endoperoxid H2. Picotamid u 1 209 nemocných s diabetem prokázal větší účinnost na mortalitu než terapie aspirinem [25].
Thienopyridiny
Thienopyridinové preparáty jsou považovány za alternativu k antiagregační léčbě aspirinem při některých kontraindikacích aspirinu a v kombinační léčbě s aspirinem jsou využívány k zesílení antiagregačního účinku v některých klinických situacích spojených s vysokým rizikem trombotických komplikací.
Zásadní studií, která etablovala postavení klopidogrelu v sekundární prevenci, byla studie CAPRIE. V této studii byl porovnáván klopidogrel (75 mg denně) oproti relativně vyšší dávce aspirinu (325 mg denně) v souboru téměř 20 000 nemocných s vyjádřenou aterosklerózou.Studie prokázala, že klopidogrel snižuje oproti ASA relativní riziko iktu, infarktu myokardu a smrti z cévních příčino 8,7 %. Následná subanalýzy skupiny 3 866 diabetiků ukázaly, že přínos klopidogrelu je výraznější u diabetiků. U nediabetiků došlo ke snížení rizika z 12,7 % na 11,8 %, u diabetiků bylo snížení rizika ještě větší - ze 17,7 % na 15,6 % odpovídající snížení relativního rizika 12,4 %, zvláště výrazný byl pokles rizika u diabetiků I typu z 21,5 % na 17,7 %. Zatímco u nediabetiků se zabrání 9 příhodám na 1000 léčených, u diabetiků je to 21 příhod a u diabetiků 1. typu je to 48 příhod [22]. Příznivé výsledky se vysvětlovaly vlivem thienopyridinů na selektiny a ovlivněním uvolňování zánětlivých mediátorů z trombocytů.
Další studie s klopidogrelem ukazovaly již méně optimistické výsledky u diabetiků, i když vždy byla kombinace lepší než monoterapie aspirinem. Ve studii CURE bylo zastoupeno 2 480 diabetiků a prospěch z kombinované léčby aspirinem a klopidogrelem byl jen mírný – výskyt úmrtí, mozkové příhody nebo recidivy infarktu myokardu byl u diabetiků 14,2 % ve skupině léčené kombinací klopidogrel a aspirin oproti 16,7 % (snížení relativního rizika o 27 %) ve skupině léčené aspirinem (u nediabetiků 9,9 oproti 7,9 % - snížení relativního rizika o 20 %) a podobně se prokazovaly výsledky i ve skupině léčené PCI. Také studie CREDO ukázala, že u diabetiků došlo ke snížení relativního rizika při duální léčbě jen o 11 % oproti snížení o 33 % u nediabetiků (tab. 3).
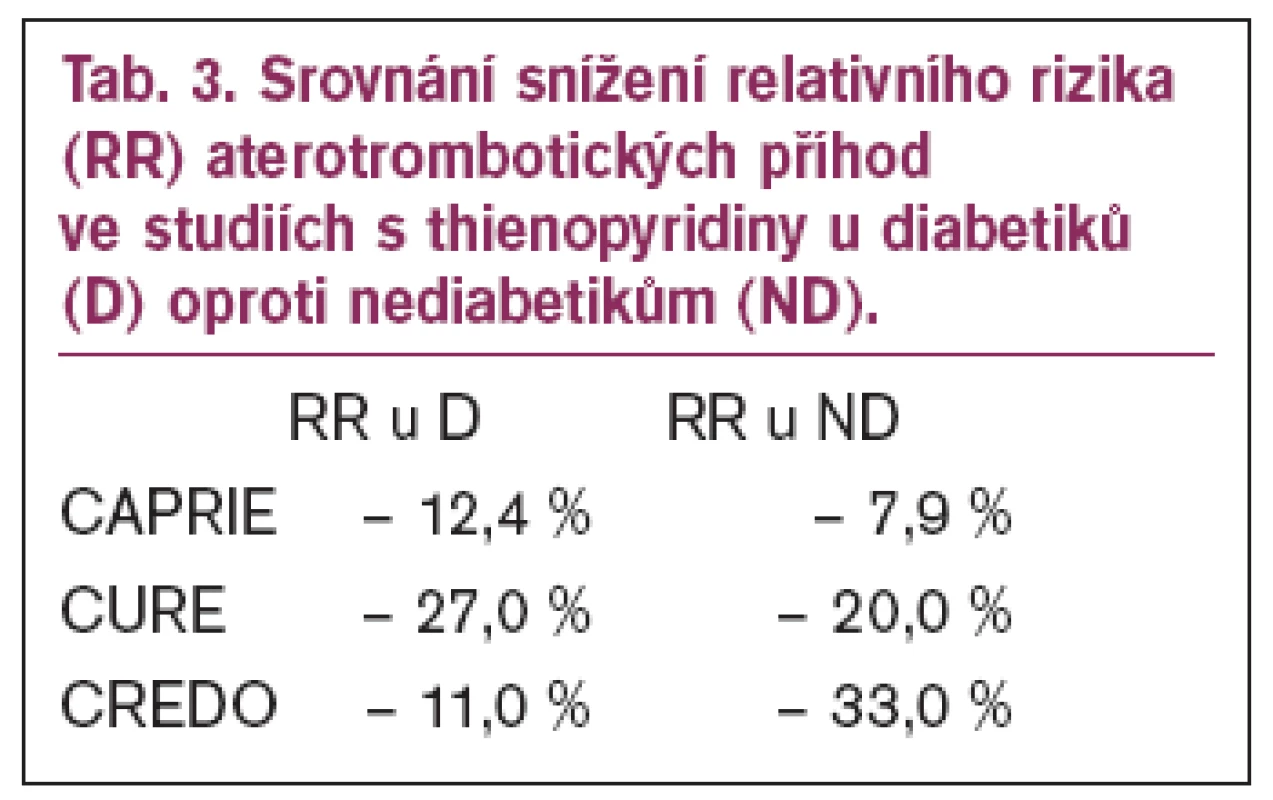
Nicméně i přes tyto zatím skromné výsledky duální antiagregační léčby je kombinace aspirinu a klopidogrelu doporučována u všech diabetiků s akutním koronárním syndromem, pokud nemají kontraindikace podávání těchto léků.
Duální kombinace je také nutná jako prevence subakutní trombózy koronárních stentů po koronární angioplastice. DM představuje nejvyšší riziko pro vznik restenózy po implantaci stentů při perkutánní intervenční léčbě ICHS. V důsledku mechanického dráždění stentem dochází k migraci makrofágů a neutrofilů k místu podráždění, kde se uvolňují cytokiny způsobující remodelaci extracelulární matrix a stimulaci migrace buněk hladkého svalstva do místa stimulace. V případě použití kovových stentů trvá zhojení v modelové situaci u zvířat bez DM zhruba 6-8 týdnů, proto také léčba duální kombinace aspirinu a thienopyridinů je doporučována po dobu 1 měsíce. U diabetiků s vysokým trombogenním potenciálem je pravděpodobně vhodnější tuto léčbu podávat déle. Za této situace s výhodou uplatňují stenty uvolňující látky s antiproliferativním účinkem (DES - drug eluting stent). Nejúčinnější jsou u diabetiků stenty potahované antiproliferační látkou rapamycinem - sirolimus (Cypher stenty), což je makrolidové antibiotikum s antiproliferačním účinkem na buňky hladkého svalu, který inhibuje dělení buněk indukované růstovými faktory a cytokiny [13]. Studie SIRIUS prokázala u podskupiny diabetiků snížení restenózy z 50,5 % u kontrolní skupiny na 17,6 % při použití rapamycinu, podobně jako studie ISAAR-Diabetes [30]. V případě použití stentů, které omezují proliferativní odezvu cévní stěny a prodlužují dobu hojení v důsledku uvolňování látek s imunosupresivním účinkem (stenty uvolňující léky), se podávání duální kombinace prodlužuje na více než 2 měsíce, nejčastěji je doporučováno 6-8 měsíců a někdy i déle, možná nejlépe doživotně. Stenty vylučující léky se u diabetiků ukázaly být vysoce účinnými, jejich použití ale znamená významné zvýšení nákladů pro zdravotní systémy. Nyní probíhají studie hodnotící účinnost těchto sirolimových stentů ve srovnání s CABG u diabetiků (Cardia trial), a je možné, že se v budoucnu tento typ stentů ukáže rovnocenným v léčbě ischemie oproti CABG.
Účinnosti kombinované antiagregační léčby u cévních mozkových příhod byla hodnocena ve studii MATCH,která srovnávala léčbu klopidogrelem v monoterapii oproti léčbě kombinací aspirinu a klopidogrelem u 7 600 nemocných a hodnotila výskyt ischemických mozkových příhod, infarktu myokardu, úmrtí z cévních příčin nebo rehospitalizaci pro akutní cévní příhodu. Použití kombinační léčby aspirinu s klopidogrelem po dobu 18 měsíců nevýznamně snižovalo frekvenci sledovaných ukazatelů (15,7 % oproti 16,7 %), ale bylo spojeno se vzestupem závažných a život ohrožujících krvácení ve skupině s duální antiagregační léčbou (2,6 % oproti 1,3 %). Protokol studie MATCH byl odvozen dle výsledků studie CAPRI, která ukázala větší prospěch používání klopidogrelu oproti aspirinu a proto byla porovnávanou látkou na rozdíl od klinické praxe zvolena monoterapie klopidogrelem a nikoliv monoterapie aspirinem. Ve srovnání s nediabetickou populací nemocní s diabetem ve studii MATCH měli menší pravděpodobnost léčby některou z kardiovaskulárních intervenčních metod jako je PCI nebo karotická endarterektomie. U diabetických nemocných se primárně sledované ukazatele vyskytly u 437 nemocných (16,8 %) ve skupině placebové ve srovnání s 392 nemocnými (15,1 %) ve skupině léčené aspirinem ukazující na lepší výsledky kombinační terapie u diabetiků. Nebyl rozdíl ve výskytu životně nebezpečných krvácení mezi nemocnými s DM a nemocnými bez DM ve skupině kombinační léčby a monoterapie klopidogrelem.
Studie CHARISMA, jejíž výsledky byly prezentovány na jaře 2006 a která neprokázala u jedinců s diagnózou stabilní klinické manifestace aterotrombózy význam kombinované antiagregační léčby aspirinem a klopidogrelem, zahrnovala také 6 552 nemocných s diabetem (tj. 42 % z celkového počtu). Analýza této podskupiny nemocných možná poskytne další data pro pochopení kombinované agresivní antiagregační léčby u nemocných trpících DM.
Budoucnost antiagregační léčby
Farmaceutický výzkum je nyní zaměřen hlavně na inhibici faktoru Xa, resp. trombinu, protože tato proteáza má rozhodující vliv jak na aktivaci destiček a tvorbu destičkového trombu, tak i na tvorbu červeného trombu.
Ximelagatran je nový perorální inhibitor trombinu indikovaný k prevenci centrálních a periferních embolických komplikací při fibrilaci síní. Na rozdíl od běžně používaného warfarinu jej lze používat bez laboratorního monitorování antikoagulačního účinku ve standardní dávce, ale problémem je jeho hepatotoxicita s nutností monitorovat jaterní funkce. Klinická účinnost byla ověřována v mnoha klinických studií s akronymem SPORTIF (Stroke Prevention using an ORal Trombin Inhibitor in atrial Fibrillation) i v sekundární prevenci po infarktu myokardu v kombinaci s aspirinem ve studii ESTEEM (Efficacy and Safety of the Oral direkt Trombin Inhibitor Ximelagatran in Patients with Recent Myocardial Damage). Při analýze podskupin diabetiků a nediabetiků se ukázala menší účinnost kombinace ximelagatranu a aspirinu u diabetiků než u nediabetiků [32].
Závěr
Jak zlepšit osud nemocných s DM a snížit na minimum opakování trombotických příhod bez nadměrného zvýšení rizika krvácení? Zatím se zdá, že základem je udržení maximálně vyrovnaného metabolického stavu – tj. glykemie a lipidů, u rizikových nemocných a v sekundární prevenci používat antiagregační léčbu společně se statiny a dobrou kompenzací krevního tlaku. U jedinců s vysokým rizikem vzniku trombotických komplikací léčbě vybírat k léčbě diabetu přípravky mající potenciál ke snížení aterotrombotických komplikací, jako jsou glitazony a metformin. Stále je nejasný význam používání středních dávek aspirinu a stejně tak i význam kombinované antiagregační léčby u diabetiků v některých klinických situací v sekundární prevenci ICHS a CMP.
Práce podpořena výzkumným záměrem MSM0021622402 Časná diagnostika a léčba kardiovaskulárních chorob
Doručeno do redakce 16. 5. 06
Přijato k otištění po recenzi 17. 7. 06
doc. MUDr. Jiří Špác, CSc.
II. interní klinika, FN U sv. Anny, Brno
Zdroje
1.Albertini JP, Valensi P, Lormeau B et al. Elevated concentrations of soluble E-selectin and vascular cell adhesion molecule-1 in NIDDM: effect of intensive insulin treatment. Diabetes Care 1998; 21 : 1008–1013.
2.American Diabetes Association. Aspirin Therapy in Diabetes. Diabetes Care 2004; 27(Suppl): 72-73.
3.Angiolillo DJ, Fernandez-Ortiz A, Bernardo E et al. Influence of Aspirin Resistance on Platelet Function Profiles in Patients on Long-Term Aspirin and Clopidogrel After Percutaneous Coronary Intervention. Am J Cardiol 2006; 97 : 38-43.
4.Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324 : 71–86.
5.Aso Y, Matsutomo N, Wakabayashi S et al. Metabolic syndrome accompanied by hypercholesterolemia is strongly associated with proinflamatory state and impairement of fibrinolysis in patiens with type 2 diabetes. Diabetes Care 2005; 28 : 2211-2216.
6.Bartnik M, Rydén L, Ferrari R et al on behalf of the Euro Heart Survey Investigators. The prevalence of abnormal glucose regulation in patients with coronary artery disease across Europe. Eur Heart J 2004; 25 : 1880-1890.
7.Basu S, Larsson A, Vessby J et al. Type 1 Diabetes Is Associated With Increased Cyclooxygenase - and Cytokine-Mediated Inflammation. Diabetes Care 2005; 28 : 1371-1375.
8.Blann AD, Nadar SK, Lip GYH. The adhesion molecule P-selectin and cardiovascular disease. Eur Heart J 2003; 24 : 2166–2179.
9.Brown LC, Johnson JA, Majumdar SR et al. Evidence of suboptimal management of cardiovascular risk in patients with type 2 diabetes mellitus and symptomatic atherosclerosis. CMAJ 2004; 171 : 1189-1192.
10.Ceriello A, Motz E. Prevention of vascular events in diabetes mellitus: which "antithrombotic" therapy? (Comment). Diabetologia 1996; 39 : 1405–1406.
11.Davi G, Catalano I, Averna M et al. Thromboxane biosynthesis and platelet function in type II diabetes mellitus. N Eng J Med 1990; 322 : 1769-1774.
12.Davi G, Ciabattoni G, Consoli A et al. In vivo formation of 8-iso-PGF2 and platelet activation in diabetes mellitus: effects of improved metabolic control and vitamin E supplementation. Circulation 1999; 99 : 224-229.
13.Dibra A, Kastrati A, Mehilli J et al. Paclitaxel-eluting or sirolimus-eluting stents to prevent restenosis in diabetic patients. N Engl J Med 2005; 353 : 663–670.
14.Dormandy JA et al. The PROactive Investigators: Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macro Vascular Events): a randomised controlled trial. Lancet 2005; 366 : 1279–1289.
15.Festa A et al. Elevated levels of acute phase proteins and plasminogen activator inhibitor – 1 predict the development of type 2 diabetes: the Insulin Resistance Atherosclerosis study. Diabetes 2002; 51 : 1131-1137.
16.Final report on the aspirin component of the ongoing Physicians’ Health Study Research Group. N Engl J Med 1989; 321 : 129-135.
17.Friend M, Vucenik I, Miller M. Research pointers: platelet responsiveness to aspirin in patients with hyperlipidaemia. BMJ 2003; 326 : 82–83.
18.Gresele P, Guglielmini G, De Angelis M et al. Acute, short-term hyperglycemia enhances shear stress-induced platelet activation in patients with type II diabetes mellitus. JACC 2003; 41 : 1013-1020.
19.Halushka MK, Halushka PV. Why are some individuals resistant to the cardioprotective effects of aspirin? Could it be thromboxane A2? Circulation 2002; 105 : 1620–1622.
20.Harpaz D, Gottlieb S, Graff E et al. Effects of aspirin treatment on survival in non-insulin - dependent diabetic patients with coronary artery disease. Am Heart J 1998; 105 : 484-487.
21.Helmersson J, Vessby B, Larsson A et al. Association of Type 2 Diabetes With Cyclooxygenase-Mediated Inflammation and Oxidative Stress in an Elderly Population. Circulation 2004; 109 : 1729-1734.
22.Hirsh J, Bhatt DL. Comparative Benefits of Clopidogrel and Aspirin in High-Risk Patient Populations: Lessons From the CAPRIE and CURE Studies. Arch Intern Med 2004; 164 : 2106-2110.
23.Jiménez-Quevedo P, Sabaté M, Angiolillo D et al. LDL-cholesterol predicts negative coronary artery remodelling in diabetic patients: an intravascular ultrasound study. Eur Heart J 2005; 26 : 2307-2312.
24.Lev EI, Patel RT, Maresh KJ et al. Aspirin and Clopidogrel Drug response in patients Undergoing Percutaneous Cornary Intervention: The Role of Dual Drug Rezistence. JACC 2006; 47 : 27-33.
25.Neri Serneri GG, Coccheri S, Marubini E et al. Picotamide, a combined inhibitor of thromboxane A2 synthase and receptor, reduces 2-year mortality in diabetics with peripheral arterial disease: the DAVID study. Eur Heart J 2004; 25 : 1845-1852.
26.Malý J, Malá H, Pecka M et al. Změny hemostázy u obézních při redukci hmotnosti. Vnitř Lék 2001; 47 : 203-209.
27.Malik S, Wong ND, Franklin S et al. Cardiovascular Disease in U.S. Patients With Metabolic Syndrome, Diabetes, and Elevated C-Reactive Protein. Diabetes Care 2005; 28 : 690-693.
28.Meade TW, Brennan PJ. Determination of who may derive most benefit from aspirin in primary prevention: subgroup results from a randomised controlled trial. BMJ 2000; 321 : 13–17.
29.Moreno PR, Fuster V. New aspects in the pathogenesis of diabetic atherothrombosis. JACC 2004; 44 : 2293 -2300.
30.Moses JW et al. Sirolimus-Eluting Stents versus Standard Stents in Patients with Stenosis in a Native Coronary Artery. N Eng J Med 2003; 349 : 1315-1323.
31.Olexa P, Olexová M. Inhibitor aktivátoru plasminogenu (PAI-1), ischemická choroba srdce a diabetes mellitus. Vnitř Lék 2003; 49 : 222-226.
32.Wallentin L, Wolcox RG, Weaver WD. Oral ximelagatran for secondary prophylaxis after myocardial infarction: the ESTEEM randomised controlled trial. Lancet 2003; 362 : 789-797.
33.Pfutzner A, Marx N, Lübben G et al. Improvement of Cardiovascular Risk Markers by Pioglitazone Is Independent From Glycemic Control. JACC 2005; 45 : 1925-1931.
34.Sacco M, Tognoni G, Pellegrinni F, Nicolucci A et al. Primary prevention of cardiovascular events with low-dose aspirin and vitamin E in type 2 diabetes patiens. Diabetes Care 2003; 26 : 3264-3272.
35.Serebruany VL, Pokov AN, Malinin AI et al. Valsartan inhibits platelet activity at different doses in mild to moderate hypertensives: Valsartan Inhibits Platelets (VIP) trial. Am Heart J 2006; 151 : 92-99.
36.Shechter MCN, Bairey Merz MJ et al. Blood glucose and platelet-dependent thrombosis in patients with coronary artery disease. J Am Coll Cardiol 2000; 35 : 300-307.
37.Sidhu JS, Cowan D, Tooze JA, Kaski JC. Peroxisome proliferator-activated receptor γ agonist rosiglitazon reduces circulating platelet activity in patients without diabetes mellitus who have coronary artery disease. Am Heart J 2004; 147 : 1-6.
38.Staško J, Hudeček J, Kubisz P. Trombínom aktivovatelný inhibitor fibrinoolýzy (TAFI) a jeho význam v regulaci fibrinolýzy. Vnitř Lék 2004; 50 : 36-44.
39.Steering Committee of the Physicians’ Health Study Research Group. Final report on the aspirin component of the ongoing Physicians’ Health Study. N Engl J Med 1989; 321 : 129-135.
40.Špác J, Pařenica J. Aspirínový paradox je méně vyjádřen u diabetiků s akutním koronárním syndromem než u nediabetiků. Přednáška XII. výročního kongresu české internistické společnosti ČLS J. E. Purkyně. Vnitř Lék 2005; 51 : 1186.
41.Wang TH, Bhatt DL, Topol EJ. Aspirin and clopidogrel resistance: an emerging clinical entity. Eur Heart J 2006; 27 : 647-654.
42.The ETDRS Investigators. Aspirin effects on mortality and morbidity in patients with diabetes mellitus: Early Treatment Diabetic Retinopathy Study report. JAMA 1992; 268 : 1292-1300.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2006 Číslo 3
-
Všechny články tohoto čísla
- Současné možnosti antiagregační léčby u nemocných s diabetem v prevenci komplikací aterosklerózy
- Léčba diabetiků hypolipidemiky a studie ASPEN
- Losartan – víc než pokles krevního tlaku
- Neinvazivní vyšetření u arteriální hypertenze
- Dálkové monitorování implantabilních kardiostimulátorů a kardioverterů-defibrilátorů
- Defekt septa síní
- Přehled studií citovaných v článcích tohoto čísla Kardiologické revue
- Galerie autorů
-
XIV. výroční sjezd České kardiologické společnosti
Brno 7.–10. 5. 2006 - Co nebylo v abstraktech
- Léčba diabetes mellitus u kardiaka
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Defekt septa síní
- Neinvazivní vyšetření u arteriální hypertenze
- Losartan – víc než pokles krevního tlaku
- Dálkové monitorování implantabilních kardiostimulátorů a kardioverterů-defibrilátorů
