Vybrané lékové interakce v kardiologii
Selected drug interactions in cardiology
Rational pharmacotherapy means the choice of a drug not only in terms of its effectiveness, but also in terms of possible risks, which include drug interactions. The aim of this article is to provide the current state of knowledge about the drug interactions of digoxin, amiodarone and statins, not so that doctors stop prescribing these drugs, but so that the doctor can take certain measures (dose adjustment, patient monitoring, laboratory tests and/or patient instructions) to reduce potential risks.
Keywords:
amiodarone – statins – Drug interactions – cardiology – pharmacology – digoxin
Autoři:
Prokeš M.; Suchopár J.
Působiště autorů:
DrugAgency a. s.
Vyšlo v časopise:
Kardiol Rev Int Med 2020, 22(3): 108-117
Souhrn
Racionální farmakoterapie znamená volbu léku nejen z hlediska jeho účinnosti, ale též z hlediska možných rizik, ke kterým mimo jiné patří i lékové interakce. Cílem tohoto článku je poskytnout současný stav vědomostí o lékových interakcích digoxinu, amiodaronu a statinů nikoliv proto, aby tyto léky lékaři přestali předepisovat, ale proto, aby lékař mohl provést určitá opatření (úpravu dávek, sledování stavu pacienta, laboratorní vyšetření a/nebo poučení pacienta) ke snížení případných rizik.
Klíčová slova:
lékové interakce – kardiologie – farmakologie – digoxin – amiodaron – statiny
Úvod k farmakokinetickým interakcím
Je všeobecně známo, že většina léčiv je před vyloučením z organizmu metabolizována, a to zpravidla na oxidázách cytochromu P450. Například simvastatin je metabolizován na CYP3A4. Pokud je současně podán inhibitor CYP3A4, zpomalí se metabolizace simvastatinu a jeho plazmatické koncentrace (PK) stoupají. Takovým inhibitorem mohou být nejen léky, ale i potraviny, nápoje a byliny. Inhibice nastává vzápětí po vstřebání inhibitoru a ustává po vyloučení inhibitoru. Pokud je plazmatický poločas inhibitoru krátký, lze intenzitu interakce podstatně redukovat tím, že takový inhibitor podáme ráno a substrát až večer (nebo naopak). Naopak, když podáváme induktor, dochází u urychlení metabolizace substrátu (např. simvastatinu) na k poklesu jeho PK. Navození indukce (na rozdíl od inhibice) nenastává okamžitě, ale až v průběhu několika dnů, k maximální indukci dochází zpravidla až za týden nebo i déle. Po vysazení induktoru přetrvává aktivita indukce ještě řadu dní poté, neboť indukcí vytvořený enzym se jen pomalu postupně odbourává. Typickými induktory většiny oxidáz jsou karbamazepin, fenytoin, fenobarbital, třezalka tečkovaná.
Koncentrace léku v organizmu, lépe řečeno v určitých kompartmentech organizmu, je výrazným způsobem ovlivňována také aktivitou transportních proteinů, z nichž některé působí jako influxní pumpy (transportují lék do buňky) a jiné jako efluxní pumpy (transportují lék z buňky). V současné době je známo přes 300 různých transportérů, je to např. P-glykoprotein (P-gp), OCT (organic cationts transporter), OATP (organic anionts transporter protein), BCRP (breast cancer resistence protein) a další. Lipofilní (v tucích rozpustné) léky se mohou vstřebávat difúzí, u hydrofilních (ve vodě rozpustných) léků je difúze obvykle zanedbatená. Aby hydrofilní lék mohl být vstřebán ze střeva, musí být nejprve přenesen influxní pumpou do enterocytu a na druhém pólu enterocytu pak efluxní pumpou vyloučen do krve. Také lipofilní léky jsou přenášeny transportními systémy, obvykle efluxními pumpami.
Obr. 1 sestavený podle Shitara et al [1] a Wang [2] popisuje vliv jednotlivých transportérů na farmakokinetiku rosuvastatinu. Na úrovni střeva transportér OATP1A2 umožňuje vstup rosuvastatinu do enterocytu a OATP2B1 výstup rosuvastatinu z enterocytu do krve. Protichůdně působí BCRP a P-gp, které v enterocytu „pumpují“ rosuvastatin zpět do lumen střeva. V játrech se na vylučování rosuvastinu do žluči podílí OATP1B1 (umožní vstup rosuvastatinu do hepatocytu) a BCRP a P-gp, které rosuvastatin z hepatocytu vyloučí do žluči. Pokud současně s rosuvastatinem podáme inhibitory BCRP a P-gp, sníží se vylučování rosuvastatinu, aniž je přitom ovlivněna míra jeho transportu do organizmu, což vede ke zvýšení jeho plazmatických koncentrací. Podobně jako u rosuvastatinu je při inhibici P-gp zvýšeno vstřebávání ze střeva i u dalších substrátů P-gp, jako je například digoxin (na rozdíl od rosuvastatinu je však enterohepatální cyklus digoxinu bezvýznamný). Vliv transportérů je významný i při vylučování léků z těla ledvinami. Existují pacienti, kteří mají vrozený defekt (mutaci) některých oxidáz nebo transportérů (pomalí metabolizátoři), nebo mají geneticky danou urychlenou činnost některých takových enzymů (ultrarychlí metabolizátoři). Zpravidla o takové zvláštnosti nevíme, musíme proto dávky určitých léků titrovat, což se týká například digoxinu.
![Vliv aktivity transportérů na farmakokinetiku rosuvastatinu [1,2].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e08d918cde80d2c079a66b946e718fab.png)
Lékové interakce digoxinu
Digoxin je dnes užíván méně často než v minulosti, ale i nadále zůstává nezastupitelným lékem u určitých případů srdečního selhání nebo fibrilace síní s rychlou odpovědí komor. Jeho spotřeby v letech 2003-2009 klesly z 31 na 16 milionů definovaných denních dávek (léku) DDD a poté na 10 milionů DDD v roce 2015, od té doby však klesly jen nepatrně na cca 9 milionů DDD v roce 2019 (údaje SÚKLu). Digoxin je klasickým lékem s úzkým terapeutickým rozpětím a proto se musí jeho dávky pečlivě titrovat. Situace složitější o to, že PK digoxinu mění i některé interagující léky.
Farmakodynamické interakce
Z farmakodynamických lékových interakcí je třeba zmínit současné podávání diuretik s kaliuretickým účinkem (saluretika, kličková diuretika), neboť při hypokalemii toxicita digoxinu narůstá. Kontrolovat plazmatické koncentrace kalia je třeba i v případě, že jsou současně podávány léky, které naopak vylučování kalia snižují. Za zmínku stojí také aditivní efekt digoxinu pozorovaný při podávání léků s bradykardizujícím účinkem (ivabradin, betablokátory, verapamil, fingolimod).
Farmakokinetické interakce
Digoxin je citlivý substrát P-gp. Řada léků, které jsou inhibitory P-gp, zvyšuje plazmatické koncentrace digoxinu tím, že snižuje vylučování digoxinu z organizmu ve střevě a zřejmě i v ledvinách. Vzhledem k úzkému terapeutickému rozpětí digoxinu je řada z takových interakcí klinicky významná. Ve studii Englund et al [3] nad databází záznamů 618 pacientů, u nichž bylo prováděno terapeutické monitorování plazmatických koncentrací (TDM) digoxinu, průměrné plazmatické koncentrace S-digoxinu u pacientů bez současného užívání inhibitorů P-gp činily 1,26 ± 0,04 nmol/l, zatímco při užívání 1 inhibitoru P-gp 1,51 ± 0,05, 2 inhibitorů P-gp 1,59 ± 0,08 a 3 P-gp inhibitorů 2,00 ± 0,07 nmol/l, rozdíly byly vysoce statisticky významné.
Mezi inhibitory P-gp patří řada kardiovaskulárních (KV) léků, u nichž je velká pravděpodobnost, že je bude pacient léčený digoxinem užívat, jedná se zejména o karvedilol a spironolakton (oba navíc používané při terapii srdečního selhání) nebo dronedaron, amiodaron, propafenon, itrakonazol, klarithromycin a verapamil. Pro jednotlivé interakce s digoxinem bylo zpravidla publikováno více studií. Graf 1 znázorňuje výsledky jednotlivých studií ve smyslu zvýšení plochy pod křivkou (AUC – area under the curve) plazmatických koncentrací digoxinu, a to vždy s nejnižšími (Min) a nejvyššími výsledky (Max) kromě spironolaktonu, kde známe výsledky pouze jedné studie. Níže jsou uvedeny poznámky k jednotlivým interakcím zobrazeným v grafu 1.

Digoxin a klarithromycin
Ve studii Rengelshausen et al [4] u 12 zdravých mužů byl po dobu 3 dnů podáván klarithromycin v dávkách 250 mg 2× denně nebo bylo podáváno placebo, druhý den studie byl perorálně podán digoxin v jednorázové dávce 0,75 mg. Klarithromycin zvýšil AUC plazmatické koncentrace digoxinu průměrně o 64 %. Interindividuální variabilita byla značná, u některých subjektů nedošlo prakticky k žádnému vzestupu AUC digoxinu, u jiných byl vzestup více než dvojnásobný. Podobné výsledky ve smyslu zvýšení AUC digoxinu klarithromycinem průměrně o 62 % přinesla i studie Tanaka et al [5]. Juurlink et al [6] v populační studii u pacientů starších než 66 let již v roce 2003 prokázal zvýšení rizika hospitalizací pro předávkování digoxinem současně podávaným klarithromycinem, a to 12×. Gomes et al [7] v roce 2009 v podobné studii zjistili 14násobný (95% CI 7,9–27,9) nárůst toxicity po digoxinu podávaném s klarithromycinem, a 3násobný (95% CI 1,7 – 7,9) s azithromycinem, oproti tomu cefuroxim nezpůsobil žádný nárůst vzniku toxicity digoxinu. Ve studii Quinn et al [8] autoři zjistili statisticky nevýznamné riziko náhlých úmrtí seniorů během 14 dnů od podávání klarithromycinu pouze ve výši 1,25 (95% CI 0,94–1,65), vzhledem k výše uvedeným skutečnostem však nelze negativní vliv interakce digoxin-klarithromycin podceňovat. Z makrolidových antibiotik azihtromycin interaguje podstatně méně a spiramycin (Rovamycine) neinteraguje vůbec, přičemž antimikrobiální spektrum i indikace těchto ATB jsou prakticky totožné.
Digoxin a antiarytmika
Zvýšení PK perorálně podávaného digoxinu amiodaronem bylo prokázáno u řady studií a byly popsány i kazuistiky arytmie Torsade de pointes (TdP). Pokud však je digoxin podán parenterálně, jsou jeho PK zvýšeny podstatně méně. Ve studii Nademanee et al [9] byly PK perorálně podávaného digoxinu zvýšeny o 104 %, zatímco v případě parenterálně aplikovaného digoxinu pouze o 22 %. Příčinou rozdílu je fakt, že při parenterálním podáním se obchází obranná bariéra na úrovni enterocytu (kde P-gp vylučuje digoxin do lumen střeva), přičemž obvyklá výše parenterální dávky digoxinu je tomu (empiricky) již uzpůsobena. Údaje pro interakci digoxinu s dronedaronem jsou údaje čerpány ze Study INT5189 [10] a Hohnloser et al [11] s propafenonem od autorů Belz et al [12] a Salerno [13].
Digoxin a verapamil
Ve studii Pedersen et al [14] podávání verapamilu v denních dávkách 240 mg po týdnu zvýšilo PK digoxinu z 0,21 ± 001 ng/ml na 0,24 ± 0,01 ng/ml (p < 0,01), po dalších pěti týdnech pak došlo k poklesu PK digoxinu na 0,27 ± 0,01 ng/ml (NS), k čemuž zřejmě přispělo vylučování digoxinu močí zvýšené o 50 %. Několik dalších studií elevaci PK digoxinu verapamilem potvrdilo. Výrobce verapamilu v ČR [15] uvádí, že při nasazení verapamilu pacientovi léčeném digoxinem lze očekávat cca 50% vzestup AUC digoxinu, a proto by měla být dávka digoxinu snížena.
Digoxin a karvedilol
Ve studii Baris et al [16] u mužů zjistili, že karvedilol zvýšil AUC digoxinu o 56 % (p < 0,001), zatímco u žen nebyly žádné statisticky významné změny PK digoxinu pozorovány. Již dříve u dětí Ratnapalan et al [17] zaznamenali snížení clearance digoxinu po nasazení karvedilolu cca o polovinu. Výrobce karvedilolu v ČR [18] uvádí, že karvedilol i digoxin zpomalují atrioventrikulární vedení. Kromě toho v některých studiích u zdravých subjektů a u pacientů se srdečním selháním byla prokázána zvýšená expozice digoxinu až o 20 %, vyšší PK byly zjišťovány především u mužů než u žen. Doporučuje se proto zvýšené sledování hladin digoxinu na začátku, při titrování a při přerušení léčby karvedilolem. Karvedilol nemá žádný vliv na PK digoxinu podaného intravenozně.
Digoxin a itrakonazol
Ve studiích u zdravých dobrovolníků autorů Partanen et al [19] a Jalava [20] cyklosporin zvýšil PK digoxinu o 80 %, resp. o 50 %. Kromě toho bylo publikováno množství kazuistik takové interakce, autoři zpravidla doporučují snížení dávek digoxinu o polovinu.
Digoxin a spironolakton
Ve studii u 9 pacientů Steiness et al [21] dlouhodobě léčených digoxinem byl podáván spironolakton v denních dávkách 200 mg perorálně, došlo ke zvýšení PK digoxinu o 20 %, byla zaznamenána zvýšená interindividuální varianta PK digoxinu. V další studii Waldorf et al [22] u 4 zdravých dobrovolníků a 4 pacientů spironolakton podávaný v denních dávkách 200 mg snížil clearance intravenózně podávaného digoxinu o 25 %. Autoři uvádějí, že u pacientů užívajících spironolakton by měl být digoxin nasazován s opatrností, úvodní i udržovací dávky by měly být nižší.
Digoxin a cyklosporin
Dorian et al [23] popsali kazuistiky 4 pacientů léčených digoxinem v denních dávkách 0,375 mg, u nichž nasazení cyklosporinu vyvolalo příznaky předávkování digoxinu. U dvou z těchto pacientů bylo zaznamenáno zvýšení PK digoxinu z 1,2 ng/ml na 4,5 ng/ml, resp. z 2,0 na 8,3 ng/ml, ke kterému došlo během 2–3 dnů. U 2 dalších pacientů cyklosporin snížil clearance digoxinu o 47 %, resp. o 58 %.
Lékové interakce amiodaronu
Amiodaron je nejužívanějším antiarytmikem III. třídy, jeho roční spotřeby v ČR činí zhruba 13 milionů DDD.
Farmakodynamické lékové interakce
Amiodaron a prodloužení intervalu QT, vč. zvýšení rizika arytmie TdP
Antiarytmika byla prvními léky, u nichž bylo v 80. letech minulého století zjištěno, že mohou vyvolat potenciálně fatální komorovu arytmii TdP. Arytmie TdP zpravidla vzniká při současném působení různých proarytmogenních faktorů, z nichž nejdůležitější jsou kombinace rizikových léků, hypokalemie, hypomagnezemie, bradykardie, kardiomyopatie, hypertrofie a/nebo chronické srdeční selhání a stress vč. sportovního výkonu. Pří velmi krátkém běhu TdP pacient může pociťovat závrať, při delším (více než několik sekund) pacient upadá do bezvědomí, smrt nastává poruchou prokrvení centrální nervové soustavy (CNS) nebo ještě rychleji při vývoji komorové fibrilace. Abychom takovou arytmii zachytili, musí být pořízen EKG záznam nebo musí být pacient zapojen na monitor, proto takové záchyty nejsou časté. Považuje se však za pravděpodobné, že nemalá část náhlých srdečních smrtí je způsobena právě TdP. Varovným znamením zvýšeného rizika TdP je prodloužení QTc intervalu (interval korigovaný s ohledem na srdeční frekvenci).
Míru rizika u jednotlivých léků určujeme podle CredibleMeds [24], které jsou uznávaným referenčním střediskem pro prodloužení QT a TdP vyvolané léky:
- skupina – léky se známým rizikem TdP. Léky, u nichž existují důkazy, že prodlužují QT interval a že jejich užívání je nepochybně spojeno s rizikem vzniku TdP.
- skupina – léky s možným rizikem TdP. Léky, u nichž existují důkazy, že mohou prodlužovat QT interval, ale u kterých nejsou dostupné dostatečné důkazy, že při užívání v indikovaných případech a dávkách mohou způsobit TdP.
- skupina – léky s podmíněným rizikem TdP. Léky, u nichž existují důkazy, že prodlužují QT interval a že jejich užívání je spojeno s rizikem vzniku TdP, ale pouze za určitých podmínek, například při předávkování, hypokalemii, u vrozeného prodloužení QT nebo při současném podávání s dalšími léky prodlužujícími QT interval.
- skupina – léky, které jsou kontraindikovány u pacientů s vrozeným LQTS. Všechny výše uvedené třídy léků a sympatomimetika.
Mezi léky prvé třídy Crediblemeds se známým rizikem TdP, které jsou v ČR dostupné, patří:
- antiarytmika – amiodaron, dronedaron, sotalol,
- antimikrobiální léky – všechna makrolidová antibiotika, z fluorfochinolonů ciprofloxacin, levofloxacin, moxifloxacin a gatifloxacin a z antimykotik flukonazol,
- antiprotozoika – hydroxychlorochin, halofantrin, pentamidin,
- cytostatika – oxaliplatin, vandetanib, oxid arsenitý a anagrelid,
- antipsychotika – chlopromazin, levomepromazin a zřejmě i další fenothiaziny, haloperidol, droperidol, chlorprothixen a sulpirid,
- antidepresiva – citalopram, escitalopram,
- ostatní léky – domperidon, ondansetron, sefovluran, propofol, methadon.
Výrobce amiodaronu [26] považuje za kontraintraindikované jeho podání s léky, které mohou vyvolat TdP, což lze vztáhnout na všechna léčiva 1. skupiny podle Crediblemeds.
Dále výrobce uvádí, že „společné podávání přípravků prodlužujících QT interval s amiodaronem musí probíhat vždy na základě důsledného posouzení potenciálních rizik a výhod pro pacienta vzhledem k tomu, že může dojít k vyvolání TdP a pacient musí být stále monitorován ohledně prodloužení QT intervalu“. To lze vztáhnout na výše uvedené skupiny č. 2 a č. 3, aktuální výčet těchto léků lze získat z výše uvedené webové stránky Crediblemeds. Pokud je takový lék nasazován u pacienta s amiodaronem, je vhodné pořídit EKG záznam před a několik dní po zahájení takové terapie a pátrat po prodloužení QTc.
Amiodaron a léky vyvolávající bradyarytmii
Amiodaron zpomaluje srdeční frekvenci, proto výrobce nedoporučuje jeho kombinaci s betablokátory a blokátory kalciového kanálu, které snižující tepovou frekvenci (verapamil, diltiazem). Může totiž dojít k poruchám automacie (vážná bradykardie) nebo vedení.
Boutitie et al [25] porovnávali nad daty ze dvou randomizovaných klinických studií (EMIAT a CAMIAT) výsledky následné péče u pacientů po infarktu myokardu užívajících kombinaci amiodaronu a betablokátoru (n = 691), samotný amiodaron (n = 657), samotný betablokátor (n = 682) nebo placebo (n = 657). Byly sledovány frekvence úmrtí z jakýchkoli příčin, úmrtí z KV příčin celkem, smrt z důvodů arytmie, úmrtí z jiných KV příčin a smrt z arytmie + zresuscitovaná náhlá zástava srdeční. Hodnoty všech uvedených parametrů byly nižší u pacientů s kombinací amiodaronu a betablokátoru než u pacientů bez betablokátorů nebo bez amiodaronu. Doba sledování činila 2 roky. Statistická významnost byla prokázána pouze u dvou z výše uvedených parametrů – úmrtí z KV příčin celkem (p = 0,04) a úmrtí na arytmii plus zresuscitovaná náhlá zástava srdeční (p = 0,03). Ne všichni pacienti však kombinaci amiodaronu a betablokátoru snášeli, jak ukazuje graf 2.
![Perzistence užívání betablokátoru u pacientů užívajících současně amiodaron nebo placebo [22].](https://pl-master.mdcdn.cz/media/image_pdf/dbce3bd547f79d6c4bb5a33e885239d5.png?version=1606935714)
Z výše uvedeného je zřejmé, že pokud by byli v reálné klinické praxi pacienti sledováni tak pečlivě, jako bývají sledováni v klinických studiích, mohla by kombinace amiodaronu a betablokátoru být výhodná alespoň pro některé z nich. Stavět se proti doporučení výrobce by však mohlo být poněkud odvážné, neboť výrobce disponuje značným množstvím informací, které nebyly nikdy publikovány a které nám tedy nejsou známy. Pokud bychom přesto amiodaron s betablokátorem podávali, musíme očekávat významné zvýšení plazmatických koncentrací především metoprololu, nebivololu i karvedilolu a v menší míře i u betaxololu a bisoprololu, protože uvedené betablokátory jsou substráty CYP2D6 a amiodaron inhibicí CYP2D6 zpomaluje jejich metabolizmus a tedy i eliminaci z organizmu.
Farmakokinetické lékové interakce amiodaronu
Amiodaron má extrémně vysoký distribuční objem, v jehož důsledku je na začátku terapie nutné podávat saturační dávku, a abnormálně dlouhý biologický poločas (více než 50 dnů), kvůli kterému amiodaron může interagovat s jinými léky ještě za několik týdnů po ukončení terapie [27]. Je středně silným inhibitorem CYP2C9 a P-gp a slabým inhibitorem CYP2D6, CYP3A4 a CYP1A2, z toho vyplývá, že mění farmakokinetické vlastnosti řady důležitých léků, jako je digoxin (viz výše) nebo warfarin. Amiodaron sám je substrátem CYP3A4 a CYP2C8. Výrobce amiodaronu [26] doporučuje vyhnout se užívání inhibitorů CYP3A4 během užívání amiodaronu, neboť jeho plazmatické koncentrace by mohly stoupat. Jako příklad je uveden grapefruitový džus, silnějšími inhibitory jsou však klarithromycin nebo azolová antimykotika.
Amiodaron a warfarin
V současné době jsme svědky rychlého nárůstu spotřeb přímých orálních antikoagulancií (DOAC), z grafu 3 je však zřejmé, že spotřeby warfarinu se téměř nemění (data SÚKL), a tak jeho lékové interakce musíme mít stále na paměti. V roce 2019 bylo léčeno warfarinem 57 % ze všech pacientů užívajících orální antikoagulancia.

Warfarin je podáván v podobě racemátu složeného ze dvou izomerů (R-warfarin a S-warfarin v poměru 1 : 1). Amiodaron inhibicí CYP2C9 zvyšuje PK S-warfarinu, který je antikoagulačně účinnější, a inhibicí CYP3A4 PK R-warfarinu, který je méně účinný. Z toho vyplývá, že amiodaron zvyšuje účinnost warfarinu. Pokud je u pacienta stabilizovaného na určité dávce warfarinu indikován amiodaron, musíme po zahájení léčby amiodaronem dávku warfarinu opět vytitrovat. Graf 4 ukazuje, jak v klinické studii Sanoski et al [28] jakým způsobem bylo třeba dávky warfarinu snižovat. U 50 pacientů zařazených do studie pouze u 5 z nich byla během následujícího roku pozorována nezávažná krvácivá příhoda. Při podávání dávek amiodaronu 400, 300, 200 nebo 100 mg denně bylo třeba snížit denní dávky warfarinu průměrně o 40 %, 35 %, 30 % nebo 25 %.
![Průměrné denní dávky warfarinu vytitrované v průběhu prvního roku od nasazení amiodaronu [28].](https://pl-master.mdcdn.cz/media/image_pdf/ee6516e4bb3d88803e3a0459dc0c908e.png?version=1606935881)

Ve studii z reálné klinické praxe Holm et al [29] ve dvou švédských registrech warfarinovaných pacientů retrospektivně sledovali úspěch titrace warfarinu po nasazení amiodaronu. Celkový počet pacientů činil 754, průměrný věk činil 67 let, 30,5 % byly ženy. Průměrné INR po zahájení léčby amiodaronem stouplo z 2,6 na maximum 3,07 (95% CI 3,01–3,13), které bylo dosaženo po 3 týdnech. Podíl pacientů se supraterapeutickým INR v tomto období zároveň vzrostl z 11,7 na 37,1 %, podíl pacientů s INR vyšším než 4 vzrostl z 0,9 na 5,5 %. Po 3. týdnu došlo k poklesu uvedených hodnot, 12 týden se procenta navýšení INR navrátila k výchozím hodnotám. Je třeba doplnit, že ne všichni pacienti byli sledováni každý týden, 1. týden po nasazení amiodaronu bylo INR stanoveno pouze u 67 %, 2. týden u 90 % a 3. týden u 96 % pacientů. Průměrné snížení dávky warfarinu po řádném vytitrování u pacientů do 65 let činilo 25,6 % a u pacientů nad 65 let 23,0 %, nebyl zjištěn rozdíl mezi muži a ženami. Již dříve v univerzitní klinice v Sao Paolo, Brazilie zaznamenali Santos et al [30] v prvních týdnech po nasazení amiodaronu zvýšení frenvekce INR vyššího než 3,9 z původních 36 na 40 %, ale počet nežádoucích příhod nebyl statisticky významně zvýšen. Na antikoagulační klinice v Minneapolisu (USA) zaznamenali Lu et al [31] o 37 % vyšší frekvenci INR vyššího než 5,0. Ve studii u warfarinizovaných pacientů starších 66 let (n = 7 124) v provincii Ontario (Kanada) byla frekvence hospitalizací pro krvácivou příhodu v prvých 30 dnech užívání amiodaronu vyšší o 145 % než u pacientů bez amiodaronu a celkem 7 z 56 hospitalizovaných pacientů zemřelo.
Z toho vyplývají dvě věci:
- Již s první dávkou amiodaronu je vhodné zvážit snížení dávky warfarinu. Z výše uvedené studie Holm et al [29] vyplývá, že snížení o 25 % by bylo optimální, Suchý et al [33] uvádí, že při denní dávce amiodaronu 200 mg, resp. 400 mg je vhodné dávku warfarinu snížit o 35 %, resp. o 50 %.
- Po nasazení amiodaronu je třeba INR pečlivě sledovat, v prvních 12 týdnech 1–2× týdně, v případě potřeby i 3× týdně [33], a dávky warfarinu upravovat.
Amiodaron a DOAC
Všechna DOAC jsou substrátem transportéru P-gp a přinejmenším některé z nich též BCRP a všechny kromě dabigatranu a edoxabanu jsou substrátem CYP3A4, i když u některých je klinická významnost této metabolické cesty malá.
Ve studii Chang et al [34] nad databází národního pojištění na Tchai-wanu u 91 330 pacientů s non-valvulární fibrilací síní léčených DOAC byl sledován vliv současného podávání dalších léčiv na frekvenci velkých krvácivých příhod. U pacientů léčených jakýmikoli DOAC a amiodaronem (94 170 pacientočtvrtletí) bylo zjištěno 1,37× (99% CI 1,25–1,50) vyšší riziko krvácivé příhody než u pacientů léčených samotnými DOAC (352 862 pacientočtvrtletí).
Nejvyšší nárůst rizika krvácení u pacientů s DOAC způsobeného amiodaronem byl v uvedené studii zaznamenán u intrakraniálních krvácení, a to 1,97× (99% CI 1,67–2,34). Z uvedeného vyplývá, že přinejmenším u některých pacientů je interakce klinicky významná u všech třech DOAC uvedených v tab. 1. Upozorňujeme, že čísla 0,98–1,72 u apixabanu vyjadřují rozptyl na 99 % hladině spolehlivosti, nikoliv obvykle používanou 95 % hladinu spolehlivosti. Edoxaban nebyl v této studii hodnocen, ale lze předpokládat, že podobné riziko vykazuje i on. Ve studii Mendell et al [35] byl 30 (26M/4F) zdravým dobrovolníkům průměrného věku 32 let amiodaron 400 mg po dobu 4 dnů, před tím a spolu s poslední dávkou byl podán edoxaban v jednorázové dávce 60 mg perorálně podaný amiodaron zvýšil AUC edoxabanu o 40 % (34–46 % na 95% CI) a Cmax o 66 % (95% CI 46–88 %).
![Zvýšení frekvence velkých krvácivých příhod při kombinaci DOAC s amiodaronem po zohlednění dalších rizikových faktorů. Podle [34].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image_pdf/4d6985273c013a1a7311a784449a0e49.png)
Dabigatran
Byly popsány četné kazuistiky velkých krvácivých příhod vzniklých při současném podávání dabigatranu a amiodaronu. Výrobce dabigatranu [36] v ČR uvádí, že amiodaron zvyšuje plochu pod křivkou dabigatranu průměrně 1,6násobně a že amiodaron je jedním z faktorů, které může zvýšit riziko krvácivé příhody, proto je třeba dodržovat pečlivý klinický dohled. Snížení dávky dabigatranu jeho výrobce stanovuje pouze v případě, že je dabigatran podáván jako prevence tromboembolické nemoci v ortopedii, a to na 75 mg dabigatranu 2× denně.
Rivaroxaban
Autoři Hanigan et al [37] v retrospektivní kohortové studii pacientů v letech 2012–2016 byli v běžné klinické praxi identifikováni pacienti, kteří užívali současně rivaroxaban nebo apixaban a inhibitor P-gp, který byl současně i středně silným inhibitorem CYP3A4 (vč. amiodaronu). K jednotlivým pacientům bylo přiřazeno celkem 213 podobných kontrolních pacientů, kteří výše zmíněné interagující léky neužívali, průměrný interval sledování činil 1,45 let. V kohortě pacientů s interagujícími léky došlo ke krvácivé příhodě u 26,4 % pacientů a v kohortě kontrolních pacientů pouze u 18,4 % pacientů. Riziko činilo 1,8 (95% CI 1,19–2,73; p = 0,0006). Mezi jednotlivými typy inhibitorů P-gp nebyly zjištěny žádné rozdíly v počtu krvácivých příhod. V rámci 10 kazuistik autorů Sennesael et al [38] pacientů léčených rivaroxabanem, kteří byli v jedné ze dvou fakultních nemocnic v Belgii přijati k hospitalizaci pro krvácivou příhodu, autoři zmiňují dva pacienty, kteří byli současně léčeni také amiodaronem. Žena ve věku 77 let s hmotností 63 kg užívala rivaroxaban v dávkách 15 mg denně pro fibrilaci síní déle než rok. Vyvolávacím faktorem bylo trauma, následně došlo k intrakraniálnímu krvácení. Dalším rizikovým faktorem bylo užívání aspirinu a genetický polymorfismus P-gp. Plazmatické koncentrace rivaroxabanu měřené Biophen DiXal činily 139,4 ng/ml, odhad minimálních plazmatických koncentrací rivaroxabanu činil 134 ng/ml (byl tedy vyšší než předpokládané hodnoty). Muž ve věku 66 let s hmotností 100 kg užíval rivaroxaban pro fibrilaci síní nejméně jeden rok v denních dávkách 20 mg. Ke krvácení do gastrointestinálního traktu došlo po invazivním zákroku, plazmatické koncentrace rivaroxabanu i protrombinového času byly v normálním rozmezí. Oba pacienti se z krvácivé příhody zotavili. Stölberg et al [39] popisují případ polymorbidního pacienta se sníženou funkcí ledvin a s hepatopatií, který užíval amiodaron v denních dávkách 200 mg, u kterého 4 měsíce po nasazení rivaroxabanu v dávkách 20 mg denně došlo k fatálnímu krvácení do mozku. Autoři identifikovali dalších 7 kazuistik intrakraniálního krvácení u pacientů léčených rivaroxabanem, z nichž 4 zemřeli. Kazuistiku pacienta, u kterého při současném podávání rivaroxabanu a amiodaronu došlo ke spontánní srdeční tamponádě, popisuje a Oladiran et al [40]. Výrobce rivaroxabanu v ČR interakci s amiodaronem v SPC nezmiňuje.
Apixaban
Flaker et al [41] u 2051 pacientů zařazených do studie ARISTOTLE zjistili, že při podávání amiodaronu s warfarinem zapříčinilo více velkých krvácivých příhod, než podávání amiodaronu s apixabanem. Ve studii autorů Gulilat et al [42] u 358 pacientů (bělochů) s fibrilací síní průměrného věku 77,2 let, hmotnosti 5,5 kg a s průměrnou hodnotou plazmatického kreatininu 103,1 mol/l bylo zjištěno, že nezávislým faktorem zvýšení PK apixabanu je současné podávání amiodaronu. Výrobce apixabanu v ČR [43] očekává, že amiodaron zvyšuje plazmatické koncentrace apixabanu minimálně.
Edoxaban
Informace o klinicky významném ovlivnění účinnosti edoxabanu amiodaronem přinesla analýa podskupin studie ENGAGE AF-TIMI 48 autorů Steffel et al [44]. V této studii nízké dávky edoxabanu nedokázaly snížit výskyt ischemické cévní mozkové příhody (CMP) takovou měrou jako warfarin. Avšak u pacientů, kteří spolu s nízkou dávkou edoxabanu užívali současně amiodaron (n = 2 492), byla účinnost edoxabanu zvýšena takovou měrou, že výskyt ischemických CMP byl snížen podobnou měrou jako u warfarinu. Výrobce edoxabanu v ČR (45) uvádí, že při souběžném podávání amiodaronu není nutné žádné snížení dávky edoxabanu, zvýšení o 40 % (které bylo nalezeno ve studii Mendell et al [35]) nepovažuje za klinicky významné. Je však třeba připomenout, že ne všichni pacienti jsou průměrní, že v reálné praxi edoxaban neužívají třicetiletí zdraví dobrovolníci a že mezi 28 zdravými dobrovolníky, kteří studii dokončili, byla pozorována jedna krvácivá příhoda.
Na závěr lze vyjádřit zklamání nad malým zájmem výrobců DOAC lépe osvětlit klinický význam lékových interakcí s amiodaronem studiemi z reálné klinické praxe. Ze znalostí, kterými disponujeme, je možno usoudit, že u některých pacientů je riziko takové interakce významné. U polymorbidních seniorů s amiodaronem by bylo vhodné zvažovat, zda by podávání warfarinu, jehož účinek je dobře měřitelný, nebylo nakonec bezpečnější než DOAC, kde je rutinní měření problematické.
Lékové interakce statinů
Statiny patří mezi nejčastěji předepisované léky. Tak jako v jiných vyspělých zemích i u nás jejich spotřeby narůstají, a to jednak z důvodů rozšiřování okruhu pacientů, kteří je užívají, a jednak z důvodů zvyšování dávek, aby bylo dosaženo cílových hodnot LDL cholesterolu. Statiny jsou vysoce účinné a zároveň velmi bezpečné léky, ale (tak jako jiné léky) nejsou bezpečné absolutně za všech okolností. Míru bezpečí snižují některé lékové interakce statinů, zejména ty, kdy jsou PK statinů zvyšovány, a to buď inhibicí jejich metabolizace na izoenzymech cytochromu P450 a inhibicí jejich transportu na transportních proteinech (tak jako jiné léky, viz obr. 1). Tab. 2 ukazuje podrobnosti u jednotlivých statinů.
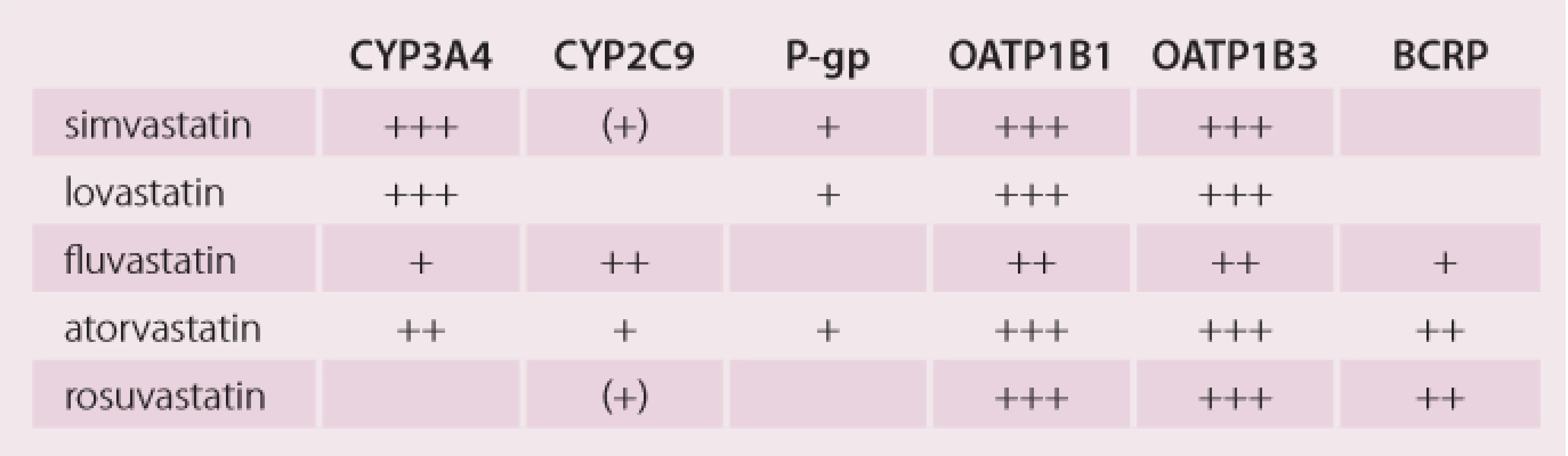
Interakce vedoucí ke zvýšení plazmatických koncentrací statinů
Z tab. 2 je zřejmé, že nejcitlivějšími substráty CYP3A4 jsou simvastatin a lovastatin, silné inhibitory CYP3A4 (např. klarithromycin) jejich PK (AUC) zvyšují téměř 10násobně. AUC atorvastatinu je silnými inhibitory CYP3A4 zvyšována „pouze“ 4násobně [46]. Na vzestupech PK statinů se zřejmě podílí i transportní proteiny OATP a BCRP, které hrají hlavní roli pro lékové interakce rosuvastatinu.
V populační studií nad databázemi pacientů starších 65 let v provincii Ontario (Kanada) Patel et al [47] u 721 277 pacientů léčených statiny metabolizovanými na CYP3A4 celkem 75 851 z nich prodělalo léčebnou kúru klarithromycinem, 3 267 erythromycinem (silné inhibitory CYP3A4) a 68 478 azithromycinem (slabým inhibitorem CYP3A4). Ze statinů činil atorvastatin 73 %, simvastatin 24 % a lovastatin 3 % všech receptů na statiny. Zaznamenáván byl výskyt hospitalizací pro rhabdomyolýzu a dalších nežádoucích účinků do 30 dnů od nasazení zmíněných antibiotik. Výsledky této a další podobné studie se statiny, které nejsou metabolizovány na CYP3A4 autorů Li et al [48] jsou uvedeny v tab. 3.
![Výsledky populačních studií statinů s makrolidy inhibující CYP3A4 (klarithromycin, erythromycin) a s azithromycinem, který CYP3A4 významně neinhibuje. Podle [47,48].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0200a976837d3e896b10402eec1fe9fd.png)
Nárůst nežádoucích účinků rosuvastatinu je zřejmě zapříčiněn inhibicí OATP1B1 způsobené klarithromycinem. Absolutní nárůsty rizik nežádoucích účinků byly v obou studiích malé a počty léčených pacientů na 1 rhabdomyolýzu velké (ve studii Patel et al [47] činily 5 870 pacientů). Proč však volit klarithromycin, když azithromycin je stejně účinný? Z makrolidů máme ještě k dispozici spiramycin, který je stejně účinný a nejvíce bezpečný.
U statinů metabolizovaných na CYP3A4 je třeba brát v úvahu podávání nejen silných, ale i středně silných inhibitorů tohoto isoenzymu, jako je například verapamil a diltiazem, které jsou na rozdíl od antibiotik podávány dlouhodobě, a které by tak spíše mohly vyvolat klinicky významnou interakci.
Silné inhibitory CYP3A4 – atazanavir, darunavir, idelalisib, indinavir, itrakonazol, ketokonazol, klarithromycin, kobicistat, lopinavir, nelfinavir, posakonazol, ribociklid, ritonavir, saquinavir, telithromycin, tipranavir, vorikonazol.
Středně silné inhibitory CYP3A4 – ciprofloxacin, diltiazem, dronedaron, flukonazol, grapefruitová šťáva, imatinib, nilotinib, verapamil.
Vyjádření výrobců statinů k jednotlivým interakcím, kdy jsou plazmatické koncentrace statinů zvyšovány
Výrobce simvastatinu v ČR [49] považují za kontraindikované současné podávání silných inhibitorů CYP3A4 vč. klarithromycinu a itrakonazolu a podávání cyklosporinu, gemfibrozilu a HIV proteáz (např. nelfinavir). Pokud je současné podávání silných inhibitorů CYP3A4 nevyhnutelné, je třeba simvastatinu přerušit a zvážit podávání jiného statinu.
Úprava dávky simvastatinu – u pacientů užívajících amiodaron, amlodipin, verapamil nebo diltiazem, nesmí dávka simvastatinu přesáhnout 20 mg denně. Dále je třeba vyhnout se požívání grapefruitové šťávy.
Výrobce atorvastatinu v ČR [50] uvádí, že současnému podávání silných inhibitorů CYP3A4 je třeba se vyvarovat, pokud je to možné. Výrobce jako příklady takových léků uvádí klarithromycin, cyklosporin, vorikonazol, itrakonazol, posakonazol, některá antivirotika užívaná k léčbě hepatitis C a inhibitory HIV proteázy. Jak bylo výše uvedeno, vyvarovat se podávání klarithromycinu lze snadno, neboť máme k dispozici bezpečnější azithromycin a spiramycin.
Úprava dávky atorvastatinu – při souběžném podávání se středně silnými inhibitory CYP3A4 je vhodné podávat nižší maximální dávku atorvastatinu (tedy maximálně 40 mg) a klinicky pacienty sledovat. Výrobce jako příklady takových léků uvádí diltiazem, verapamil a flukonazol.
Výrobce rosuvastatinu v ČR (51) považuje za kontraindikované současné podávání cyklosporinu (silný inhibitor OATP1B1) nebo fibrátů.
Úprava dávky rosuvastatinu – výrobce uvádí, že rosuvastatin je substrát transportérů OATP1B1 a BCRP. Souběžné podávání rosuvastatinu s inhibitory těchto transportních proteinů může vést ke zvýšeným PK a zvýšenému riziku myopatie. Mezi běžně podávanými léky, jejichž současné užívání vyžaduje snížení dávky rosuvastinu, výrobce též uvádí klopidogrel, který zvyšuje AUC rosuvastatinu na dvojnásobek (pozn.: klarithromycin k inhibitorům OATP1B1 též náleží). Výrobce doporučuje snížení dávky na polovinu, z čehož lze vyvodit, že maximální dávka rosuvastatinu u pacientů s klopidogrelem nečiní 40 mg, ale pouze 20 mg. Je třeba upozornit, že nárůst PK rosuvastatinu by mohly způsobit i rostlinné inhibitory OATP1B1, jako je např. kurkumin, častá přísada pokrmů indické kuchyně. Proto by si měl gurmán vzít rosuvastatin nikoliv po návratu z takové restaurace, ale již před její návštěvou, aby byl vliv kurkuminu minimalizován.
Pro úplnost uvádíme, že některá nová antivirotika používaná při terapii hepatitidy typu C jsou silné inhibitory OATP1B1 (sofosbuvir/ledipasvir, elbasvir/grazoprevir, sofosbuvir/velpatasvir, sofosbuvir/velpatasvir/voxilaprevir a glekaprevir/pibrentasvir). Některá z těchto antivirotik jsou v kombinaci s rosuvastatinem kontraindikována (např. sofosbuvir/ledipasvir) u jiných je nezbytné snížit dávky rosuvastatinu, v případě současného podávání kombinace glekaprevir/pibrentasvir na pouhých 5 mg denně.
Fluvastatin je substrátem CYP2C9, středně silné inhibitory CYP2C9 jsou amiodaron, flukonazolu, kyselina valproová, metronidazol a trimethoprim (tedy i kontrimoxazol, který jej obsahuje). Silné inhibitory CYP2C9 nebyly dosud identifikovány. Výrobce fluvastatinu v ČR [52] upozorňuje, že při současném podávání s glibenklamidem stouply PK (AUC) fluvastatinu i glibenklamidu zhruba o polovinu, proto by měly být pacienti pečlivě sledováni, pokud užívají 80 mg fluvastatinu denně (obáváme se nejen myopatie, ale též hypoglykemie). Flukonazol zvýšil AUC fluvastatinu o 84 %, výrobce doporučuje opatrnost, totéž lze doporučit při podávání ostatních středně silných inhibitorů CYP2C9.
Interakce působící snižování plazmatických koncentrací statinů
Induktory CYP3A4 snižují PK statinů o desítky procent. Typickými „širokospektrými“ induktory většiny isoenzymů P450 a některých transportních systémů jsou karbamazepin, fenytoin, fenobarbital a také třezalka tečkovaná, které snižují i PK flukonazolu, který je metabolizován na CYP2C9. Nověji se ukazuje, že k silným induktorům CYP3A4 patří i řada dalších bylin (vč. těch, které využívá „tradiční čínská medicína“), k nejsilnějším patří např. šalvěj červenokořenná. Pokud by pacienti zároveň s atorvastatinem, lovastatinem nebo simvastatinem uvedené léky či byliny pravidelně užívali, mohli by se stát farmakorezistentními vůči uvedeným statinům. Khandwala [53] popsal kazuistiku muže ve věku 61 let, u něhož nebylo možno snížit hladiny LDL cholesterolu pod 4,3 ani maximální dávkou atorvastatinu a ezetimibu. Poté pacient prozradil, že již od mládí užívá fenytoin 500 mg denně. Po konzultaci s neurologem byl fenytoin vysazen, následně klesly hladiny LDL cholesterolu na 2,8. Klinický význam takových interakcí byl potvrzen několika klinickými studiemi, např. Candrilli et al [54] a Mäkinen et al [55].
Závěr
V tomto článku nebylo možno popsat všechny publikované lékové interakce zmiňovaných léčiv, neboť rozsah informací, které o tématu lékových interakcí KV léků máme k dispozici, je ohromující.
Na závěr si dovolujeme nabídnout jednu zajímavou kazuistiku, která by vlastně mohla též spadat do širší definice lékových interakcí: Al-Sarraf et al [56] popsali případ muže ve věku 41 let s hmotností 254 kg, který během jednoho roku uvědoměle zredukoval hmotnost o 159 kg. Po 2 měsících od začátku redukčního programu bylo třeba implantovat pacemaker spojený s defibrilátorem pro bradykardii. Měsíc poté se dostavily záchvaty ventrikulární tachykardie, bylo zahájeno podávání amiodaronu 200 mg denně. Dva měsíce poté bylo pozorováno zvýšení ke zvýšení LDL cholesterolu z 2,6 na 6,4 mmol/l, bylo zahájeno podávání rosuvastatinu v denních dávkách 10 mg. O měsíc později byly jeho dávky zvýšeny na 20 mg, hladiny LDL cholesterolu se však dále zvyšovaly až na 8,4 mmol/l, hodnoty celkového cholesterolu činily 10,9 mmol/l. Klinické příznaky hypotyreózy nebyly zjištěny, ale tyreostimulační hormon byl mírně zvýšeno (6,72 mU/l). U pacienta byl následně proveden ablační zákrok na srdci, podávání rosuvastatinu i amiodaronu bylo ukončeno a byla zahájena léčba L-thyroxinem. Hodnoty LDL cholesterolu se poté znormalizovaly na 2,3 mmol/l. Autoři přičítají vznik hypercholesterolemie nejen latentní hypotyreóze, ale též negativnímu působení amiodaronu na expresi genu pro LDL cholesterolový receptor [57].
Doručeno do redakce: 9. 8. 2020
Přijato po recenzi: 15. 8. 2020
MUDr. Michal Prokeš
www.drugagency.cz
Zdroje
1. Shitara Y, Sugiyama Y. Pharmacokinetic and pharmacodynamic alterations of 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors: drug-drug interactions and interindividual differences in transporter and metabolic enzyme function. Pharmacol Ther 2006; 112 (1): 71–105. doi: 10.1016/j.pharmthera.2006.03.003.
2. Wang Q, Zheng M, Leil T. Investigating transporter-mediated drug-drug intgeractions using a physiologically based pharmacokinetic model of rosuvastatin. CPT Pharmacometrics Syst Pharmacol 2017; 6 (4): 228–238. doi: 10.1002/psp4.12168.
3. Englund G, Hallberg P, Artursson P et al. Association between the number of coadministered P-glycoprotein inhibitors and serum digoxin levels in patients on therapeutic drug monitoring. BMC Med 2004; 2 : 8. doi: 10.1186/1741-7015-2-8.
4. Rengelshausen J, Göggelmann C, Burhenne J et al. Contribution of increased oral bioavailability and reduced nonglomerular renal clearance of digoxin to the digoxin-clarihtromycin interaction. Br J Clin Pharmacol 2003; 56 (1): 32–38. doi: 10.1046/j.1365-2125.2003.01824.x.
5. Tanaka H, Matsumoto K, Ueno K et al. Effect of clarithromycin on steady-state digoxin concentrations. Ann Pharmacother 2003; 37 (2): 178–181. doi: 10.1177/106002800303700202.
6. Juurlink DN, Mamdani M, Kopp A et al. Drug-drug interactions among elderly patients hospitalized for drug toxicity. JAMA 2003; 289 (13): 1652–1658. doi: 10.1001/jama.289.13.1652.
7. Gomes T, Mamdani M, Juurlink DN. Macrolide-induced digoxin toxicity: a population-based study. Clin Pharmacol Ther 2009; 86 (4): 383–386. doi: 10.1038/clpt.2009.127.
8. Quinn KL, Macdonald EM, Gomes T et al. Macrolides, digoxin toxicity and the risk of sudden death: a population-based study. Drug Saf 2017; 40 (9): 835–840. doi: 10.1007/s40264-017-0539-9.
9. Nademanee K, Kannan R, Hendrickson J et al. Amiodarone-digoxin interaction: Clinical signifikance, time course of development, potential pharmacokinetic mechanisms and therapeutic implications. J Am Coll Cardiol 1984; 4 (1): 111–116. doi: 10.1016/s0735-1097 (84) 80327-7.
10. Study INT5189. In: U.S. Food and Drug Administration; Center for Drug Evaluation and Research. NDA 22-425 Clinical Pharmacology and Biopharmaceutics Review: 230–236.
11. Hohnloser SH, Halperin JL, Camm AJ et al. Interaction between digoxin and dronedarone in the PALLAS trial. Circ Arrhythm Electrophysiol 2014; 7 (6): 1019–1025. doi: 10.1161/CIRCEP.114.002046.
12. Belz GG, Doering W, Munkes R et al. Interaction between digoxin and calcium antagonists and antiarrhythmic drugs. Clin Pharmacol Ther 1983; 33 (4): 410–417. doi: 10.1038/clpt.1983.55.
13. Salerno DM, Granrud G, Sharkey P et al. A controlled trial of propafenone for treatment of frequent and repetitive ventricular premature complexes. Am J Cardiol 1984; 53 (1): 77–83. doi: 10.1016/0002-9149 (84) 90687-8.
14. Pedersen KE, Dorf-Pedersen A, Hvidt S et al. The long-term effect of verapamil on plasma digoxin concentration and renal digoxin clearance in healthy subjects. Eur J Clin Pharmacol 1982; 22 (2): 123–127. doi: 10.1007/BF00542456.
15. SPC v ČR. Isoptin (verapamil), Mylan, 2020/4. Dostupné na: //www.sukl.cz/modules/medication/search.php.
16. Baris N, Kalkan S, Güneri S et al. Infuence of carvedilol on serum digoxin levels in heart failure: is there any gender difference? Eur J Clin Pharmacol 2006; 62 (7): 535–538. doi: 10.1007/s00228-006-0138-7.
17. Ratnapalan S, Griffiths K, Costei AM et al. Digoxin carvedilol interactions in children. J Pediatr 2003; 142 (5): 572–574. doi: 10.1067/mpd.2003.160.
18. SPC v ČR. Atram (karvedilol), Zentiva, 2018/6. Dostupné na: http: //www.sukl.cz/modules/medication/search.php.
19. Partanen J, Jalava KM, Neuvonen PJ. Intraconazole increasses serum digoxin concentration. Pharmacol Toxicol 1996; 79 (5): 274–276. doi: 10.1111/j.1600-0773.1996.tb00273.x.
20. Jalava KM, Partanen J, Neuvonen PJ. Intraconazole decreases renal clearance of digoxin. Ther Drug Monit 1997; 19 (6): 609–613. doi: 10.1097/00007691-199712000-00001.
21. Steiness E. Renal tubular secretion of digoxin. Circulation 1874; 50 (1): 103–107. doi: 10.1161/01.cir.50.1.103.
22. Waldorf S, Andersen JD, Heeboll-Nielsen N et al. Spironolactone-induced changes in digoxin kinetics. Clin Pharmacol Ther 1978; 24 (2): 162–167. doi: 10.1002/cpt1978242162.
23. Dorian P, Strauss M, Cardella C et al. Digoxin-cyclosporine interaction: severe digitalis toxicity after cyclosporine treatment. Clin Invest Med 1988; 11 (2): 108–112.
24. Woosley RL, Heise CW, Romero KA. QTdrugs List, (1. 3. 2020), AZCERT, Inc., 1822 Innovation Park Dr., Oro Valley, AZ 85755, USA. Available at: www.CredibleMeds.org.
25. Boutitie F, Boissel JP, Connolly SJ et al. Amiodarone interaction with beta-blockers: analysis of the merged EMIAT (European myocardial infarct amiodarone trial) and CAMIAT (Canadian amiodarone myocardial infarction trial) databases. The Emiat and Camiat Investigators. Ciculation 1999; 99 (17): 2268–2275. doi: 10.1161/01.cir.99.17.2268.
26. SPC ČR. Cordarone® (amiodaron), sanofi-aventis, 2019/8. Dostupné na: http: //www.sukl.cz/modules/medication/search.php)
27. Bultas J. Antiarytmika. In: Suchopár J et al. Compendium Léčiva používaná v podmínkách ČR, 2018 : 1125–1132.
28. Sanoski CA, Bauman JL. Clinical observations with the amiodarone/warfarin interaction: dosing relationships with long-term therapy. Chest 2002; 121 (1): 19–23. doi: 10.1378/chest.121.1.19.
29. Holm J, Lindh JD, Andersson ML et al. The effect of amiodarone on warfarin anticoagulation: a register-based nationwide cohort study involving the Swedish population. J Thromb Haemost 2017; 15 (3): 446–453. doi: 10.1111/jth.13614.
30. Santos PC, Soares RA, Strunz CM et al. Simultaneous use of amiodarone influences warfarin maintenance dose but is not associated with adverse events. J Manag Care Spec Pharm 2014; 20 (4): 376–381. doi: 10.18553/jmcp.2014.20.4.376.
31. Lu Y, Won KA, Nelson BJ et al. Characteristics of the amiodarone-warfarin interaction during long-term follow-up. Am J Health Syst Pharm 2008; 65 (10): 947–952. doi: 10.2146/ajhp060415.
32. Lam J, Gomes T, Juurlink DN et al. Hospitalization for hemorrhage among warfarin recipients prescribed amiodarone. Am J Cardiol 2013; 112 (3): 420–423. doi: 10.1016/j.amjcard.2013.03.051.
33. Suchý D, Poklopová Z. Lékové interakce warfarinu s kardiovaskulárními léky. Klin Farmakol Farm 2005; 19 : 40–42.
34. Chang SH, Chou IJ, Yeh YH et al. Association between use of non-vitamin K oral anticoagulants with and without concurrent medications and risk of major bleeding in nonvalvular atrial fibrillation. JAMA 2017; 318 (13): 1250–1259. doi: 10.1001/jama.2017.13883.
35. Mendell J, Zahir H, Matsushima N et al. Drug-drug interaction studies of cardiovascular drugs involving P-glycoprotein, an efflux transporter, on the pharmacokinetics of edoxaban, an oral factor Xa inhibitor. Am J Cardiovasc Drugs 2013; 13 (5): 331–342. doi: 10.1007/s40256-013-0029-0.
36. SPC ČR. Pradaxa® (dabigatran), Behringer Ingelheim 2020/1. Dostupné na: https: //www.ema.europa.eu/en/documents/productinformation/pradaxa-epar-product-information_cs.pdf.
37. Hanigan S, Das J, Pogue K et al. The real world use of combined P-glycoprotein and moderate CYP3A4 inhibitors with rivaroxaban or apixaban increases bleeding. J Thromb Thrombolysis 2020; 49 (4): 636–643. doi: 10.1007/s11239-020-02037-3.
38. Senesael AL, Larock AS, Douxfils J et al. Rivaroxaban plasma levels in patients admitted for bleeding events: insights from a prospective study. Thromb J 2018; 16 : 28. doi: 10.1186/s12959-018-0183-3.
39. Stölberg C, Bastovansky A, Finsterer J. Fatal intracerebral bleeding under rivaroxaban. Int J Cardiol 2015; 201 : 110–112. doi: 10.1016/j.ijcard.2015.06.081.
40. Oladiran O, Segal J, Nwosu I et al. A rare case of spontaneous cardiac tamponade idnuced by concomitant use of rivaroxaban and amiodarone. Case Rep Cardiol 2018; 1650716. doi: 10.1155/2018/1650716.
41. SPC ČR. Xarelto® (rivaroxaban), Bayeer 2020/1. Dostupné na: https: //www.ema.europa.eu/en/documents/product-information/xarelto-epar-product-information_cs.pdf.
41. Flaker G, Lopez RD, Hylek E et al. Amiodarone, anticoagulation and clinical events in patients with atrial fibrillation. Insights from the ARISTOTLE trial. J Am Coll Cardiol 2014; 64 (15): 1541–1550. doi: 10.1016/j.jacc.2014.07.967.
42. Gulilat M, Keller D, Linton B et al. Drug interactions and pharmacogenetic factors contribute to variation in apixaban concentration in atrial fibrillation patients in routine care. J Trhomb Thrombolysis 2020; 49 (2): 294–303. doi: 10.1007/s11239-019-01962-2.
43. SPC ČR. Eliquis® (apixaban), Bristol-Myers Squib/Pfizer, 2020/3. Dostupné na: https: //www.ema.europa.eu/en/documents/product-information/eliquis-epar-product-information_cs.pdf.
44. Steffel J, Guigliano RP, Braunwald E et al. Edoxaban vs. warfarin in patients with atrial fibrillation on amiodarone: a subgroup analysis of the ENGAGE AF-TIMI 48 Trial. Eur Heart J 2015; 36 (33): 2239–2245. doi: 10.1093/eurheartj/ehv201.
45. SPC ČR. Lixiana® (edoxaban), Daiichi Sankyo, 2020/3. Dostupné na: https: //www.ema.europa.eu/en/documents/product-information/lixiana-epar-product-information_cs.pdf.
46. Jacobson TA. Comparative pharmacokinetic interaction profiles of pravastatin, simvastatin and atorvastatin when coadministered with cytochrome P450 inhibitors. Am J Cardiol 2004; 94 (9): 1140–1146. doi: 10.1016/j.amjcard.2004.07.080.
47. Patel AM, Shariff S, Bailey DG et al. Statin toxicity from macrolide antibiotic coprescription: a population-based cohort study. Ann Intern Med 2013; 158 (12): 860–876. doi: 10.7326/0003-4819-158-12-201306180-00004.
48. Li DQ, Kim R, McArthur E. Risk of adverse events among older adults following co-prescription of clarithromycin and statins not metabolized by cytochrome P450 3A4. CMAJ 2015; 187 (3): 174–180. doi: 10.1503/cmaj.140950.
49. SPC ČR. Simvastatin Mylan (simvastatin), Mylan, 2020/2n. Dostupné na: http: //www.sukl.cz/modules/medication/search.php.
50. SPC ČR. Sortis (atorvastatin), Pfizer, 2019/9. Dostupné na: http: //www.sukl.cz/modules/medication/search.php).
51. SPC ČR. Crestor (rosuvastatin), AstraZeneca AB, 2019/4. Dostupné na: http: //www.sukl.cz/modules/medication/search.php.
52. SPC ČR. Lescol XL (fluvastatin), Novartis, 2018/12. Dostupné na: http: //www.sukl.cz/modules/medication/search.php.
53. Khandwala MH. Lipid lowering inefficiacy of high-dose statin therapy due to concurrent use of phenytoin. South Med J 2006; 99 (12): 1385–1387. doi: 10.1097/01.smj.0000251470.39036.ea.
54. Candrilli SD, Manjunath R, Davis KL et al. The association between antiepileptic drugs and HMG-CoA reductase inhibitor co-medication and cholesterol management in patients with epilepsy. Epilepsy Res 2010; 91 (2–3): 260–266. doi: 10.1016/j.eplepsyres.2010.07.021.
55. Mäkinen J, Rainesalo S, Raitanen J et al. Discontinuation of carbamazepine due to concerns of long-term consequences of enzyme induction. Epilepsia Open 2018; 3 (3): 340–347. doi: 10.1002/epi4.12227.
56. Al-Sarraf A, Li M, Frohlich J. Statin resistant dyslipidemia in a patient treated with amiodarone. BMJ Case Rep 2011; bcr0820114620. doi: 10.1136/bcr.08.2011.4620.
57. Hudig F, Bakker O, Wiersinga WM. Amiodarone decreases gene expression of low-density lipoprotein receptor at both the mRNA and the protein level. Metabolism 1998; 47 (9): 1052–1057. doi: 10.1016/s0026-0495 (98) 90277-3.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2020 Číslo 3
-
Všechny články tohoto čísla
- Lékové interakce – aktuálně a prakticky
- Vybrané lékové interakce v kardiologii
- EMPEROR reduced – srdeční a renální cíle s empagliflozinem u nemocných se srdečním selháním se sníženou ejekční frakcí
- Kvalita života u nemocných po akutním infarktu myokardu
- Interakce léčiv se zaměřením na vybrané lékové skupiny v kardiologii
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Lékové interakce – aktuálně a prakticky
- Vybrané lékové interakce v kardiologii
- Interakce léčiv se zaměřením na vybrané lékové skupiny v kardiologii
- Kvalita života u nemocných po akutním infarktu myokardu
