MikroRNA v kardiologii – přehled pro klinickou praxi
MicroRNA in cardiology – review for clinical practice
MicroRNAs (miRNAs, miRs) are small, non-coding RNA molecules that are involved in the regulation and fine-tuning of gene expression. They regulate almost all thinkable signalling pathways and thus participate in the maintenance of homeostasis. The levels of individual miRNAs are affected by various external stimuli and they also change in the presence of diseases; these changes can be detected in tissues and bodily fluids (i.e. blood or urine). One miRNA commonly regulates more signalling cascades, either interconnected or independent, and this enables us to better understand the pathophysiology of cardiovascular diseases and reveal novel targets for therapy. Moreover, the presence of miRNAs in the extracellular space makes them potentially usable as diagnostic or prognostic biomarkers of various diseases that can be employed in differential diagnostics and risk stratification of individual patients. This review article summarises basic information about miRNAs and their function. Further, selected miRNAs and their roles in the pathophysiology of some cardiovascular diseases will be described, focusing on those potentially usable in clinical practice.
Keywords:
microRNA – cardiology – biomarkers
Autoři:
J. Novák
Působiště autorů:
II. interní klinika LF MU a FN U sv. Anny v Brně
1; Fyziologický ústav, LF MU Brno
2; Ústav patologické fyziologie, LF MU Brno
3
Vyšlo v časopise:
Kardiol Rev Int Med 2016, 18(4): 258-267
Souhrn
mikroRNA (miRNA, miR) jsou malé nekódující molekuly RNA, které se podílejí na regulaci genové exprese a zasahují prakticky do všech myslitelných signálních, metabolických či regulačních okruhů, čímž se podílejí na udržování homeostázy. Jejich hladiny se mění vlivem vnějších stimulů či při přítomnosti nemoci, a to nejen ve tkáních, ale i v tělních tekutinách (v krvi, moči). Jedna miRNA je často zapojena do regulace více signálních drah, ať již funkčně propojených či zcela nezávislých, čímž nám umožňují nové pohledy na patofyziologii nemocí a přináší nové cíle pro terapii. Přítomnost miRNA v extracelulárním prostoru dělá z miRNA potenciální nové biomarkery různých nemocí použitelných při diagnostice, odhadu prognózy nebo rizikové stratifikaci pacientů. V rámci tohoto souhrnného článku jsou uvedeny základní informace týkající se miRNA a jejich funkce a poté u vybraných nemocí popsány konkrétní miRNA, které jsou zapojeny do jejich patofyziologie nebo které by mohly být potenciálně využitelné v klinické praxi.
Klíčová slova:
mikroRNA – kardiologie – biomarkery
Nekódující RNA – typy, základní funkce a nomenklatura
Lidský genom je „zapsán“ ve struktuře deoxyribonukleové kyseliny (DNA) a jeho základní stavební a funkční jednotky označujeme jako geny. Geny jsou dennodenně aktivně přepisovány do molekul ribonukleové kyseliny (RNA) a v procesu proteosyntézy slouží jako matrice pro vznik proteinů – tímto způsobem jsou však přepisovány pouze 1–3 % genů, které označujeme jako tzv. protein-kódující geny [1]. Dříve se odborníci domnívali, že zbytek genomu je „nadbytečný“ – označovali jsme jej jako „junk DNA“ [2]. Nové metody molekulární biologie umožňující studium transkriptomu (tj. všech přepisovaných RNA v buňce) však ukazují, že až tři čtvrtiny genomu jsou aktivně přepisovány [1] a že většina z těchto RNA neslouží jako matrice pro vznik bílkovin, nýbrž má regulační funkci – tyto RNA proto označujeme jako nekódující RNA.
Nekódující RNA plní v buňce celou řadu regulačních funkcí. Dle délky rozlišujeme dlouhé nekódující RNA (long non-coding RNA – lncRNA; > 200 nukleotidů délky) a malé nekódující RNA (small non-coding RNA – sncRNA) [3]. Malé nekódující RNA jsou značně heterogenní skupinou zahrnující např. malé nukleární (jaderné) RNA (small nuclear RNA – snRNA), které se podílejí na zrání mRNA a jejím sestřihu a mají délku okolo 150 nukleotidů [4], malé nukleolární (jadérkové) RNA (small nucleolar RNA – snoRNA), které se v jadérku podílejí na dozrávání ribozomální RNA (rRNA) nezbytné pro vznik ribozomů a proteosyntézu a mají délku cca 70 – 120 nukleotidů [5], RNA interagující s PIWI proteiny (PIWI-interacting RNA – piRNA) o délce 24 – 32 nukleotidů, které spolu s PIWI proteiny regulují aktivitu transpozonů [6], a v neposlední řadě pak mikroRNA (miRNA, miR) o délce cca 21 – 24 nukleotidů, které se váží na molekuly mRNA a brání jejich překladu do bílkovin [7]. Význam jednotlivých skupin sncRNA v regulaci genové exprese začínáme teprve odkrývat, avšak zdá se, že tyto molekuly hrají klíčové role v rozvoji řady různých nemocí, vč. nemocí kardiologických. Se stoupající úrovní poznání se nám také otevírají nové postupy, jak tyto malé molekuly využít v klinické praxi, ať již v diagnostice či terapii nemocí. V další části tohoto souhrnného článku se zaměříme na aktuálně asi nejvíce prostudovanou oblast sncRNA, tedy na miRNA.
Dle současných odhadů existuje více než 30 000 různých miRNA, z nichž více než 2 000 tvoří jen ty lidské. Údaje o jejich struktuře a funkci jsou shromažďovány v různých online databázích; nejznámější je miRbase (http://mirbase.org/) [8]. S ohledem na počet různých miRNA byl vytvořen jednoznačný systém jejich pojmenovávání [9,10]; jméno se většinou skládá z třípísmenné zkratky miR, hovoříme-li o zralých miRNA (viz dále), případně z třípísmenné zkratky mir psané kurzívou, hovoříme-li o prekurzorech nebo o genech pro dané miRNA. Za touto třípísmennou zkratkou následuje číslice odrážející pořadí jejich objevu – např. tedy miR-1 byla objevena dříve než miR-499; avšak než se tento systém pojmenovávání stihl vytvořit, byla již pojmenována jedna skupina miRNA, zvaná let (např. let-7 apod.), která tak tvoří výjimku z této nomenklatury. Po číselném označení může následovat písmeno a, b, c, d… např. existují miR-133a a miR-133b nebo let-7a, let-7b, let-7d,…, let-7i apod., které se vzájemně jen velice jemně liší ve své struktuře, ale mohou se lišit svými cíli a funkcí či tkáňovou expresí. Dále se zjistilo, že jedna miRNA může být zakódována v genomu na více místech (existuje tedy více genů pro danou miRNA kódující zcela stejnou sekvenci nukleotidů) – k jejich odlišení je možné za první číselný údaj přidat pomlčku a další číslo, např. miR-1-1 a miR-1-2 jsou stejné ve své struktuře, ale miR-1-1 je kódována genem na chromozomu 20, a miR-1-2 je kódována genem na chromozomu 18. Pokud je však za číslem udávající pořadí jejich objevu uvedeno číslo s písmenem (konkrétně 3p nebo 5p), jedná se o bližší specifikaci aktivního vlákna (pocházející z 3’ nebo z 5’ konce prekurzorové miRNA – viz dále). Posledním krokem, jak specifikovat, o které miRNA hovoříme, je přidání třípísmenného prefixu, který odráží, o jakém živočišném druhu hovoříme – např. hsa-miR-1 je lidská miR-1; hsa je zkratka pro homo sapiens. Podobně se v literatuře setkáme s prefixy cel (Caenorhabditis elegans – háďátko), rno (rattus novergicus – potkan), mmu (mus musculus – myš) a podobně.
Objev, vznik a funkce intracelulárních miRNA
První miRNA byla popsána v roce 1993 při studiu háďátka obecného [11] a až dalších téměř 10 let výzkumu ukázalo, že miRNA jsou vysoce evolučně zakonzervované molekuly (jejich struktura se mezi jednotlivými živočišnými druhy liší jen velmi málo) a že mechanizmus, kterým miRNA řídí vývoj háďátka, je možné najít i u dalších živočišných druhů, vč. člověka [12]. Geny pro miRNA jsou rozmístěny po celém genomu – nacházejí se v oblastech intergenních (tedy mezi již známými protein-kódujícími geny), ale je možné je najít i v intronech a exonech již známých genů (tedy v oblastech intragenních) [13]. Když se v genomu nacházejí samostatně, mají často vlastní promotorové oblasti řídící jejich expresi, nacházejí-li se uvnitř již známých genů, je jejich exprese často řízena regulační oblastí tohoto genu (tj. miRNA může a nemusí být přepisována společně s genem, ve kterém se nachází [7]).
Syntéza miRNA je několikastupňový proces [7] – tzv. kanonická cesta syntézy začíná přepisem genu pro miRNA z DNA pomocí enzymu RNA-polymerázy II do podoby primárního transkriptu zvaného pri-miRNA (primární miRNA). Pri-miRNA jsou poměrně dlouhé (někdy i nad 2 000 nukleotidů) jednovláknové RNA, které mohou sloužit jako prekurzor pro více různých zralých (maturovaných) miRNA a ještě v jádře dochází k jejich štěpení pomocí tzv. mikroprocesorového komplexu (enzymu Drosha a jeho kofaktoru DGCR8) na struktury zvané pre-miRNA (prekurzorové miRNA). Prekurzorové miRNA mají typickou strukturu vlásenky – jedná se o jednovláknovou RNA, kdy jeden konec (3’ konec) je spojen s druhým koncem (5’ konec) díky jejich vzájemné komplementaritě, čímž vzniká struktura znázorněná na obr. 1A. pre-miRNA jsou následně exportovány z jádra pomocí systému Exportin-5/RanGTP a v plazmě dochází k odštěpení nekomplementární smyčkové oblasti, čímž vznikají zralé miRNA (celý proces stejně jako alternativní cesty vzniku miRNA jsou znázorněny na obr. 1A). Zralá miRNA je dvouvláknová, přičemž vlákno pocházející z 3’ konce označujeme jako 3p a vlákno pocházející z 5’ konce jako 5p. Obě vlákna jsou následně zavzata do tzv. miRNA-indukovaného tlumicího komplexu (miRISC); miRISC je tvořen zralou miRNA, proteinem TRBP (trans-activation response RNA-binding protein) a typicky argonautovým proteinem 2 (Ago2). Ago-2 dvouvláknovou miRNA rozvine a jedno vlákno, označované jako vedoucí, v miRISC zůstane a druhé je z něj uvolněno do cytoplazmy a následně degradováno [7].
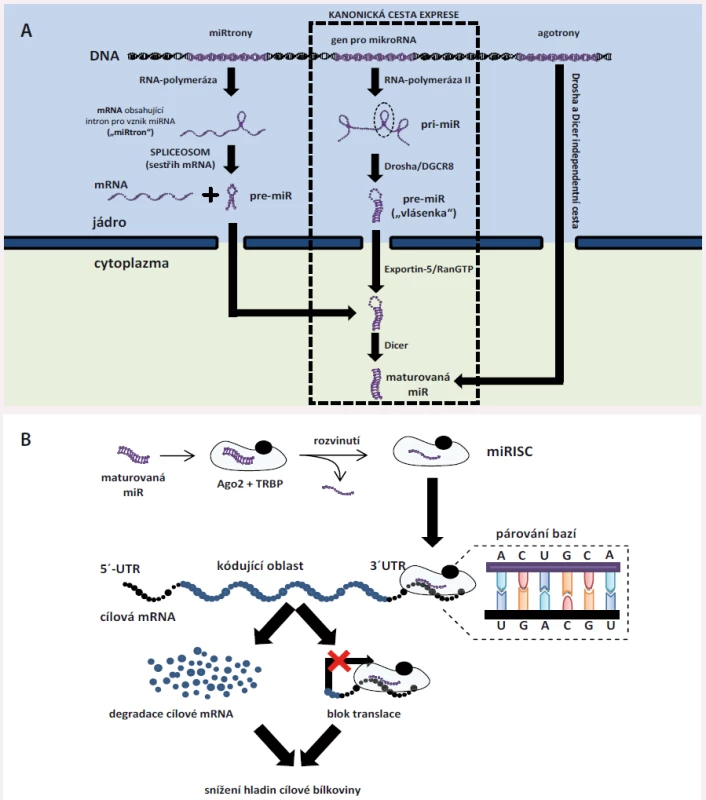
Vytvořený miRISC je zodpovědný za funkci miRNA v tzv. posttranskripční regulaci genové exprese (obr. 1B). miRNA mají 21 – 24 nukleotidů, avšak jen 2.–8. nukleotid představují tzv. seed region, který je zodpovědný za rozpoznávání cíle [7]. Rozpoznávání cíle probíhá na podkladě komplementarity bází – adenin se váže s uracilem a guanin se váže s cytozinem (A-U, C-G). miRISC cílí na molekuly messengerové RNA (mRNA), což jsou prekurzorové protein-kódující RNA zodpovědné za vznik proteinů. V těchto se nachází tzv. miRNA-response element (MRE), typicky v jejich 3’ nepřekládané oblasti. Vazba mezi miRISC a cílovou mRNA může mít dvojí následek – způsobí degradaci této mRNA (pokud je komplementarita bází úplná) nebo miRISC zabrání překladu cílové mRNA do bílkoviny – v obou případech tak dojde ke snížení hladiny proteinu, který daná mRNA kóduje [7]. Proto hovoříme o negativní (= snižuje se hladina proteinu) posttranskripční (působí po transkripci, tedy po přepisu DNA do mRNA) regulaci.
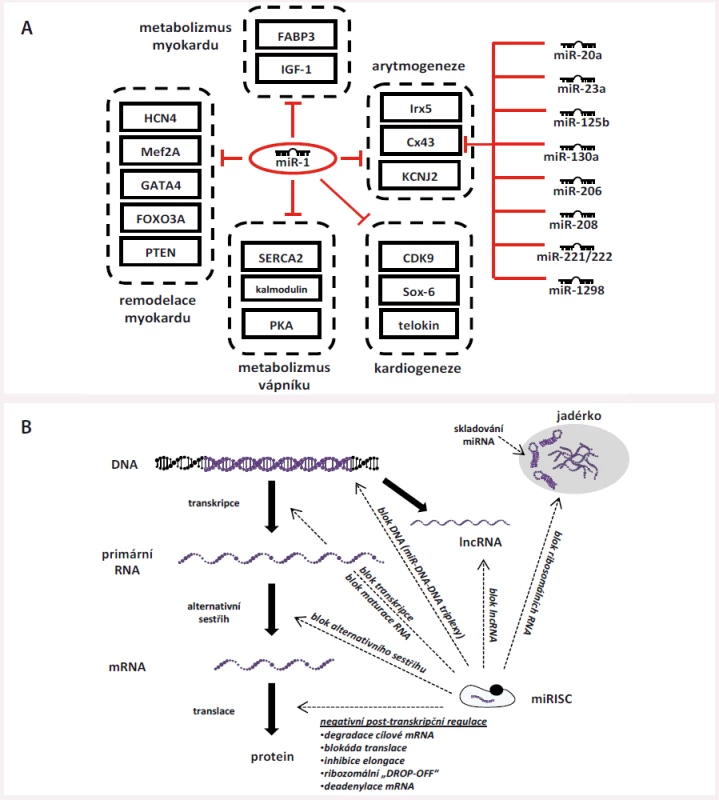
Regulace miRNA je vysoce komplexní a provázaná – jedna miRNA je schopna cílit na více mRNA zároveň a jedna mRNA může být regulována celou řadou různých miRNA (obr. 2A) [14] nebo se v ní dokonce může nacházet více MRE pro jednu a tu samou miRNA (např. tři vazebná místa pro miR-1 apod.). Na podkladě těchto faktů vznikají vysoce komplexní a propletené sítě, některé miRNA jsou vzájemně abundantní, jiné jsou pro správnou funkci buněk nezbytné. Výše popsaným způsobem miRNA jemně dolaďují genovou expresi v konkrétních tkáních s cílem udržet jejich správnou funkci a homeostázu nebo jsou schopny ji významným způsobem vychýlit při svém nadbytku/nedostatku, což se poté může uplatit při vzniku nemocí. Studie z posledních let také ukazují, že miRNA mají i řadu dalších funkcí, než jen těch popsaných výše, které pro úplnost uvádíme na obr. 2B, který byl vytvořen dle textu souhrnného článku Catallanoto et al [3].
Extracelulární miRNA a jejich funkce
Změny hladin intracelulárních miRNA ovlivňují genovou expresi, mění signalizaci uvnitř buněk, a významně tak ovlivňují buněčný metabolizmus, buněčný cyklus či správnou funkci buněk. V roce 2008 se však ukázalo, že miRNA je možné najít i za hranicí buněčné membrány – v krvi a jejích derivátech (plazmě, séru), ale také v moči či ve slinách [15,16]. miRNA nacházející se v extracelulárním prostoru jsou stabilní (jsou odolné vůči štěpícím enzymům nacházejícím se v plazmě), jejich hladiny lze reprodubicilně a opakovaně stanovit, a co je pro možné klinické využití nejdůležitější, jejich hladiny jsou nenáhodné a odrážejí děje odehrávající se uvnitř organizmu [15,17,18] – v současné době jsou proto studovány jako potencionální nové biomarkery.
V extracelulárním prostoru jsou miRNA uloženy v malých membránových váčcích (mikrovezikulách, exozomech) [19], v apoptotických tělíscích [20] či uvnitř lipoproteinových částic o vysoké a nízké hustotě (HDL a LDL) [21,22] a dále je možné je najít v komplexech s RNA-vazebnými proteiny, nejčastěji s proteinem Ago-2 [23], ale také např. s nukleofosminem (NMP1) [24]. V současné době se předpokládá, že se miRNA do extracelulárního prostoru dostávají dvěma hlavními mechanizmy – jsou do něj aktivně pumpovány (např. pomocí neutrální sfingomyelinázy 2 [25] či při vzniku mikrovezikul/ exozomů) nebo se do něj dostávají pasivně při zániku buněk (obr. 3).
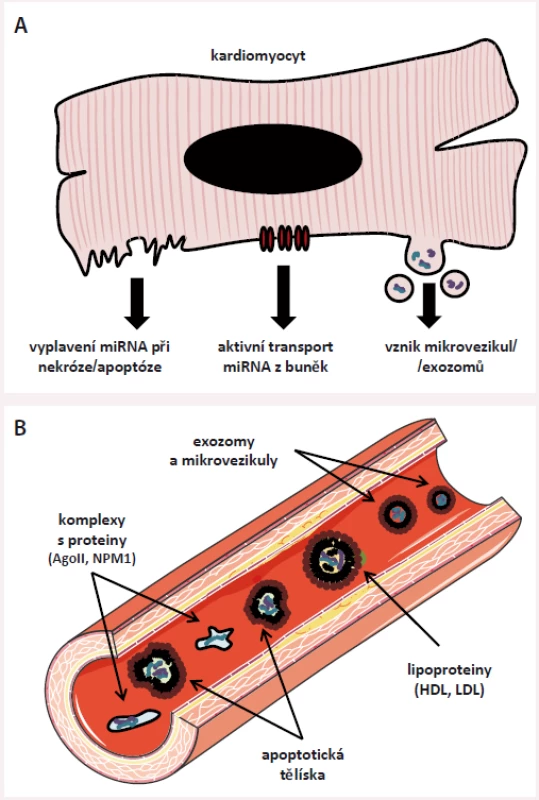
miRNA, které jsou do extracelulárního prostoru aktivně pumpovány nebo se do něj dostávají v podobě apoptotických tělísek, se podílejí na mezibuněčné komunikaci [26] – opakovaně bylo prokázáno, že miRNA produkované a uvolňované do extracelulárního prostoru jedním typem buněk jsou vychytávány v jiných buňkách, v nichž dokážou ovlivnit genovou expresi [27]. Např. fibroblasty přítomné v myokardu produkují vlivem tlakového přetížení či působením angiotenzinu II (dvou stresových faktorů rezultujících v hypertrofii myokardu) exozomy, které obsahují velké množství miR-21-3p; tyto exozomy jsou okolními kardiomyocyty vychytávány a miR-21 v nich aktivuje signalizační kaskády vedoucí k buněčné hypertrofii a fibróze [28]. Blokáda miR-21 dokázala u pokusných zvířat tuto hypertrofii alespoň částečně zvrátit, což otevírá nové možnosti terapie srdeční hypertrofie, potažmo srdečního selhání (SS) [28]. Další příklady mezibuněčné komunikace pomocí miRNA najdeme v procesu aterosklerózy. Během tohoto procesu dochází k zániku endotelií, mj. i apoptózou (programovanou buněčnou smrtí) – při apoptóze vznikají tzv. apoptotická tělíska a ta obsahují velká množství endotelově specifické miR-126; apoptotická tělíska jsou vychytávána v okolních endotelových buňkách, zvyšuje se v nich hladina miR-126, která následně blokuje protein RGS16, čímž je zvýšena produkce protizánětlivého cytokinu CXCR4 [20], který působí protektivně na zbývající endotel. Podobně působí i miR-223 přenášená v HDL. Z HDL je tato miRNA přenášena do endotelií, v nichž tlumí expresi intracelulární zánětlivé molekuly 1 (ICAM1), a tím rovněž snižuje zánětlivou odpověď, protože dochází k menší infiltraci endotelu leukocyty [21]. Tyto příklady jednoznačně ukazují, že extracelulární přenos miRNA je jedním z nových způsobů mezibuněčné komunikace, a jelikož je mezibuněčná komunikace u řady nemocí narušena, mohou změny v hladinách miRNA odrážet přítomnost či aktivitu daného onemocnění.
Jak bylo řečeno výše, tak kromě aktivního transportu se miRNA do cirkulace dostávají i pasivně, např. při nekróze tkání vlivem ischemie (např. u akutního infarktu myokardu (AIM) [29] nebo u ischemické cévní mozkové příhody [30]), či mechanickým (ať již při operacích, úrazech nebo i vlivem vysokého krevního tlaku [31]) nebo chemickým (např. vlivem léčiv [32]) postižením. Tyto miRNA se v krvi za normálních okolností nevyskytují a jejich přítomnost v cirkulaci proto odráží poškození orgánů, ze kterých pocházejí. Většina miRNA se sice vyskytuje ve všech tkáních, ale existují i miRNA, které se zvýšeně exprimují v některých tkáních – o těchto miRNA hovoříme jako o tkáňově specifických a právě tyto miRNA představují potenciální biomarkery tkáňového poškození [33]. Pro kardiologii asi nejznámějším příkladem jsou svalově specifické miR-1, miR-133, miR-208 a miR-499, které jsou v současné době intenzivně zkoumány jako nové potenciální biomarkery IM [29].
miRNA v patofyziologii a výhledy pro terapii a diagnostiku některých kardiovaskulárních nemocí
Ateroskleróza a IM
Ateroskleróza je multifaktoriální proces, během kterého dochází k ukládání lipidů do stěny tepen, což vede k jejich chronickému zánětu, remodelaci a ke vzniku aterosklerotických plátů – ruptura či přílišný nárůst těchto plátů může rezultovat např. v akutní koronární syndrom či v ischemickou cévní mozkovou příhodu; v dlouhodobém hledisku vede ateroskleróza k ischemickému poškození všech myslitelných orgánů na podkladě jejich sníženého prokrvení [34]. V procesu aterosklerózy je zapojena celá řada miRNA, které ovlivňují její jednotlivé patofyziologické dráhy – např. metabolizmus lipoproteinů a cholesterolu, zánětlivou reakci a cévní remodelaci [34].
Metabolizmus lipoproteinů a transport cholesterolu je regulován řadou miRNA, z nichž jmenujme např. miR-27b, miR-33, miR-148a nebo miR-223 [35]. Všechny tyto miRNA cílí na mRNA proteinů, které se přímo podílí na transportu cholesterolu z tkání jater (např. miR-33 snižuje hladiny proteinu ABCA1, který zajišťuje eflux cholesterolu z tkání do HDL [36]), z jater do žluči (v tomto procesu miR-33 cílí na ABCB11, což je transportér zajišťující přenos cholesterolu přes membránu hepatocytu do žlučových cest [37]) nebo jsou nezbytné pro vznik lipoproteinů (jedním z cílů miR-27b je např. apolipoprotein B nezbytný pro vznik VLDL, a tedy i LDL [38]) či pro jejich vychytávání v játrech (miR-148a reguluje v játrech vznik receptoru pro lipoproteiny o nízké hustotě, tedy LDL-receptoru [39], miR-223 cílí na scavengerové receptory, konkrétně na SRB1 (scavengerový receptor 1. typu třídy B)) [40]. Ovlivněním hladin těchto miRNA u pokusných zvířat bylo dosaženo zajímavých výsledků – blokáda miR-33 způsobila, že došlo ke zmenšení aterosklerotických plátů a zvýšení hladin cirkulujícího HDL až o 50 % [41], podobně pak blokáda miR-148a zvýšila clearance LDL částic v játrech [39]. V klinické praxi se můžeme setkat s mipomersenem – jedná se o „anti-sense terapii“ využívající jevu RNA-interference: mipomersen se velice podobně jako miR-27a cíleně váže v játrech na mRNA pro apolipoprotein B (apoB), což vede ke snížení hladin LDL a v dlouhodobém hledisku ke snížení kardiovaskulárních (KV) příhod u léčených pacientů [42].
Další doménu přispívající ke vzniku aterosklerózy – tedy zánět a přechod bílých krvinek z cirkulace do cévní stěny – regulují další miRNA. Výše již byl popsán význam v HDL částicích přenášené miR-223, která brání přestupu bílých krvinek do cévní stěny blokádou ICAM-1 [21], podobně funguje i miR-126 [43]. Další miRNA zapojenou do regulace zánětu je např. miR-181b, která přímo ovlivňuje signální kaskádu nukleárního faktoru kappa B (NFκB), a tím reguluje zánětlivou odpověď – její zablokování dokonce vedlo k zmenšení aterosklerotických plátů, aniž by se změnil lipidový profil pokusných zvířat [44], což naznačuje, že protizánětlivé strategie léčby aterosklerózy mohou být účinné i pokud se nepodaří snížit hladiny krevních lipidů.
Kromě patofyziologického a potenciálního terapeutického významu pak mají celé skupiny dalších miRNA diagnostický význam. Uzávěr koronárních tepen při AIM vede k vyplavení výše zmíněných v srdci bohatě se vyskytujících miRNA (miR-1, miR-133, miR-208 nebo miR-499), jejichž hladiny dobře korelují s hladinami troponinu, a je tak zřejmé, že odrážejí myokardiální poškození [29]. Nutno však podotknout, že senzitivita ani specificita těchto miRNA ve většině provedených studií nepřesáhla senzitivitu a specificitu troponinu [29] a také že praktické využití těchto miRNA v diagnostice AIM bude možné až po standardizaci laboratorních postupů a po významném zkrácení celého procesu stanovení hladin miRNA (v současné době je nezbytná izolace RNA, reverzní transkripce do molekuly komplementární DNA a poté polymerázová řetězová reakce v reálném čase (qRT-PCR), které společně trvají déle než 3 hodiny) [29].
V čem by se však cirkulující miRNA u AIM mohly uplatnit i bez zkrácení procesu stanovení, je predikce dalšího vývoje stavu u pacientů po AIM. Z krevních vzorků odebraných v průměru 18 dní po IM s ST elevacemi (STEMI) bylo možné identifikovat zvýšené hladiny tří miRNA (miR-34a, miR-192 a miR-194), které predikovaly vznik SS do jednoho roku od prodělání STEMI [45). Stejná skupina autorů popsala i další miRNA, konkrétně miR-155 a miR-380, které predikovaly náhlou srdeční smrt pacientů po STEMI do jednoho roku od propuštění z nemocnice [46]. Jiní autoři popsali podobný význam zvýšených cirkulujících hladin miR-328 a miR-134 [47] a další autoři popisují možnost využití miR-16, miR-27a, miR-101 a miR-150 spolu s klinickými charakteristikami (anteriorní AIM a elevace NT-proBNP) v predikci vzniku poruchy kontraktility u pacientů šest měsíců po AIM [48]. Výsledky těchto pilotních studií musí být potvrzeny na větších kohortách pacientů, ale pokud se potvrdí, mohly by miRNA představovat nezávislé prediktory přežití pacientů po AIM, a umožnit tak jejich lepší stratifikaci a sledování.
Srdeční selhání
SS představuje komplexní syndrom charakterizovaný neschopností srdce pokrýt metabolické nároky jednotlivých tkání. Rizikových faktorů vedoucích ke vzniku SS je celá řada, ať se již jedná o ischemickou chorobu srdeční, hypertenzi, diabetes mellitus, fibrilace síní (FS), chlopenní vady či dilatační kardiomyopatii jako konečný fenotyp celé řady dalších onemocnění. Tato vysoká heterogenita je pravděpodobně příčinou toho, že se stále nedaří nalézt „jednoznačný podpis“, tedy profil několika konkrétních miRNA, který by byl pro SS specifický [49]. Recentní souhrnný článek popisující význam miRNA u SS shrnuje poznatky z 21 studií a vyzdvihuje 13 miRNA (miR-1, miR-21, miR-30a, miR-92a, miR-124-3p, miR-126, miR-150, miR-195, miR-210, miR-342-3p, miR-423-5p, miR-499-5p a miR-622), u nichž byla i přes značnou heterogenitu zkoumaných kohort opakovaně (minimálně ve dvou nezávislých studiích) pozorována změněná exprese, a mohly by tak být zapojeny do drah, které jsou pro SS společné různým patologiím [49]. Z uvedených se např. miR-21 a miR-29 spojují s fibrózou myokardu, miR-1 a miR-30a s hypertrofií a miR-195 a miR-499-5p s procesem apoptózy [49] – tedy s procesy, o nichž je známo, že probíhají v selhávajícím myokardu. Další miRNA byly v animálních experimentech či s využitím buněčných kultur identifikovány jako potenciální regulátory funkce natriuretických peptidů (NP) nebo renin-angiotenzin-aldosteronového systému (RAAS). Např. syntéza atriálního natriuretického peptidu (ANP) je přímo regulována miR-425 [50], receptor pro NP typu 3 (NPR3) je zase cílem miR-100 [51] a receptor typu 1 pro angiotenzin II (AT1R) je cílem miR-155 [52]. Terapeutické ovlivnění obou uvedených systémů představuje první krok léčby SS pomocí sakubitril-valsartanu [53] a nové terapeutické postupy cílící na některou z výše uvedených miRNA by mohly v budoucnu přispět k individuálnímu nastavení terapie jednotlivých pacientů.
Co se týče diagnostiky SS pomocí miRNA, nebyl zatím popsán jednoznačný profil, který by byl pro diagnózu SS více specifický než v současnosti užívané stanovení NT [49]. Watson et al však identifkovali pět sérových miRNA (miR-30c, miR-146a, miR-221, miR-328 a miR-375) a Nair et al identifikovali dalších pět miRNA vyizolovaných z buffy-coatu (tedy zejména leukocytárních; konkrétně miR-124-5p, miR-142-3p, miR-454, miR-500 a miR-1246), které dokázaly rozlišit pacienty se zachovalou a redukovanou ejekční frakcí, a mohly by tak sloužit jako biomarkery diastolické dysfunkce [54,55]. Zaměříme-li se na prognostické markery, tak zatím asi doposud největší studie zahrnující na 1 000 pacientů prokázala, že snížené hladiny miR-423-5p predikují horší prognózu u pacientů prezentujících se s akutní dušností, u nichž byla následně stanovena diagnóza akutního SS. Horší prognóza byla definována jako četnější následné hospitalizace pro SS nebo vyšší mortalita v prvním roce [56].
Specifickou oblastí, kde by miRNA mohly najít své uplatnění, je terminální SS a transplantace srdce – pacienti po transplantaci srdce jsou zejména v prvních měsících od výkonu vystaveni riziku odmítnutí štěpu (akutní celulární rejekce), současné preventivní postupy proto zahrnují sérii pravidelných klinických prohlídek, jejichž nedílnou součástí je endomyokardiální biopsie se zhodnocením stupně rejekce v odebraném vzorku [57]; neinvazivní marker rejekce v současné době ještě neexistuje. Dvě studie zaměřující se na stanovení cirkulujících miRNA již prokázaly, že sérové hladiny vybraných miRNA (konkrétně miR-27a, miR-101, miR-142-3p, miR-144, miR-326 a miR-424 v první studii [58] a miR-10a, miR-31, miR-92a a miR-155 v druhé studii [59]) odlišují pacienty s akutní celulární rejekcí od pacientů bez rejekce. Pravidelné sledování hladin těchto miRNA by tak mohlo v budoucnu sloužit k neinvazivní monitoraci rejekce bez nutnosti invazivní endomyokardiální biopsie.
Fibrilace síní
FS představuje nejčastější supraventrikulární setrvalou arytmii, jejíž incidence se stárnutím populace stoupá [60]. V patofyziologii FS se uplatňuje celá řada procesů, které lze shrnout pod pojmy elektrické a strukturální remodelace. Oba tyto procesy vedou ke zkrácení efektivní refrakterní periody, zkrácení trvání akčního potenciálu, a to následně favorizuje vznik re-entry [61].
První studie věnující se problematice miRNA a FS se zaměřily (jako většina kardiologických studií) na miRNA, které jsou abundantně exprimovány v srdci, konkrétně na miR-1 [62]. U pacientů podstupujících kardiochirurgický výkon byly odebrány vzorky síňového myokardu a prokázalo se, že miR-1 je v síňovém myokardu pacientů se známou FS o 86 % méně exprimována ve srovnání s pacienty bez FS. Snížení miR-1 také korelovalo se zvýšením hladin draselného kanálu Kir2.1 (KCNJ2; který je jejím mechanistickým cílem), a to vedlo k zesílení IK1 proudu, o němž je známo, že se na patofyziologii FS podílí [63]. Podobně se pak miR-1 podílí na regulaci exprese srdečních konexinů nezbytných pro správné šíření vzruchu mezi kardiomyocyty (přímým cílem je konexin-43) [64]. Na regulaci exprese Kir2.1 se dále podílí miR-26 (u pacientů s FS rovněž downregulovaná) [65] a další draslíkový kanál KCNN3 je zase regulován miR-499, jejíž exprese je u pacientů s FS zvýšená [66]. Kromě draslíkových kanálů bylo prokázáno, že miRNA regulují i hladiny kanálů pro vápenaté ionty – např. miR-328, zvýšená v myokardu u pacientů s FS, cílí na CACNA1C a CACNB, čímž snižuje jejich expresi, a zkracuje tak trvání akčního potenciálu [67]. Po elektrickém remodelování přichází remodelování strukturální, kdy dochází k přestavbě síně a jehož nedílnou součástí je vznik fibrózy. Do procesu fibrotizace je rovněž zapojena celá řada miRNA – např. miR-30 reguluje hladiny růstového faktoru pojivové tkáně (conective tissue growth factor – CTGF) [68], miR-29 přímo reguluje hladinu proteinů nezbytných k vytvoření kolagenu [69] a v neposlední řadě již dříve v textu zmíněná miR-21 reguluje přežití fibroblastů tím, že cílí na protein Sprouty 1 [70]. Hladiny miR-30 a miR-29 jsou v srdcích u pacientů s FS sníženy (což mechanisticky vede ke zvýšení zmiňovaného CTGF a produkce kolagenu), hladiny miR-21 jsou sníženy (čímž je zvýšeno přežívání fibroblastů) [68 – 70].
Kromě studií zaměřených na srdeční tkáň, a tedy zejména na bližší pochopení patofyziologie FS, pak existují i studie, které se zaobíraly možným diagnostickým využitím miRNA – hladiny zmiňovaných miR-21, miR-29 či miR-328 jsou v plazmě jedinců s FS sníženy [69,71]; podobně jsou sníženy i hladiny dalších miRNA, např. miR-150, miR-409-3p nebo miR-432 [71,72]. Při porovnání jedinců s paroxysmální a perzistující FS se dokonce ukazuje, že hladiny miR-21 a miR-150 jsou nižší u jedinců s paroxysmální FS [71] a v neposlední řadě bylo prokázáno, že hladiny miR-21, miR-150, miR-409-3p a miR-432 se po katetrové ablaci vracejí k normálním hodnotám [71,72], a lze tedy předpokládat, že změny jejich plazmatických hladin skutečně odrážejí přítomnost/nepřítomnost FS.
Hypertenze
Hypertenze představuje nejčastěji se vyskytující rizikový faktor KV onemocnění a její etiopatogeneze není stále zcela objasněna, i když je známa řada rizikových faktorů, které vedou ke zvýšení a následné fixaci elevovaného TK. miRNA do patogeneze hypertenze zasahují hned na několika úrovních [73,74]. Na úrovni endoteliální dysfunkce je známa řada miRNA, které se podílejí na regulaci adhezivních molekul pro leukocyty (viz výše), čímž ovlivňují intaktnost endotelu a přestup bílých krvinek do cévní stěny [21]; jiné miRNA, např. klastr miR-143/ 145, reagují na změny v proudění krve, což ovlivňuje hladiny endotelem produkovaných působků – konkrétně změna laminárního proudění krve na turbulentní a zvýšení tzv. shear stressu vede ke zvýšení hladin této miRNA, což mechanisticky způsobí snížení hladin angiotenzin-konvertujícího enzymu (ACE) a narušení vazodilatace mediované bradykininem [75]. Přes řadu dalších kroků se tato miRNA navíc podílí na udržení tzv. kontraktilního fenotypu hladkosvalových buněk cévní stěny – jsou-li hladiny této miRNA dysregulovány, přecházejí hladkosvalové buňky cévní stěny do fenotypu proliferativního (dochází k cévní remodelaci), a nejsou tak schopny plnit svou funkci v regulaci TK [75]. Další miRNA, miR-155, zasahuje do regulace TK rovněž na dvou úrovních – jedním z jejích mechanistických cílů je AT1R [52], druhým je jeden z hlavních producentů oxidu dusnatého (NO), tedy endoteliální NO-syntáza (eNOS) [76]. miR-155 je považována za miRNA spojovanou se zánětem [77] a chronický zánět endotelu je rovněž považován za jednoho z přispěvatelů endotelové dysfunkce a hypertenze [73].
Velice zajímavé výsledky pak přináší i humánní studie, kdy byly v krvi u pacientů s hypertenzí nalezeny zvýšené hladiny, kromě řady lidských miRNA, miRNA pocházející z cytomegaloviru (CMV) – hcmv-miR-UL112 [78]. Tento nález otevírá možnost, že by hypertenze mohla být spojena s infekcí CMV, avšak nelze z něj posoudit kauzalitu, tj. nelze říci, zda je tato miRNA vyplavována z poškozených buněk vlivem hypertenze nebo zda je CMV infekce primární inzult vedoucí ke zvýšení TK. Mechanisticky je zde možný následující vztah: jedním z cílů hcmv-miR-UL112 je interferon regulující faktor 1 (IRF-1), o němž je známo, že reguluje hladiny AT2R a že je spojený s indukcí syntézy NO v kardiomyocytech [74]. Snížení IRF-1 pomocí hcmv-miR-UL112 by proto mohlo vést ke snížení hladin AT2R (jehož aktivace je považována za kardioprotektivní a což by mohlo vést k vychýlení rovnováhy AT1R × AT2R ve prospěch vazokonstrikčního působení AT1R) a rovněž by mohl snižovat hladiny NO, a tím vést k poruše vazodilatace [74]. V oblasti hypertenze se zatím jedná o pilotní studie, ale lze předpokládat, že nám miRNA mohou pomoci osvětlit některé stále nejasné patofyziologické aspekty vedoucí k elevaci TK, které by potenciálně mohly být využitelné při stratifikaci rizika u pacientů nebo k vytvoření nových terapeutických přístupů.
Chlopenní vady
Chlopenní vady postihují přibližně 2,7 % populace, přičemž v kohortě pacientů nad 75 let může jít i o více než 13 % jedinců [79]. Nejvíce pozornosti bylo ve studiích zaměřených na význam miRNA u chlopenních vad věnováno problematice aortální stenózy a méně pak mitrálním vadám. U aortální stenózy je známo, že postupně se rozvíjející změny na úrovni kolagenních vláken způsobují tuhnutí jednotlivých cípů, což vede k biomechanickým a hemodynamickým změnám, jejichž následkem je další poškození chlopně, její postupná kalcifikace, infiltrace makrofágy, přestavba extracelulární matrix a akumulace lipidů [80]. Změny průtoku se poté projevují i v levé komoře, která se pozvolna remodeluje (ve smyslu hypertrofie a fibrózy). Jelikož u jedinců s bikuspidní aortální chlopní dochází k častějšímu rozvoji aortální stenózy, byla provedena analýza miRNA přímo v bikuspidních a trikuspidních aortálních cípech (získaných při kardiochirurgických zákrocích) a ukázalo se, že exprese 35 různých miRNA je mezi cípy změněná [81]. Další výsledky pak přináší porovnání kalcifikované chlopně a nekalcifikované okolní tkáně či nekalcifikovaných chlopní, které odhalilo snížení hladin miR-30b, miR-374b, miR-602 a miR-939 a zvýšení hladin miR-125b [82,83]. Analýzy okolního hypertrofovaného myokardu zase ukázaly snížení hladin srdeční miR-1, které se však normalizovaly po náhradě aortální chlopně (AVR) [84].
Řada studií se rovněž zaměřila na cirkulující miRNA a jejich diagnostický a prognostický význam u aortální stenózy, a to se zajímavými výsledky – porovnání pacientů s různými typy hypertrofie (s hypertrofickou obstrukční a neobstrukční kardiomyopatií a s hypertrofií na podkladě aortální stenózy) ukázalo, že miR-29c je specificky zvýšena jen u pacientů s aortální stenózou [85]. Hladiny jiných miRNA korelují s různými echokardiografickými, laboratorními či klinickými parametry – hladiny miR-21 korelují s transvalvulárním gradientem a mírou fibrózy myokardu [86], hladiny miR-387 korelují s LV mass indexem a dokonce slouží jako nezávislé prediktory hypertrofie [87], hladiny miR-1 zase negativně korelují s vyplavováním FABP3 [84] a zvýšené hladiny miR-210 jsou asociované s vyšší mortalitou (follow-up 3,5 roku) [88].
Co se týče mitrální chlopně, bylo provedeno jen několik málo studií, které se zaměřily na porovnání myxomatózní degenerace mitrální chlopně a fibroelastické deficience, při nichž autoři identifikovali rozdíly v expresi minimálně 10 miRNA, které společně ovlivňují expresi jednotlivých strukturálních složek mitrální chlopně (např. fibromodulinu, alfa-aktinu, proteinů extracelulární matrix a dalších) [89]. Studie zaměřující se na cirkulující miRNA byly zatím provedeny pouze na psích modelech, které ukazují, že plazmatická exprese vybraných miRNA se liší mezi pokusnými zvířaty s již rozvinutou hypertrofií bez SS a s již manifestním SS [90].
Další oblasti
Na animálních modelech je nyní studován význam miRNA u myokarditid [91]. Jiné studie se zaměřují na možné využití miRNA v diagnostice kardiomyopatií – např. miR-3135b, miR-3908 a miR-5571-5p jsou zvýšeny v cirkulaci u pacientů s dilatační kardiomyopatií (ve srovnání se zdravými kontrolami) [92], zvýšené hladiny miR-185 mají u těchto pacientů pozitivní prognostický význam, protože po roční kontrole pacienti s vyššími vstupními hladinami miR-185 vykazují zlepšení v systolické funkci srdce, snížení NT-proBNP a také méně hospitalizací pro SS a nižší mortalitu [93]. Velké množství výzkumů se věnuje problematice plicní hypertenze a jejímu možnému terapeutickému ovlivnění [94]. Podobné příklady by pak bylo možné najít ve všech ostatních oblastech kardiologie.
Závěr
miRNA jsou sice malé svou velikostí, ale mohou být velké svým významem. Jejich studium přináší nové pohledy na patofyziologii KV nemocí. Experimenty na buněčných kulturách či na animálních modelech ukazují na jejich možný terapeutický potenciál a jejich přítomnost v cirkulaci a fakt, že jejich hladiny odrážejí děje odehrávající se uvnitř organizmu, z nich dělají slibné biomarkery užitečné v diagnostice, diferenciální diagnostice či při odhadu prognózy konkrétního pacienta. Jejich užití v každodenní klinické praxi je stále hudbou budoucnosti, neboť je nutné vyřešit celou řadu technologických a praktických problémů, které s sebou každá nová výzkumná oblast přináší (např. je nutné nalézt vhodné vnitřní kontroly pro normalizaci hladin miRNA, které zlepší vzájemné porovnávání výsledků mezi různými výzkumnými týmy; dále je nutné urychlit celý proces izolace a stanovení, je nezbytné aktuální výsledky pilotních studií ověřit na větších kohortách a provést více studií porovnávajících pacienty se stejnými symptomy, nejen jedince s danou nemocí a zdravé kontroly, je nutné zjistit, jak se mění hladiny miRNA vlivem léčiv apod.). Budoucí výzkum také může ukázat, že vzhledem ke komplexnosti KV nemocí nebude možné miRNA v klinické praxi využít jinak než u několika málo specifických případů. Pokud se však výsledky pilotních pozorování potvrdí, lze předpokládat, že si miRNA možná jednoho dne najdou své místo v doporučených postupech, ať již jako nové působky biologické léčby nebo jako diagnostické či prognostické markery.
Poděkování
Podpořeno projektem „Cirkulující mikroRNA jako neinvazivní markery rejekce štěpu u pacientů po srdeční transplantaci“ podpořeného Agenturou pro zdravotnický výzkum ČR (registrační číslo 16-30537A).
Doručeno do redakce: 22. 11. 2016
Přijato po recenzi: 1. 12. 2016
MUDr. Jan Novák
www.fnusa.cz
jan.novak@fnusa.cz
Zdroje
1. Djebali S, Davis CA, Merkel A et al. Landscape of transcription in human cells. Nature 2012; 489(7414): 101 – 108. doi: 10.1038/ nature11233.
2. Grant B. The safe-neighborhood hypothesis of junk DNA. J Theor Biol 1981; 90(1): 149 – 150.
3. Catalanotto C, Cogoni C, Zardo G. MicroRNA in control of gene expression: an overview of nuclear functions. Int J Mol Sci 2016; 17(10): pii E1712.
4. Valadkhan S, Gunawardane LS. Role of small nuclear RNAs in eukaryotic gene expression. Essays Biochem 2013; 54 : 79 – 90. doi: 10.1042/ bse0540079.
5. Stepanov GA, Filippova JA, Komissarov AB et al. Regulatory role of small nucleolar RNAs in human diseases. Bio Med Res Int 2015; 2015 : 206849. doi: 10.1155/ 2015/ 206849.
6. Iwasaki YW, Siomi MC, Siomi H. PIWI-Interact-ing RNA: Its Biogenesis and Functions. Annu Rev Biochem 2015; 84 : 405 – 433. doi: 10.1146/ annurev--biochem-060614-034258.
7. Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 2004; 116(2): 281 – 297.
8. Kozomara A, Griffiths-Jones S. miRBase: annotating high confidence microRNAs using deep sequencing data. Nucleic Acids Res 2014; 42(Database issue): D68 – D73. doi: 10.1093/ nar/ gkt1181.
9. Fromm B, Billipp T, Peck LE et al. A Uniform System for the Annotation of Vertebrate microRNA Genes and the Evolution of the Human micro-RNAome. Annu Rev Genet 2015; 49 : 213 – 242. doi: 10.1146/ annurev-genet-120213-092023.
10. Desvignes T, Batzel P, Berezikov E et al. miRNA Nomenclature: a view incorporating genetic origins, biosynthetic pathways, and sequence variants. Trends Genet 2015; 31(11): 613 – 626. doi: 10.1016/ j.tig.2015.09.002.
11. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75(5): 843 – 854.
12. Pasquinelli AE, Reinhart BJ, Slack F et al. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature 2000; 408(6808): 86 – 89.
13. Esteller M. Non-coding RNAs in human disease. Nat Rev Genet 2011; 12(12): 861 – 874. doi: 10.1038/ nrg3074.
14. Lim LP, Lau NC, Garrett-Engele P et al. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs. Nature 2005; 433(7027): 769 – 773.
15. Chen X, Ba Y, Ma L et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res 2008; 18(10): 997 – 1006. doi: 10.1038/ cr.2008.282.
16. Weber JA, Baxter DH, Zhang S et al. The microRNA spectrum in 12 body fluids. Clin Chem 2010; 56(11): 1733 – 1741. doi: 10.1373/ clinchem.2010.147405.
17. Gilad S, Meiri E, Yogev Y et al. Serum microRNAs are promising novel biomarkers. PloS One 2008; 3(9): e3148. doi: 10.1371/ journal.pone.0003148.
18. Mitchell PS, Parkin RK, Kroh EM et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci U S A 2008; 105(30): 10513 – 10518. doi: 10.1073/ pnas.0804549105.
19. Turchinovich A, Weiz L, Langheinz A et al. Characterization of extracellular circulating microRNA. Nucleic Acids Res 2011; 39(16): 7223 – 7233. doi: 10.1093/ nar/ gkr254.
20. Zernecke A, Bidzhekov K, Noels H et al. Delivery of microRNA-126 by apoptotic bodies induces CXCL12-dependent vascular protection. Sci Signal 2009; 2(100): 81. doi: 10.1126/ scisignal.2000610.
21. Tabet F, Vickers KC, Cuesta Torres LF et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nat Commun 2014; 5 : 3292. doi: 10.1038/ ncomms4292.
22. Vickers KC, Palmisano BT, Shoucri BM et al. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nat Cell Biol 2011; 13(4): 423 – 433. doi: 10.1038/ ncb2210.
23. Arroyo JD, Chevillet JR, Kroh EM et al. Argonaute 2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma. Proc Natl Acad Sci U S A 2011; 108(12): 5003 – 5008. doi: 10.1073/ pnas.1019055108.
24. Wang K, Zhang S, Weber J et al. Export of microRNAs and microRNA-protective protein by mammalian cells. Nucleic Acids Res 2010; 38(20): 7248 – 7259. doi: 10.1093/ nar/ gkq601.
25. Kosaka N, Iguchi H, Yoshioka Y et al. Secretory mechanisms and intercellular transfer of microRNAs in living cells. J Biol Chem 2010; 285(23): 17442 – 17452. doi: 10.1074/ jbc.M110.107821.
26. Zhu H, Fan GC. Extracellular/ circulating microRNAs and their potential role in cardiovascular disease. Am J Cardiovasc Dis 2011; 1(2): 138 – 149.
27. Valadi H, Ekström K, Bossios A et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 200; 9(6): 654 – 659.
28. Bang C, Batkai S, Dangwal S et al. Cardiac fibroblast - derived microRNA passenger strand-enriched exosomes mediate cardiomyocyte hypertrophy. J Clin Invest 2014; 124(5): 2136 – 2146. doi: 10.1172/ JCI70577.
29. Navickas R, Gal D, Laucevičius A et al. Identifying circulating microRNAs as biomarkers of cardiovascular disease: a systematic review. Cardiovasc Res 2016; 111(4): 322 – 337. doi: 10.1093/ cvr/ cvw174.
30. Volný O, Kašičková L, Coufalová D et al. microRNAs in cerebrovascular disease. Adv Exp Med Biol 2015; 888 : 155 – 195. doi: 10.1007/ 978-3-319-22671-2_9.
31. Romaine SP, Charchar FJ, Samani NJ et al. Circulating microRNAs and hypertension-from new insights into blood pressure regulation to biomarkers of cardiovascular risk. Curr Opin Pharmacol 2016; 27 : 1 – 7. doi: 10.1016/ j.coph.2015.12.002.
32. Nishimura Y, Kondo C, Morikawa Y et al. Plasma miR-208 as a useful biomarker for drug-induced cardiotoxicity in rats. J Appl Toxicol 2015; 35(2): 173 – 180. doi: 10.1002/ jat.3044.
33. Heggermont WA, Heymans S. MicroRNAs are involved in end-organ damage during hypertension. Hypertension 2012; 60(5): 1088 – 1093. doi: 10.1161/ HYPERTENSIONAHA.111.187104.
34. Feinberg MW, Moore KJ. MicroRNA regulation of atherosclerosis. Circ Res 2016; 118(4): 703 – 720. doi: 10.1161/ CIRCRESAHA.115.306300.
35. Novák J, Bienertová-Vašků J, Kára T et al. MicroRNAs involved in the lipid metabolism and their possible implications for atherosclerosis development and treatment. Mediators Inflamm 2014; 2014 : 275867. doi: 10.1155/ 2014/ 275867.
36. Najafi-Shoushtari SH, Kristo F, Li Y et al. MicroRNA-33 and the SREBP host genes cooperate to control cholesterol homeostasis. Science 2010; 328(5985): 1566 – 1569. doi: 10.1126/ science.1189123.
37. Allen RM, Marquart TJ, Albert CJ et al. miR-33 cont-rols the expression of biliary transporters, and mediates statin - and diet-induced hepatotoxicity. EMBO Mol Med 2012; 4(9): 882 – 895. doi: 10.1002/ emmm.201201228.
38. Vickers KC, Shoucri BM, Levin MG et al. MicroRNA-27b is a regulatory hub in lipid metabolism and is altered in dyslipidemia. Hepatol 2013; 57(2): 533 – 542. doi: 10.1002/ hep.25846.
39. Goedeke L, Rotllan N, Canfrán-Duque A et al. MicroRNA-148a regulates LDL receptor and ABCA1 expression to control circulating lipoprotein levels. Nat Med 2015 21(11): 1280 – 1289. doi: 10.1038/ nm.3949.
40. Vickers KC, Landstreet SR, Levin MG et al. MicroRNA-223 coordinates cholesterol homeostasis. Proc Natl Acad Sci U S A 2014; 111(40): 14518 – 14523. doi: 10.1073/ pnas.1215767111.
41. Rayner KJ, Sheedy FJ, Esau CC et al. Antagonism of miR-33 in mice promotes reverse cholesterol transport and regression of atherosclerosis. J Clin Invest 2011; 121(7): 2921 – 2931. doi: 10.1172/ JCI57275.
42. Duell PB, Santos RD, Kirwan BA et al. Long-term mipomersen treatment is associated with a reduction in cardiovascular events in patients with familial hypercholesterolemia. J Clin Lipidol 2016; 10(4): 1011 – 1021. doi: 10.1016/ j.jacl.2016.04.013.
43. Harris TA, Yamakuchi M, Ferlito M et al. MicroRNA-126 regulates endothelial expression of vascular cell adhesion molecule 1. Proc Natl Acad Sci U S A 2008; 105(5): 1516 – 15121. doi: 10.1073/ pnas.0707493105.
44. Sun X, He S, Wara AK et al. Systemic delivery of microRNA-181b inhibits nuclear factor-κB activation, vascular inflammation, and atherosclerosis in apolipoprotein E-deficient mice. Circ Res 2014; 114(1): 32 – 40. doi: 10.1161/ CIRCRESAHA.113.302089.
45. Matsumoto S, Sakata Y, Suna S et al. Circulating p53-Responsive MicroRNAs are predictive indicators of heart failure after acute myocardial infarction short communication. Circ Res 2013; 113(3): 322 – 326. doi: 10.1161/ CIRCRESAHA.113.301209.
46. Matsumoto S, Sakata Y, Nakatani D et al. A subset of circulating microRNAs are predictive for cardiac death after discharge for acute myocardial infarction. Biochem Biophys Res Commun 2012; 427(2): 280 – 284. doi: 10.1016/ j.bbrc.2012.09.039.
47. He F, Lv P, Zhao X et al. Predictive value of circulating miR-328 and miR-134 for acute myocardial infarction. Mol Cell Biochem 2014; 394(1 – 2): 137 – 144. doi: 10.1007/ s11010-014-2089-0.
48. Devaux Y, Vausort M, McCann GP et al. A panel of 4 microRNAs facilitates the prediction of left ventricular contractility after acute myocardial infarction. PloS One 2013; 8(8): e70644. doi: 10.1371/ journal.pone.0070644.
49. Wong LL, Wang J, Liew OW et al. MicroRNA and Heart Failure. Int J Mol Sci 2016; 17(4): 502. doi: 10.3390/ ijms17040502.
50. Arora P, Wu C, Khan AM, Bloch DB et al. Atrial natriuretic peptide is negatively regulated by microRNA-425. J Clin Invest 2013; 123(8): 3378 – 3382. doi: 10.1172/ JCI67383.
51. Wong LL, Wee AS, Lim JY et al. Natriuretic peptide receptor 3 (NPR3) is regulated by microRNA-100. J Mol Cell Cardiol 2015; 82 : 13 – 21. doi: 10.1016/ j.yjmcc.2015.02.019.
52. Ceolotto G, Papparella I, Bortoluzzi A et al. Interplay between miR-155, AT1R A1166C polymorphism, and AT1R expression in young untreated hypertensives. Am J Hypertens 2011; 24(2): 241 – 246. doi: 10.1038/ ajh.2010.211.
53. Vítovec J, Špinarová L, Špinar J. Sacubitril-valsartan (LCZ696) in the treatment of heart failure. Kardiol Rev Int Med 2016; 18(2): 125 – 128.
54. Watson CJ, Gupta SK, O’Connell E et al. MicroRNA signatures differentiate preserved from reduced ejection fraction heart failure. Eur J Heart Fail 2015; 17(4): 405 – 415. doi: 10.1002/ ejhf.244.
55. Nair N, Kumar S, Gongora E et al. Circulating miRNA as novel markers for diastolic dysfunction. Mol Cell Biochem 2013; 376(1 – 2): 33 – 40. doi: 10.1007/ s11010-012-1546-x.
56. Seronde MF, Vausort M, Gayat E et al. Circulating microRNAs and outcome in patients with acute heart failure. PloS One 2015; 10(11): e0142237. doi: 10.1371/ journal.pone.0142237.
57. Berry GJ, Burke MM, Andersen C et al. The 2013 International Society for Heart and Lung Transplantation Working Formulation for the standardization of nomenclature in the pathologic diagnosis of antibody-mediated rejection in heart transplantation. J Heart Lung Transplant 2013; 32(12): 1147 – 1162. doi: 10.1016/ j.healun.2013.08.011.
58. Sukma Dewi I, Torngren K, Gidlöf O et al. Altered serum miRNA profiles during acute rejection after heart transplantation: potential for non-invasive allograft surveillance. J Heart Lung Transplant 2013; 32(4): 463 – 466. doi: 10.1016/ j.healun.2012.12.007.
59. Duong Van Huyen JP, Tible M, Gay A et al. MicroRNAs as non-invasive biomarkers of heart transplant rejection. Eur Heart J 2014; 35(45): 3194 – 3202. doi: 10.1093/ eurheartj/ ehu346.
60. Riley AB, Manning WJ. Atrial fibrillation: an epidemic in the elderly. Expert Rev Cardiovasc Ther 2011; 9(8): 1081 – 1090. doi: 10.1586/ erc.11.107.
61. Santulli G, Iaccarino G, De Luca N et al. Atrial fibrillation and microRNAs. Front Physiol 2014; 5 : 15. doi: 10.3389/ fphys.2014.00015.
62. Girmatsion Z, Biliczki P, Bonauer A et al. Changes in microRNA-1 expression and IK1 up-regulation in human atrial fibrillation. Heart Rhythm 2009; 6(12): 1802 – 1809. doi: 10.1016/ j.hrthm.2009.08.035.
63. Musa H, Carlton L, Klos M et al. Arrhythmogenesis in a novel murine model with KCNJ2 mutation of familial atrial fibrillation. Heart Rhythm 2013; 10(11): 1749. doi: 10.1016/ j.hrthm.2013.09.077.
64. Zhang Y, Sun L, Zhang Y et al. Overexpression of microRNA-1 causes atrioventricular block in rodents. Int J Biol Sci 2013; 9(5): 455 – 462. doi: 10.7150/ ijbs.4630.
65. Luo X, Pan Z, Shan H et al. MicroRNA-26 governs profibrillatory inward-rectifier potassium current changes in atrial fibrillation. J Clin Invest 2013; 123(5): 1939 – 1951. doi: 10.1172/ JCI62185.
66. Ling TY, Wang XL, Chai Q et al. Regulation of the SK3 channel by microRNA-499 – potential role in atrial fibrillation. Heart Rhythm 2013; 10(7): 1001 – 1009. doi: 10.1016/ j.hrthm.2013.03.005.
67. Lu Y, Zhang Y, Wang N et al. MicroRNA-328 contributes to adverse electrical remodeling in atrial fibrillation. Circulation 2010; 122(23): 2378 – 2387. doi: 10.1161/ CIRCULATIONAHA.110.958967.
68. Duisters RF, Tijsen AJ, Schroen B et al. miR-133 and miR-30 regulate connective tissue growth factor: implications for a role of microRNAs in myocardial matrix remodeling. Circ Res 2009; 104(2): 170 – 178, 6p following 178. doi: 10.1161/ CIRCRESAHA.108.182535.
69. Dawson K, Wakili R, Ordög B et al. MicroRNA29: a mechanistic contributor and potential biomarker in atrial fibrillation. Circulation 2013; 127(14): 1466 – 1475. doi: 10.1161/ CIRCULATIONAHA.112.001207.
70. Thum T, Gross C, Fiedler J et al. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts. Nature 2008; 456(7224): 980 – 984. doi: 10.1038/ nature07511.
71. McManus DD, Tanriverdi K, Lin H et al. Plasma microRNAs are associated with atrial fibrillation and change after catheter ablation (the miRhythm study). Heart Rhythm 2015; 12(1): 3 – 10. doi: 10.1016/ j.hrthm.2014.09.050.
72. Liu T, Zhong S, Rao F et al. Catheter ablation restores decreased plasma miR-409-3p and miR-432 in atrial fibrillation patients. Europace 2016; 18(1): 92 – 99. doi: 10.1093/ europace/ euu366.
73. Nemecz M, Alexandru N, Tanko G et al. Role of MicroRNA in endothelial dysfunction and hypertension. Curr Hypertens Rep 2016; 18(12): 87.
74. Klimczak D, Jazdzewski K, Kuch M. Regulatory mechanisms in arterial hypertension: role of microRNA in pathophysiology and therapy. Blood Press 2016; 13 : 1 – 7.
75. Boettger T, Beetz N, Kostin S et al. Acquisition of the contractile phenotype by murine arterial smooth muscle cells depends on the Mir143/ 145 gene cluster. J Clin Invest 2009; 119(9): 2634 – 2647. doi: 10.1172/ JCI38864.
76. Sun HX, Zeng DY, Li RT et al. Essential role of microRNA-155 in regulating endothelium-dependent vasorelaxation by targeting endothelial nitric oxide synthase. Hypertension 2012; 60(6): 1407 – 1414. doi: 10.1161/ HYPERTENSIONAHA.112.197301.
77. Marques-Rocha JL, Samblas M, Milagro FI et al. Noncoding RNAs, cytokines, and inflammation-related diseases. FASEB J 2015; 29(9): 3595 – 3611. doi: 10.1096/ fj.14-260323.
78. Li S, Zhu J, Zhang W et al. Signature microRNA expression profile of essential hypertension and its novel link to human cytomegalovirus infection. Circulation 2011; 124(2): 175 – 184. doi: 10.1161/ CIRCULATIONAHA.110.012237.
79. Nkomo VT, Gardin JM, Skelton TN et al. Burden of valvular heart diseases: a population-based study. Lancet 2006; 368(9540): 1005 – 1011.
80. Oury C, Servais L, Bouznad N et al. MicroRNAs in valvular heart diseases: potential role as markers and actors of valvular and cardiac remodeling. Int J Mol Sci 2016; 17(7): pii E1120. doi: 10.3390/ ijms17071120.
81. Yanagawa B, Lovren F, Pan Y et al. miRNA-141 is a novel regulator of BMP-2-mediated calcification in aortic stenosis. J Thorac Cardiovasc Surg 2012; 144(1): 256 – 262. doi: 10.1016/ j.jtcvs.2011.10.097.
82. Ohukainen P, Syväranta S, Näpänkangas J et al. MicroRNA-125b and chemokine CCL4 expression are associated with calcific aortic valve disease. Ann Med 2015; 47(5): 423 – 429. doi: 10.3109/ 07853890.2015.1059955.
83. Zhang M, Liu X, Zhang X et al. MicroRNA-30b is a multifunctional regulator of aortic valve interstitial cells. J Thorac Cardiovasc Surg 2014; 147(3): 1073 – 1080.e2. doi: 10.1016/ j.jtcvs.2013.05.011.
84. Varrone F, Gargano B, Carullo P et al. The circulating level of FABP3 is an indirect biomarker of microRNA-1. J Am Coll Cardiol 2013; 61(1): 88 – 95. doi: 10.1016/ j.jacc.2012.08.1003.
85. Derda AA, Thum S, Lorenzen JM et al. Blood-based microRNA signatures differentiate various forms of cardiac hypertrophy. Int J Cardiol 2015; 196 : 115 – 122. doi: 10.1016/ j.ijcard.2015.05.185.
86. Villar AV, García R, Merino D et al. Myocardial and circulating levels of microRNA-21 reflect left ventricular fibrosis in aortic stenosis patients. Int J Cardiol 2013; 167(6): 2875 – 2881. doi: 10.1016/ j.ijcard.2012.07.021.
87. Chen Z, Li C, Xu Y et al. Circulating level of miR-378 predicts left ventricular hypertrophy in patients with aortic stenosis. PloS One 2014; 9(8): e105702. doi: 10.1371/ journal.pone.0105702.
88. Røsjø H, Dahl MB, Bye A et al. Prognostic value of circulating microRNA-210 levels in patients with moderate to severe aortic stenosis. PloS One 2014; 9(3): e91812. doi: 10.1371/ journal.pone.0091812.
89. Chen YT, Wang J, Wee AS et al. Differential microRNA expression profile in myxomatous mitral valve prolapse and fibroelastic deficiency valves. Int J Mol Sci 2016; 17(5): pii: E753. doi: 10.3390/ ijms17050753.
90. Li Q, Freeman LM, Rush JE et al. Expression profiling of circulating micrornas in canine myxomatous mitral valve disease. Int J Mol Sci 2015; 16(6): 14098 – 14108. doi: 10.3390/ ijms160614098.
91. Corsten M, Heggermont W, Papageorgiou AP et al. The microRNA-221/ -222 cluster balances the antiviral and inflammatory response in viral myocarditis. Eur Heart J 2015; 36(42): 2909 – 29019. doi: 10.1093/ eurheartj/ ehv321.
92. Wang H, Chen F, Tong J et al. Circulating micro-RNAs as novel biomarkers for dilated cardiomyopathy. Cardiol J. In press 2016. doi: 10.5603/ CJ.a2016.0097. [Epub ahead of print].
93. Yu M, Liang W, Xie Y et al. Circulating miR-185 might be a novel biomarker for clinical outcome in patients with dilated cardiomyopathy. Sci Rep 2016; 6 : 33580. doi: 10.1038/ srep33580.
94. Bienertova-Vasku J, Novak J, Vasku A. MicroRNAsin pulmonary arterial hypertension: pathogenesis, diagnosis and treatment. J Am Soc Hypertens 2015; 9(3): 221 – 234. doi: 10.1016/ j.jash.2014.12.011.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2016 Číslo 4
-
Všechny články tohoto čísla
- Rok 2016 – rok srdečního selhání
-
Komentář k Doporučeným postupům ESC/ ČKS
Diagnostika srdečního selhání -
Komentář k Doporučeným postupům ESC/ ČKS
Farmakoterapie srdečního selhání -
Komentář k Doporučeným postupům ESC/ ČKS
Poruchy srdečního rytmu a přidružená onemocnění -
Komentář k Doporučeným postupům ESC/ ČKS
Akutní srdeční selhání - Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
- MikroRNA v kardiologii – přehled pro klinickou praxi
- Aplikace molekulární diagnostiky kardiomyopatií v pediatrické praxi
- Železo a ateroskleróza
- Léčba hypertenze starších nemocných
- Duální inhibice receptoru angiotenzinu a neprilysinu – revoluční princip léčby chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Lipertance® – dva problémy, jedno řešení
- Co zaznělo na kongresu AHA 2016 v New Orleans
- Kongres International Society of Hypertension 2016 Soul
- Srdíčkáři zdolali Praděd
-
Z kongresu Evropské kardiologické společnosti
Léčba hypertenze – kombinace jako klíč k úspěchu - 10 let sitagliptinu – účinná léčba s minimem komplikací
- Apremilast – dlouhodobě bezpečný v léčbě psoriázy a psoriatické artritidy
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
-
Komentář k Doporučeným postupům ESC/ ČKS
Diagnostika srdečního selhání - Léčba hypertenze starších nemocných
- Lipertance® – dva problémy, jedno řešení
