Myokarditidy a zánětlivé kardiomyopatie
Myocarditis and inflammatory cardiomyopathy
Myocarditis means an inflammation of the heart muscle, in the Czech Republic mostly of viral etiology. Infection may trigger immune and autoimmune mechanisms which contribute to the impairment of myocardial function. Myocarditis is considered the most common cause of dilated cardiomyopathy. Its typical manifestation is heart failure, chest pain, or arrhythmias. The most important noninvasive diagnostic method is magnetic resonance imaging; the gold standard of diagnostics is invasive examination – endomyocardial biopsy. A significant number of cases with impaired left ventricular systolic function recover spontaneously and therefore it is appropriate to postpone critical therapeutic decisions until approximately 3–6 months after diagnosis. Therapy is based on the standard heart failure treatment. Immunosuppressive or antimicrobial treatment may be considered in some cases according to endomyocardial biopsy results. The most severe cases may require device therapy.
Keywords:
myocarditis – inflammatory cardiomyopathy – clinical course – diagnostics – treatment
Autoři:
J. Krejčí
Působiště autorů:
I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
Vyšlo v časopise:
Kardiol Rev Int Med 2015, 17(4): 288-294
Kategorie:
Kardiologická revue
Souhrn
Myokarditidou rozumíme zánětlivé postižení srdečního svalu, které má v našem regionu nejčastěji virovou etiologii. Virový infekt může být momentem, který aktivuje imunitní a autoimunitní mechanizmy, které se následně spolupodílí na dalším postižení myokardu. Myokarditida je pokládána za nejčastější příčinu vzniku dilatační kardiomyopatie. Manifestuje se obvykle srdečním selháním, bolestmi na hrudi nebo arytmickými příznaky. Nejdůležitější neinvazivní vyšetřovací metodou je magnetická rezonance, zlatým standardem diagnostiky je invazivní vyšetření myokardu pomocí endomyokardiální biopsie. Ve značné části případů s poruchou systolické funkce levé komory dochází spontánně k její úpravě, proto je vhodné zásadní terapeutická rozhodnutí přijímat alespoň 3–6 měsíců po stanovení diagnózy. Základem terapie je standardní léčba srdečního selhání, ve specifických situacích může být dle výsledku endomyokardiální biopsie indikovaná imunosupresivní či antimikrobiální léčba, v nejzávažnějších případech je nezbytné sáhnout k přístrojové léčbě.
Klíčová slova:
myokarditida – zánětlivá kardiomyopatie – klinický obraz – diagnostika – léčba
Definice
Myokarditida je definována jako zánětlivé postižení srdečního svalu, které může mít infekční (virové, bakteriální, protozoální) i neinfekční příčiny (např. myokarditida doprovázející autoimunitní onemocnění nebo hypersenzitivita na některé noxy). Podle definice z roku 1995 dle WHO/ ISCF jde o zánět myokardu, který je diagnostikován pomocí histologických, imunologických a imunohistochemických kritérií. Zánětlivou kardiomyopatií rozumíme myokarditidu spojenou s poruchou funkce levé komory (LK) srdeční, která má nejčastěji morfologický obraz dilatační kardiomyopatie [1].
V roce 2013 byl publikován tzv. Position statement Pracovní skupiny pro Onemocnění myokardu a perikardu Evropské kardiologické společnosti (ESC), který je souhrnem aktuálních vědomostí o této nozologické jednotce. Podle tohoto dokumentu je pokládán histologický a imunohistochemický průkaz zánětu myokardu za zcela zásadní, a proto je pro definitivní potvrzení myokarditidy in vivo nezbytné provedení endomyokardiální biopsie (EMB). Vyhodnocení vzorků myokardu umožňuje vedle samotné diagnózy myokarditidy také její přesnější typizaci (např. lymfocytární, autoimunitní, obrovskobuněčnou, eozinofilní apod.), což má důležité prognostické a terapeutické konsekvence. Nedílnou součástí hodnocení bioptických vzorků je také pátrání po potenciálním infekčním agens v myokardu [2].
Patofyziologie
Za nejčastější příčinu myokarditid v západní civilizaci jsou pokládány virové infekce. Ve Střední a Jižní Americe se často vyskytuje Chagasova nemoc způsobená prvokem Trypanosoma cruzi. Jedním z projevů této nemoci může být i myokarditida [3]. V ČR jsou endemické oblasti výskytu Borrelia burgorferi, v nichž je zvýšený výskyt borreliových myokarditid [4,5].
Aktuální názory na patofyziologii myokarditid vychází z animálních modelů enterovirové myokarditidy a předpokládají třífázový průběh onemocnění [6–8]. První, akutní fáze je spojena se vstupem virů do myocytů (přes virově specifické receptory) a s rozvojem nespecifické imunitní reakce. V této fázi, která trvá několik dnů až týdnů, zodpovídají za postižení myocytů (a tedy i funkce myokardu) zánětlivé mediátory a virová replikace. Toto období může často v klinické praxi proběhnout prakticky asymptomaticky. Druhá fáze nastupuje zpravidla s odstupem 2–4 týdnů po začátku onemocnění a je charakterizována rozvojem specifické imunitní reakce. Ta může mít často rysy autoimunity, kdy dochází ke zkřížené reakci proti autoantigenům s podobnou strukturou, jako mají virové epitopy, nebo dojde k imunitní reakci s původně intracelulárními antigeny, které byly exponovány imunitnímu systému po poškození myocytů v první fázi onemocnění. Třetí fáze nastupuje po několika týdnech či měsících a v jejím průběhu může dojít buď k ústupu zánětu a úpravě funkce LK (v 50–70 % případů, obvykle po předchozím odstranění virů z myokardu), nebo k rozvoji dilatační kardiomyopatie (DKMP) [9,10].
Zda ovšem popsaným způsobem probíhá myokarditida u všech virů (např. u těch, které primárně nenapadají myocyty, ale např. endoteliální buňky cév), není vůbec jisté. Zdá se pravděpodobné, že nezbytnou podmínkou vzniku myokarditidy je jistá genetická dispozice – u převážné většiny jedinců se totiž po setkání s tzv. kardiotropními viry myokarditida nerozvine. Této teorii nasvědčuje také častější výskyt myokarditid v některých rodinách [2,8].
Epidemiologie
Reálný výskyt myokarditid není vzhledem k obtížné diagnostice přesně známý. U mladých jedinců zemřelých náhlou smrtí byla myokarditida post mortem nalezena v širokém rozmezí pohybujícím se mezi 2 a 42 %, jiné práce uvádí až 46% výskyt myokarditid u dětí s nevysvětlitelnou DKMP [2]. Starší práce využívající Dallaská kritéria uváděly výskyt biopticky potvrzené myokarditidy v 9–16 % případů DKMP [11], novější studie [12,13] ukazují, že téměř 50 % nemocných s DKMP má imunohistochemicky detekovatelnou myokarditidu, a jde tak vlastně o zánětlivou kardiomyopatii. Myokarditida je v současnosti pokládána za nejčastější příčinu vzniku dilatační kardiomyopatie [14].
Další zajímavou skutečností je častý průkaz virových nukleových kyselin v myokardu (až v 60–80 % případů) [12,13]. Vzhledem k tomu, že některé viry (např. parvovirus B19) jsou často nalézány i u jedinců s normální funkcí LK, je jejich skutečný význam nejasný [15,16]. Podle některých je virová přítomnost v myokardu negativním prognostickým faktorem [17,18], jiní naopak nepotvrdili nepříznivý vliv virové přítomnosti na prognózu či vývoj funkce LK [13,19].
Klinická manifestace
Klinický obraz myokarditidy může být velmi proměnlivý a variabilní, což činí diagnostiku myokarditidy obtížnou. Iniciální virový infekt může proběhnout subklinicky, stejně tak samotná myokarditida bývá mnohdy asymptomatická či oligosymptomatická. Je tomu tak pochopitelně častěji u mírnějších případů s menším rozsahem postižení myokardu. Na druhou stranu mohou být symptomy dramatické a prvním příznakem může být v extrémních případech náhlá smrt či fulminantní srdeční selhání [2,6–9].
Typický klinický obraz má tři základní scénáře podle dominujícího příznaku. Nejčastějším projevem myokarditidy je srdeční selhání. Může mít pozvolný nástup a jen mírné symptomy, výjimkou ale nejsou ani případy rychle vznikajícího kardiogenního šoku, kdy pouze implantace mechanické srdeční podpory či urgentní srdeční transplantace mohou nemocnému zachránit život. Tento scénář je typický pro fulminantní myokarditidu, u níž – pokud nemocný přežije akutní fázi – po několika málo týdnech může dojít k výraznému zlepšení či dokonce úplné normalizaci systolické funkce LK s velmi dobrou dlouhodobou prognózou [20]. To platí v různé míře i pro jiné typy myokarditid s iniciální systolickou dysfunkcí LK, kdy minimálně v polovině případů dochází spontánně k její úpravě [9–11]. Proto je vhodné odsunout zásadní terapeutická rozhodnutí (jako např. implantace kardioverteru/ defibrilátoru, indikace srdeční transplantace apod.) na dobu po odeznění akutní fáze, což bývá asi 3–6 měsíců po stanovení diagnózy. Naše data z šestiměsíčního sledování ukázala, že ústup zánětlivé infiltrace v myokardu je spojen se zlepšením řady echokardiografických parametrů, se snížením hladin NTproBNP a zlepšením funkčního stavu nemocných [21]. Dalším scénářem je manifestace onemocnění bolestmi na hrudi, které mohou připomínat anginu pectoris, popř. v případě perimyokarditidy mohou mít perikardiální charakter. Nemocní jsou přivezeni na katetrizační sál k vyloučení akutního koronárního syndromu (zejména pokud je přítomna elevace markerů myokardiálního postižení) a normální nález na koronárních tepnách v takových případech vede k úvaze o možné myokarditidě [22]. Třetím dominujícím symptomem mohou být arytmie, ať už supraventrikulární či komorové. Převodní poruchy či závažné komorové arytmie upozorňují na možnost obrovskobuněčné myokarditidy, srdeční sarkoidózy či borreliové myokarditidy. Myokarditida může být také nalezena náhodně při pitvě u nemocných zemřelých náhlou srdeční smrtí pravděpodobně na podkladě maligní arytmie.
Samozřejmě není výjimečné ani prolínání jednotlivých klinických manifestací. Z hlediska prognózy bylo popsáno, že případy s příznaky srdečního selhání mají horší prognózu než ty, které se projeví bolestmi na hrudi nebo přítomností arytmií [17].
Diagnostika
Diagnostika myokarditidy byla zejména v minulosti velmi obtížná. I dnes, kdy máme k dispozici řadu moderních diagnostických metod, zůstává mnohdy diagnóza myokarditidy diagnózou per exclusionem, ke které se přikloníme až poté, co vyloučíme jiné potenciální příčiny obtíží. Ve zmíněném Position statementu ESC jsou uvedena diagnostická kritéria pro klinickou diagnózu myokarditidy, která se opírají o přítomnost některého z uvedených symptomů (srdeční selhání, bolesti na hrudi, arytmické příznaky) a nálezu z neinvazivních vyšetřovacích metod (tab. 1) [2]. Současně je v tomto dokumentu (podobně jako v řadě jiných prací) konstatováno, že definitivní diagnostickou metodou je EMB (schéma 1) [2,7–9]. Nicméně vzhledem k nižší dostupnosti tohoto vyšetření, resp. značným nárokům na laboratorní komplement nezbytný pro vyhodnocení bioptických vzorků, nebývá EMB provedena obvykle jako vyšetření v první linii. Obdobně jako u jiných onemocnění v kardiologii zahajujeme běžnými vyšetřeními, jako je EKG, které může mít velmi variabilní a také nespecifické nálezy (přítomnost arytmií, změny ST-T úseku, prodloužení PQ intervalu či QRS komplexu, přítomnost Q kmitů), byť některé nálezy mohou svědčit pro určité typy postižení. Echokardiografický nález rovněž nemá žádný typický obraz; mohou být přítomny ložiskové či globální poruchy kinetiky levé/ pravé komory (PK), diastolická dysfunkce, hypertrofie stěn LK, perikardiální výpotek). Je třeba mít na vědomí, že ani normální echokardiografický nález nevylučuje přítomnost myokarditidy. Význam echokardiografie spíše leží ve vyloučení jiné příčiny obtíží (chlopenní vady, postižení perikardu) a případně ve stratifikaci rizika odhalením případné systolické dysfunkce LK. Nejdůležitější neinvazivní vyšetřovací metodou je magnetická rezonance (MR), která v posledních letech začíná být běžně dostupná i v našich krajích. Jde o zobrazovací metodu, která je schopna bez radiační zátěže nejen zhodnotit s vysokou přesností morfologii a funkci myokardu, ale také se vyjádřit ke tkáňové charakteristice myokardu. Vyšetření pro podezření na myokarditidu je jednou z nejčastějších indikací v kardiologii, neboť z jednoho vyšetření se můžeme vyjádřit k celé řadě známek myokarditidy: edému myokardu, jeho hyperemii a kapilárnímu leaku, přítomnosti nekrózy či fibrózy, regionální nebo celkové kontraktilní dysfunkci jedné nebo obou komor nebo výskytu perikardiálního výpotku [23]. Ve snaze o standardizaci vyšetřování byla definována tzv. Lake Louise kritéria pro detekci myokarditidy [24]. Zahrnují zhodnocení edému myokardu doprovázejícího akutní zánětlivé postižení pomocí T2 vážených obrazů, dále záchyt tzv. časného sycení myokardu gadoliniem (early gadolinium enhancement – EGE), který odráží zánětlivou hyperemii), a zejména zhodnocení přítomnosti pozdního sycení (late gadolinium enhancement – LGE) s nálezem charakteristického typu akumulace gadolinia v místech nekrózy myokardu či fibrotických reparačních změn. Jsou-li přítomna alespoň dvě z těchto tří kritérií, činí senzitivita vyšetření 67 %, specificita 97 % a diagnostická přesnost 78 % [2,24]. Přítomnost pozdního sycení je vedle diagnostického významu důležité také pro prognostickou stratifikaci – nemocní s negativním nálezem mají dobrou prognózu [25], naopak přítomnost LGE se ukázala jako statisticky i klinicky velmi významný prediktor celkové i kardiovaskulární mortality (OR 8,4, resp. 12,8) [26].


Obecně lze říci, že v akutních stadiích je diagnostická přesnost vyšší než u chronických a méně aktivních forem myokarditid. Nelze pominout ani některé technické aspekty, které hodnocení výše uvedených kritérií komplikují (týká se zejména časného sycení gadoliniem), nicméně není sporu o tom, že MR je jedním ze základních vyšetření, které by při podezření na myokarditidu mělo být provedeno.
V diagnostice hrají důležitou roli laboratorní metody, zejména jde o detekci myokardiálního poškození (elevace troponinů či CK-MB), které bývají přítomné v akutní fázi onemocnění a jejichž elevace má negativní prognostický význam [27]. Přínosná může být detekce protilátek proti některým myokardiálním strukturám, byť zde zatím chybí standardizované a komerčně dostupné metody [2]. Zánětlivé markery mohou být elevovány, ale není to pravidlem. V minulosti často používaná sérologická diagnostika z periferní krve se při srovnání s bioptickými nálezy ukázala jako nepřínosná [28].
V poslední době se s rozvojem nových metod zvýrazňuje snaha o neinvazivní diagnostiku myokarditid s využitím moderních a sofistikovaných přístupů. Nadějnými přístupy by mohla být třeba detekce odlišné transkripce některých genů, která umožňuje s vysokou specificitou a senzitivitou odlišit myokarditidu od dilatační kardiomyopatie [29,30]. Další nadějnou možností se zdá být stanovení hladin miRNA, což jsou malé nekódující RNA, které zasahují do regulace posttranskripční genové exprese. Jejich hladiny se liší u různých fyziologických i patologických stavů a objevily se první práce prokazující, že up-regulace některých z nich (např. miRNA-155, -146b, nebo -21) odlišuje na myším modelu zvířata s myokarditidou od jedinců bez zánětlivého postižení myokardu [31], totéž bylo prokázáno i u lidských jedinců s virovou myokarditidou pro miRNA-155 a -148a [32]. Byly publikovány i práce ukazující odlišnou expresi řady miRNA [33] a také odlišnou genovou transkripci [34] u replikujících se a „spících“ myokardiálních infekcí virem PVB19.
Z invazivních diagnostických metod bývá indikována koronarografie k vyloučení koronární nemoci srdeční jako možné příčiny obtíží. Zlatým standardem diagnostiky je, jak bylo již konstatováno, endomyokardiální biopsie. Ta může být provedena z PK či LK (případně z obou komor), diagnostická výtěžnost závisí především na počtu odebraných vzorků, i když byly publikovány práce ukazující vyšší senzitivitu levokomorové či biventrikulární biopsie než obvykleji prováděné biopsie z PK srdeční [35,36].
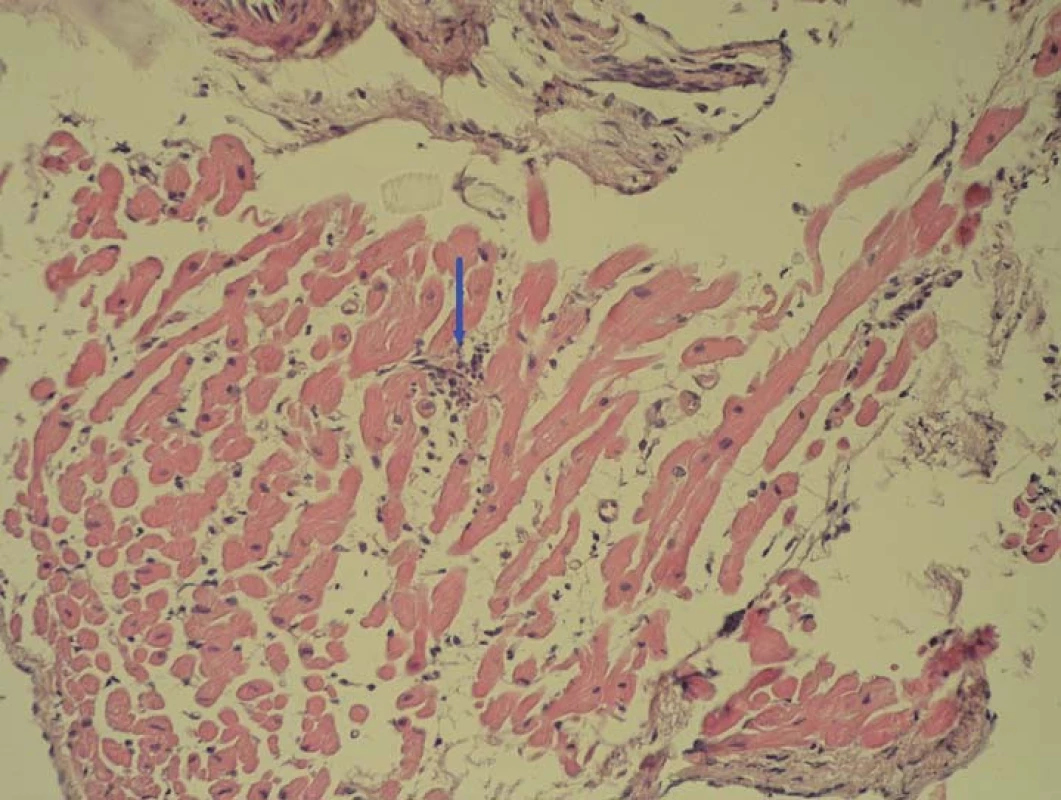
Snaha o využití EMB není nová, prvním pokusem o standardizaci hodnocení biopsií byla v 80. letech minulého stolení histologická Dallaská kritéria [37]. Poté co byla potvrzena jejich nízká senzitivita a výrazná variabilita hodnocení i mezi zkušenými patology, objevila se snaha o nalezení nových senzitivnějších a přesnějších patologických diagnostických kritérií pro detekci myokarditidy [38]. Průlomové bylo využití imunohistochemické typizace infiltrujících leukocytů – nejprve byla ustanovena tzv. Margburgská kritéria, která požadovala přítomnost > 14 mononukleárních leukocytů v 1 mm2 bioptického vzorku [39]. Ve studii TIMIC byl tento parametr doplněn alternativní možností přítomnosti > 7 T lymfocytů/ mm2 [40]; stávající oficiální dokument ESC požaduje současné splnění obou těchto parametrů a navíc přítomnost maximálně čtyř monocytů/ mm2 [2]. Další možností je semikvantitativní hodnocení zvýšené exprese HLA antigenů, což bylo využito např. ve studii Wojnicze et al [41]. Při hodnocení bioptických vzorků je nutné si být vědomi možnosti ložiskového postižení myokardu a s tím spojené možnosti chyby odběru (tzv. sampling error), která snižuje senzitivitu tohoto vyštření. Fokální zánětlivá celulární infiltrace mononukleárními leukocyty je zachycena na obr. 1. Součástí hodnocení bioptických vzorků musí být vždy pátrání po přítomnosti virů (či jiných patogenů) v myokardu, nejčastěji metodou polymerázové řetězové reakce (PCR). U některých virů (PVB19) by mělo být doplněno i kvantitativní hodnocení (tzn. stanovení virové nálože, tedy počtu virových kopií), protože se zdá, že nízká nálož by v případě PVB19 nemusela být jednoznačně spojena s indukcí zánětu [42]. Jiní zdůrazňují význam hodnocení replikační aktivity (pomocí mRNA, popř. profilu miRNA či genové transkripce) s tím, že se zdá, že replikačně neaktivní parvoviry by opravdu mohly být spíše „nevinnými pozorovateli“ než skutečnou příčinou aktuálního zánětu [33,34].
Z výše uvedeného vyplývá, že nastavení diagnostických kritérií je stále ve vývoji, a lze tedy předpokládat, že v budoucnosti bude docházet k jejich dalším modifikacím.
Terapie
Problémem terapeutických doporučení, resp. příčinou jejich velmi opatrného vyznění, je skutečnost, že se opírají spíše o data z řady malých nekontrolovaných a monocentrických sledování, zatímco data z větších randomizovaných, multicentrických, placebem kontrolovaných studií jsou buď velmi subtilní, nebo dokonce zcela chybí [2,23].
Z režimových opatření panuje shoda v nezbytnosti omezení fyzické aktivity na dobu šesti měsíců či do ústupu zánětu v kontrolní EMB a/ nebo do restituce funkce LK. Základem farmakoterapie je při přítomné poruše funkce LK podávání standardní léčby srdečního selhání podle platných guidelines sestávající zejména z ACEI/ ARB, betablokátorů, antagonistů aldosteronu. U těchto lékových skupin máme určitá experimentální i klinická data o možném pozitivním ovlivnění zánětlivých změn či prognózy nemocných [43–47]. Naopak se nedoporučuje podávat nesteroidní antirevmatika a digoxin, které v animálních experimentech vedly ke zhoršení funkce LK [9]. V kritických případech je nezbytné využít mechanickou srdeční podporu buď jako „most k úpravě“, nebo jako „most k srdeční transplantaci“, která může být v některých případech posledním možným řešením. Přístup k léčbě arytmií či přístrojové prevenci náhlé srdeční smrti by v akutní fázi měl být pokud možno zdrženlivý, protože často vídáme v horizontu několika málo týdnů výrazné zlepšení funkce LK a ústup arytmií souvisejících s regresí zánětlivých změn. Na překlenutí kritické akutní fáze zánětu je možné v některých zemích využít speciální externí defibrilační pomůcky, jako je např. life-vest [2], v našich končinách spíše tyto nemocné hospitalizujeme na monitorovaném lůžku a rozhodujeme se individuálně podle arytmologické situace.
Závěr
Diagnostika myokarditid je i přes velký rozmach diagnostických metod nadále značně komplikovaná. Vyžaduje vedle pečlivé anamnézy a klinického vyšetření komplexní diagnostický přístup s využitím řady neinvazivních a také invazivních metod stejně jako dostatečné laboratorní zázemí. Nejdůležitější neinvazivní diagnostickou metodou je MR myokardu, zlatým standardem zůstává endomyokardiální biopsie. Standardní terapie myokarditid vychází z doporučení pro léčbu srdečního selhání či arytmií, specifická léčba může být indikována pouze na podkladě znalosti výsledku EMB. Evidence pro takový postup není zcela přesvědčivá, a proto v rozhodování hraje důležitou roli individuální posouzení každého konkrétního případu a zkušenost ošetřujícího kardiologa s tímto onemocněním. Bude tedy třeba ještě značného úsilí, abychom se v oblasti myokarditid dostali na úroveň znalostí srovnatelnou s jinými diagnózami, u nichž máme k dispozici nejen jednoznačná a ověřená diagnostická kritéria, ale také jasná terapeutická doporučení.
Podpořeno grantem IGA MZ ČR 14087-3/ 2013 a Evropským regionálním rozvojovým fondem – Projekt FNUSA-ICRC (No. CZ.1.05/ 1.1.00/ 02.0123).
Doručeno do redakce: 22. 8. 2015
Přijato po recenzi: 30. 10. 2015
MU Dr. Jan Krejčí, Ph.D.
www.fnusa.cz
jan.krejci@fnusa.cz
Zdroje
1. Richardson P, McKenna W, Bristow M et al. Report of the 1995 World Health Organisation/ International Society and Federation of Cardiology Task force on the definition and classification of cardiomyopathies. Circulation 1996; 93 : 841–842.
2. Caforio AL, Pankuweit S, Arbustini E et al. Current state of knowledge on aetiology, diagnosis, management, and therapy ofmyocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34 : 2636–2648. doi: 10.1093/ eurheartj/ eht210.
3. Malik LH, Singh GD, Amsterdam EA. The epidemiology, clinical manifestations, and management of chagas heart disease. Clin Cardiol 2015; 38 : 565–569. doi: 10.1002/ clc.22421.
4. Palecek T, Kuchynka P, Hulinska D et al. Presence od Borrelia burgdorferi in endomyocardial biopsies in patients with new-onset unexplained dilated cardiomyopathy. Med Microbiol Immunol 2010; 199 : 139–143. doi: 10.1007/ s00430-009-0141-6.
5. Kubanek M, Sramko M, Berenova D et al. Detection of Borrelia burgdorferi sensu lato in endomyocardial biopsy specimens in individuals with recent-onset dilated cardiomyopathy. Eur J Heart Fail 2012; 14 : 588–596. doi: 10.1093/ eurjhf/ hfs027.
6. Cooper LT jr. Myocarditis. N Engl J Med 2009; 360 : 1526–1538. doi: 10.1056/ NEJMra0800028.
7. Kindermann I, Barth C, Mahfoud F et al. Update on myocarditis. J Am Coll Cardiol 2012; 59 : 779–792. doi: 10.1016/ j.jacc.2011.09.074.
8. Dennert R, Crijns HJ, Heymans S. Acute viral myocarditis. Eur Heart J 2008; 29 : 2073–2082. doi: 10.1093/ eurheartj/ ehn296.
9. Schultheiss HP, Kühl U, Cooper LT. The management of myocarditis. Eur Heart J 2011; 32 : 2616–2625. doi: 10.1093/ eurheartj/ ehr165.
10. D’Ambrosio A, Patti G, Manzoli A et al. The fate of acute myocarditis between spontaneous improvement and evolution to dilated cardiomyopathy: a review. Heart 2001; 85 : 499–504.
11. Mason JW, O’Connell JB, Herskowitz A et al. A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N Engl J Med 1995; 333 : 269–275.
12. Kühl U, Pauschinger M, Noutsias M et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with „idiopathic“ left ventricular dysfunction. Circulation 2005; 111 : 887–893.
13. Krejci J, Poloczkova H, Hude P et al. Impact of inflammatory infiltration and viral genome presence in myocardium on the changes of echocardiographic parameters. Cor Vasa 2013; 55: e333–e340.
14. Kühl U. Antiviral treatment of myocarditis and acute dilated cardiomyopathy. Heart Fail Clin 2005; 1 : 467–474.
15. Kuethe F, Lindner J, Matschke K et al. Prevalence of parvovirus B19 and human bocavirus DNA in the heart of patients with no evidence of dilated cardiomyopathy or myocarditis. Clin Infect Dis 2009; 49 : 1660–1666. doi: 10.1086/ 648074.
16. Escher F, Modrow S, Sabi T et al. Parvovirus B19 profiles in patients with acute myocarditis and chronic dilated cardiomyopathy. Med Sci Monit 2008; 14 : 589–597.
17. Caforio AL, Calabrese F, Angelini A et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J 2007; 28 : 1326–1333.
18. Kühl U, Lassner D, von Schlippenbach J et al. Interferon-beta improves survival in enterovirus-associated cardiomyopathy. J Am Coll Cardiol 2012; 60 : 1295–1296.
19. Kindermann I, Kindermann M, Kandolf R et al. Predictors of outcome in patients with suspected myocarditis. Circulation 2008; 118 : 639–648. doi: 10.1161/ CIRCULATIONAHA.108.769489.
20. McCarthy RE, Boehmer JP, Hruban RH et al. Long-term outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis. N Engl J Med 2000; 342 : 690–695.
21. Krejci J, Hude P, Poloczkova H et al. Correlations of the changes in bioptic findings with echocardiographic, clinical and laboratory parameters in patients with inflammatory cardiomyopathy. Heart Vessels 2014. In press. Available from: http:/ / link.springer.com/ article/ 10.1007/ s00380-014-0618-0#.
22. Baccouche H, Mahrholdt H, Meinhardt G et al. Diagnostic synergy of non-invasive cardiovascular magnetic resonance and invasive endomyocardial biopsy in troponin-positive patients without coronary artery disease. Eur Heart J 2009; 30 : 2869–2879. doi: 10.1093/ eurheartj/ ehp328.
23. Kuchynka P, Palecek T, Nemecek E et al. New therapeutic aspects on inflammatory cardiomyopathy. Curr Pharm Des 2015; 21 : 459–465.
24. Friedrich MG, Sechtem U, Schulz-Menger J et. al.Cardiovascular magnetic resonance in myocarditis: a JACC White Paper. J Am Coll Cardiol 2009; 53 : 1475–1487. doi: 10.1016/ j.jacc.2009.02.007.
25. Schumm J, Greulich S, Wagner A et al. Cardiovascular magnetic resonance risk stratification in patiens with clinically suspected myocarditis. J Cardiovasc Magn Reson 2014; 16 : 14. doi: 10.1186/ 1532-429X-16-14.
26. Grün S, Schumm J, Greulich S et al. Long-term follow-up of biopsy-proven viral myocarditis: predictors of mortality and incomplete recovery. J Am Coll Cardiol 2012; 59 : 1604–1615. doi: 10.1016/ j.jacc.2012.01.007.
27. Lauer B, Niederau C, Kühl U et al. Cardiac troponin T in patients with clinically suspected myokarditis. J Am Coll Cardiol 1997; 30 : 1354–1359.
28. Mahfoud F, Gärtner B, Kindermann M et al. Virus serology in patients with suspected myocarditis: utility or futility? Eur Heart J 2011; 32 : 897–903. doi: 10.1093/ eurheartj/ ehq493.
29. Heidecker B, Kittleson Mm, Kasper EK et al. Transcriptomic biomarkers for the accurate diagnosis of myocarditis. Circulation 2011; 123 : 1174–1184. doi: 10.1161/ CIRCULATIONAHA.110.002857.
30. Cooper LT jr, Onuma OK, Sagar S et al. Genomic and proteomic analysis of myocarditis and dilated cardiomyopathy. Heart Fail Clin 2010; 6 : 75–85. doi: 10.1016/ j.hfc.2009.08.012.
31. Corsten MF, Papageorgiou A, Verhesen W et al. miRNA profiling identifies miRNA-155 as an adverse mediator of cardiac injury and dysfunction during acute viral myocarditis. Circ Res 2012; 111 : 415–425. doi: 10.1161/ CIRCRESAHA.112.267443.
32. Bao JL, Lin L. MiR-155 and miR-148a reduce cardiac injury by inhibiting NF-κB pathway during acute viral myocarditis. Eur Rev Med Pharmacol Sci 2014; 18 : 2349–2356.
33. Kühl U, Rohde M, Lassner D et al. miRNA as activity marker in Parvo B19 associated heart disease. Herz 2012; 37 : 637–643.
34. Kühl U, Lassner D, Dorner A et al. A Distinct subgroup of cardiomyopathy patients characterized by transcriptionally active cardiotropic erythrovirus and altered cardiac gene expression. Basic Res Cardiol 2013; 108 : 372. doi: 10.1007/ s00395-013-0372-y.
35. Yilmaz A, Kindermann I, Kindermann M et al.Comparative evaluation of left and right ventricular endomyocardial biopsy: differences in complication rate and diagnostic performance. Circulation 2010; 122 : 900–909. doi: 10.1161/ CIRCULATIONAHA.109.924167.
36. Chimenti C, Frustaci A. Contribution and risks of left ventricular endomyocardial biopsy in patients with cardiomyopathies: a retrospective study over a 28-year period. Circulation 2013; 128 : 1531–1541. doi: 10.1161/ CIRCULATIONAHA.13.001414.
37. Aretz HT, Billingham ME, Edwards WD et al. Myocarditis. A histopathologic definition and classification. Am J Cardiovasc Pathol 1987; 1 : 3–14.
38. Baughman KL. Diagnosis of myocarditis: Death of Dallas criteria. Circulation 2006; 113 : 593–595.
39. Maisch B, Bultman B, Factor S et al. World Heart Federation consensus conference's definition on inflammatory cardiomyopathy (myocarditis): report from two expert committees on histology and viral cardiomyopathy. Heartbeat 1999; 4 : 3–4.
40. Frustaci A, Russo MA, Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur Heart J 2009; 30 : 1995–2002. doi: 10.1093/ eurheartj/ ehp249.
41. Wojnicz R, Nowalany-Kozielska E, Wojciechowska C et al. Randomized, placebo controled study for immunosuppressive treatment of inflammatory dilated cardiomyopathy: two year follow-up results. Circulation 2001; 104 : 39–45.
42. Bock CT, Klingel K, Kandolf R. Human parvovirus B19-associated myocarditis. N Engl J Med 2010; 362 : 1248–1249. doi: 10.1056/ NEJMc0911362.
43. Bahk TJ, Daniels MD, Leon JS et al. Comparison of angiotension converting enzyme inhibition and angiotension II receptor blocade for prevention of experimental autoimmune myocarditis. Int J Cardiol 2008; 125 : 85–93.
44. Saegusa S, Fei Y, Takahashi T et al. Oral administration of candesartan improves the survival of mice with viral myocarditis through modification of cardiac adiponectin expression. Cardiovasc Drug Ther 2007; 21 : 155–160.
45. Yuan Z, Shioji K, Kihara Y et al. Cardioprotective effect of carvedilol on acute autoimmune myocarditis: antiinflammatory effects associated with antioxydant property. Am J Physiol Heart Circ Physiol 2004; 286 : 83–90.
46. Pauschinger M, Rutschow S, Chandrasekharan Ket al. Carvedilol improves left ventricular function in murine coxsackievirus induced acute myocarditis association with reduced myocardial interleukin-1beta and MmP-8 expression and a modulated immune response. Eur J Heart Fail 2005; 7 : 444–452.
47. Xiao J, Shimada M, Liu W et al. Antiinflammatory effect of eplerenone on viral myocarditis. Eur J Heart Fail 2009; 11 : 349–353. doi: 10.1093/ eurjhf/ hfp023.
48. Cooper LT jr, Berry GJ, Shabetai R. Idiopathic giant-cell myocarditis-natural history and treatment. Multicentre giant cell myocarditis study group investigators. N Engl J Med 1997; 336 : 1860–1866.
49. Cooper LT jr, Hare JM, Tazelaar HD et al. Usefulness of immunosuppression for giant cell myocarditis. Am J Cardiol 2008; 102 : 1535–1539. doi: 10.1016/ j.amjcard.2008.07.041.
50. Kandolin R, Lehtonen J, Salmenkivi K et al. Diagnosis, treatment, and outcome of giant-cell myocarditis in the era of combined immunosuppression. Circ Heart Fail 2013; 6 : 15–22. doi: 10.1161/ CIRCHEARTFAILURE.112.969261.
51. Kawano S, Kato J, Kawano N et al. Clinical features and outcomes of eosinophilic myocarditis patients treated with prednisolone at a single institution over a 27-year period. Intern Med 2011; 50 : 975–981.
52. Yanagisawa T, Inomata T, Watanabe I et al. Clinical significance of corticosteroid therapy for eosinophilic myocarditis. Int Heart J 2011; 52 : 110–113.
53. Blauwet LA, Cooper LT. Idiopathic giant cell myocarditis and cardiac sarcoidosis. Heart Fail Rev 2013; 18 : 733–746. doi: 10.1007/ s10741-012-9358-3.
54. Frustaci A, Chimenti C, Calabrese F et al. Immunosuppressive therapy for active lymphocytic myocarditis. Virological and immunologic profile of responders versus nonresponders. Circulation 2003; 107 : 857–886.
55. Palecek T, Krejci J, Pecen L et al. Czech Inflammatory Cardiomyopathy Immunosuppression Trial (CZECH-ICIT): Randomized, multicentric study comparing the effect of two regimens of combined immunosuppressive therapy in the treatment of inflammatory cardiomyopathy: The aims and design of the trial. Cor Vasa 2013; 55 : 475–478.
56. Gullestad L, Aass H, Fjeld JG et al. Immunomodulating therapy with intravenous immunoglobulin in patients with chronic heart failure. Circulation 2001; 103 : 220–225.
57. Dennert R, Velthuis S, Schalla S et al. Intravenous immunoglobulin therapy for patients with idiopathic cardiomyopathy and endomyocardial biopsy-proven high PVB19 viral load. Antivir Ther 2010; 15 : 193–201.
58. McNamara DM, Holubkov R, Starling RC et al. Controlled trial of intravenous immune globulin in recent-onset dilated cardiomyopathy. Circulation 2001; 103 : 2254–2259.
59. Staudt A, Hummel A, Ruppert A et al. Immunoadsorption in dilated cardiomyopathy: 6-month results from randomized study. Am Heart J 2006; 152 : 712.e16.
60. Felix SB, Staudt A, Dörffer WV et al. Hemodynamic effects of immunoadsorption and subsequent immunoglobulin substitution in dilated cardiomyopathy: three-month results from a randomized study. J Am Coll Cardiol 2000; 35 : 1590–1598.
61. Kühl U, Pauschinger M, Schwimmbeck PL et al. Interoferon – treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation 2003; 107 : 2793–2798.
62. Zimmermann O, Rodewald C, Radermacher M et al. Interferon β-1b therapy in chronic viral dilated cardiomyopathy – is there a role for specific therapy? J Cardiac Fail 2010; 16 : 348–356.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2015 Číslo 4
-
Všechny články tohoto čísla
- Myokarditidy a zánětlivé kardiomyopatie
- Obrovskobuněčná myokarditida a sarkoidóza srdce – update 2015
- Perikarditidy
- Infekční endokarditida – diagnostika a doporučené postupy
- Srdeční vrozené vady v dospělosti
- Klinický přístup k pacientovi s aortální stenózou
- Indikace k intervenci a volba nejvhodnějšího postupu u mitrálních regurgitací
-
Vztah a klinický význam chronického onemocnění ledvin u pacientů s poruchami srdečního rytmu a/ nebo s implantabilními elektrickými přístroji
Zkrácená komentovaná verze oficiálního stanoviska Evropské společnosti pro srdeční rytmus -
Jak léčit dyslipidemii u pacientů s renální insuficiencí
Výběr z doporučení KDIGO s klinickým komentářem - Dávkování antibiotik u pacientů léčených hemoeliminačními metodami
- Vénové vaskulárne choroby – aktuálny naliehavý problém klinickej medicíny
- Diagnóza, klasifikácia a princípy manažmentu cerebrovaskulárnej aterosklerotickej choroby z hľadiska angiológie
- Evolocumab – protilátka proti PCSK9 s mohutným hypolipidemických účinkem
- Co zaznělo na kongresu AHA 2015 v Orlandu
-
European Society of Cardiology Congress
Co může být lepší než NOAC?
Snad jedině NOAC s antidotem... -
European Society of Cardiology Congress
Mají pacienti se srdečním selháním opět naději?
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Perikarditidy
- Myokarditidy a zánětlivé kardiomyopatie
- Srdeční vrozené vady v dospělosti
- Infekční endokarditida – diagnostika a doporučené postupy
