Nové léky pro akutní srdeční selhání
Autoři:
J. Špinar 1,2; L. Špinarová 3; O. Ludka 1,2
Působiště autorů:
Interní kardiologická klinika LF MU a FN Brno
1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
2; I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
3
Vyšlo v časopise:
Kardiol Rev Int Med 2015, 17(2): 152-154
Kategorie:
Kardiologická revue
Pracovní skupina Srdeční selhání připravila na sjezd České kardiologické společnosti 2015 blok Co nového v léčbě srdečního selhání, ve kterém představuje tři nové léky pro akutní srdeční selhání, které jsou ve třetí fázi klinického zkoušení a klinické studie se všemi probíhají i v ČR.
Serelaxin
Prof. Špinarová, národní koordinátora studie PANRELAX, představuje serelaxin. Jedná se o lidský rekombinantní relaxin‑2, původně peptid, který reguluje adaptaci mateřského organizmu na těhotenství. Má několik vlastností, které jsou využitelné v léčbě akutního srdečního selhání: zvyšuje arteriální compliance, srdeční výdej a renální průtok.
Studie RELAX ‑ AHF byla mezinárodní dvojitě slepá, randomizovaná, placebem kontrolovaná studie, která zahrnula celkem 1 161 pacientů s akutním srdečním selháním. Polovina pacientů dostávala ke standardní terapii infuzně 48 hod serelaxin, polovina placebo. Primárním cílem bylo odstranění dušnosti podle vizuální analogové škály a podle Likertovy škály od počátku do pátého dne. Sekundární cíle byly: mortalita a hospitalizace k 60. dnu od počátku studie a kardiovaskulární úmrtí nebo rehospitalizace pro srdeční nebo renální selhání do 60. dne od zahájení léčby. Serelaxin zlepšil dušnost pacientů podle vizuální analogové škály (p < 0,007), ale ne podle Likertovy škály (p < 0,7). Neměl efekt na sekundární cíle do 30. dne, avšak zlepšil dlouhodobější prognózu pacientů do 180. dne (tab. 1, graf 1).
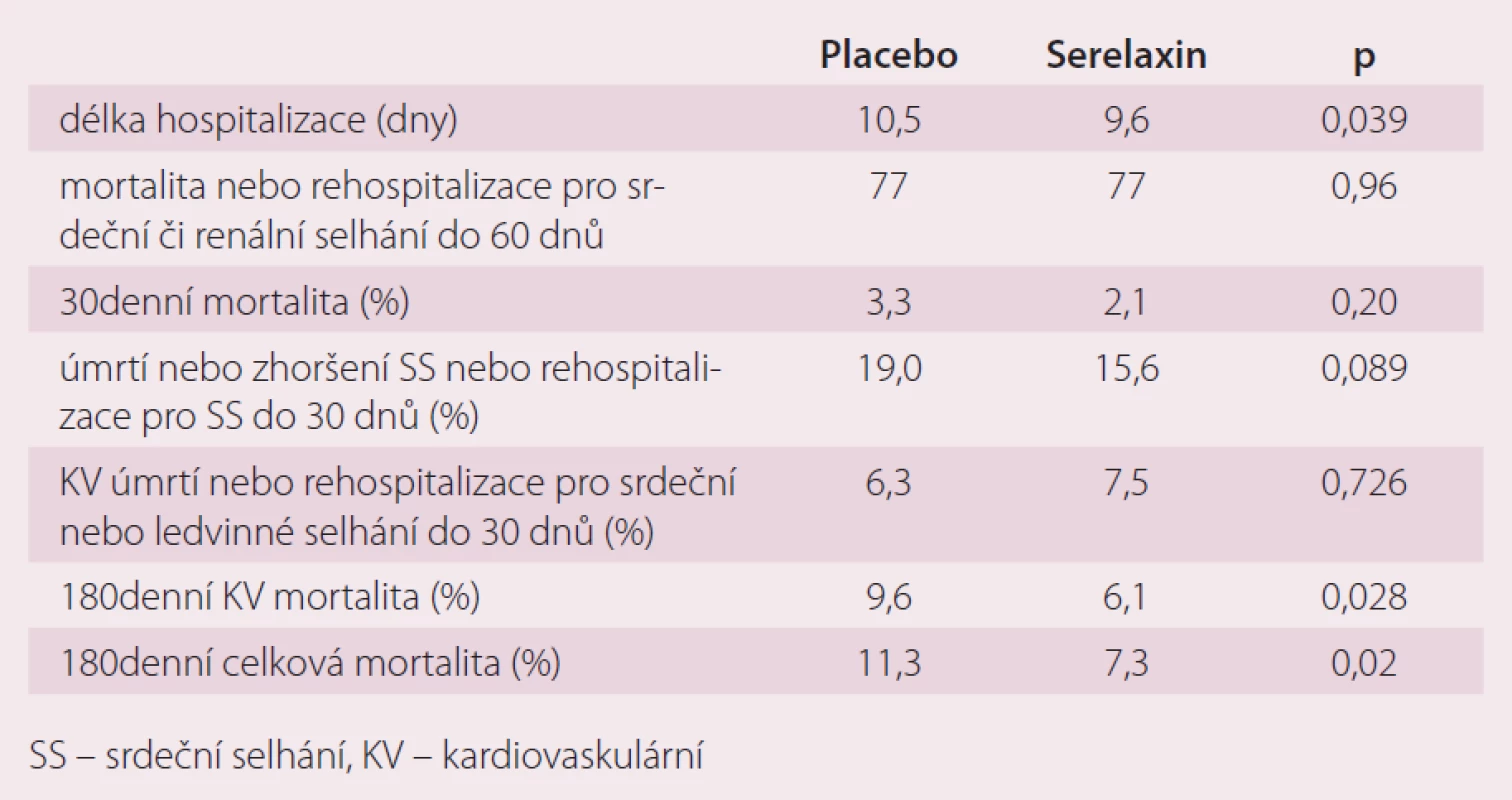

Při dalším rozboru výsledků studie se prokázalo, že pacienti léčení serelaxinem měli výraznější pokles NT ‑ proBNP, kreatininu a jaterních testů než pacienti v placebové větvi. Je proto diskutován možný vliv serelaxinu na organoprotektivitu, která musí být dále prokázána většími studiemi. V současné době probíhají takové studie tři a všech se účastní i ČR. Jedná se o studie:
RELAX II (CRLX030A2301) – multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované klinické hodnocení fáze III hodnotící účinnost, bezpečnost a snášenlivost serelaxinu přidaného ke standardní léčbě u pacientů s akutním srdečním selháním.
REPEAT (CRLX030A2209) – prospektivní, dvojitě zaslepené, multicentrické klinické hodnocení sledující bezpečnost opakovaných dávek intravenózně podaného serelaxinu u pacientů s chronickým srdečním selháním.
PANRELAX (CRLX030A3301) – multicentrické, prospektivní, randomizované, otevřené klinické hodnocení účinnosti serelaxinu oproti standardní léčbě u pacientů s akutním srdečním selháním.
Ularitid
Prof. Špinar, národní koordinátor studie TRUE ‑ AHF, představuje ularitid. Ularitid je chemicky syntetizovaný urodilatin, což je lidský přirozený natriuretický peptid syntetizovaný z proatriálního natriuretického peptidu v distálních tubulech ledviny. Urodilatin má fyziologickou úlohu v procesu homeostázy. V lidském organizmu vyvolává vazodilataci, diurézu s natriurézou aktivací receptorů pro natriuretické peptidy. Ve studiích na zvířatech a v prvních studiích na zdravých dobrovolnících měl především vazodilatační a renoprotektivní efekt. Ve fázi II proběhly studie SIRIUS.
SIRIUS I (fáze IIa) zařadila 24 nemocných NYHA III – IV se srdečním výdejem méně než 2,5 l/ min/ m2 a tlakem v zaklínění ≥ 18 mm Hg. Ularitid v této studii snižoval tlak v zaklínění asi o 12 mm Hg a hladinu NT ‑ proBNP asi o 45 %. Z nežádoucích účinků byla u tří pacientů pozorována hypotenze.
SIRIUS II (fáze IIb) zařadila 221 nemocných s akutní dekompenzací srdečního selhání (NYHA III – IV) a opět s nízkým srdečním výdejem a vysokým tlakem v zaklínění, kdy 1/ 4 nemocných dostávala placebo a 3/ 4 různé dávky ularitidu (od 7,5 do 30,0 ng/ kg/ min). Ularitid významně snížil tlak v zaklínění (graf 2), celkovou vaskulární rezistenci a zvýšil minutový výdej. Pacienti na aktivní léčbě častěji udávali zlepšení dušnosti, zatímco pacienti na placebu změnu dušnosti neuváděli. Pokles tlaku v zaklínění koreloval s udávanou změnou dušnosti podle tzv. Likertovy sedmibodové škály. Podávání ularitidu bylo spojeno s poklesem NT ‑ proBNP. Pozorně byly vyhodnoceny renální funkce, které ale nebyly podáváním ularitidu ovlivněny. Stejně tak se nemění marker srdečního poškození (troponin I) ani renálního poškození (cystatin C). Ularitid významně snižoval endotelin 1 a aldosteron (o 40 %).

Pokles systolického krevního tlaku byl závislý na dávce, při TKs pod 80 mm Hg bylo doporučeno infuzi přerušit. Hypotenze se vyskytla u 5,4 % nemocných. Studie povolovala zařadit nemocné se vstupním systolickým tlakem více než 90 mm Hg, což většina studií s vazodilatačními léky nepovoluje, a nejnižší možný systolický krevní tlak bývá 110 – 120 mm Hg.
Vyhodnocena byla i 30denní mortalita, kdy celkem zemřelo 12 (5,4 %) nemocných, z čehož 7 (13,2 %) na placebu a 5 (3,2 %) na všech dávkách ularitidu (graf 3).

V roce 2012 byla zahájena studie TRUE ‑ AHF – multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované klinické hodnocení III. fáze – ke zhodnocení účinnosti a bezpečnosti intravenózní infuze ularitidu (Urodilatinu) u pacientů s akutním dekompenzovaným srdečním selháním. Studie měla naplánováno zařadit 2 152 nemocných s akutní dekompenzací chronického srdečního selhání a tento počet pacientů bude dosažen právě v květnu 2015. Primární cíl je složen z posouzení klinického stavu a kardiovaskulární mortality po 180 dnech, kdy infuze placeba nebo 15 ng/ kg/ min je podávána po dobu 48 hod ve fázi akutní dekompenzace. Studie se aktivně účastní 10 center v ČR.
Omecamtiv mecarbil
Doc. Ludka představuje omecamtiv mecarbil, což je specifický srdeční aktivátor myozinu, který je ve fázi III. klinického zkoušení u srdečního selhání se systolickou dysfunkcí. U srdečního selhání je snížena kontraktilita v důsledku ztráty actino ‑ myozinových můstků. Snížený srdeční výdej způsobuje hypotenzi a aktivaci sympatického nervového systému. Současné pozitivně inotropní léky jako dobutamin mají paliativní, ale ne léčebný efekt, navíc mohou způsobovat arytmie a zvýšenou spotřebu kyslíku.
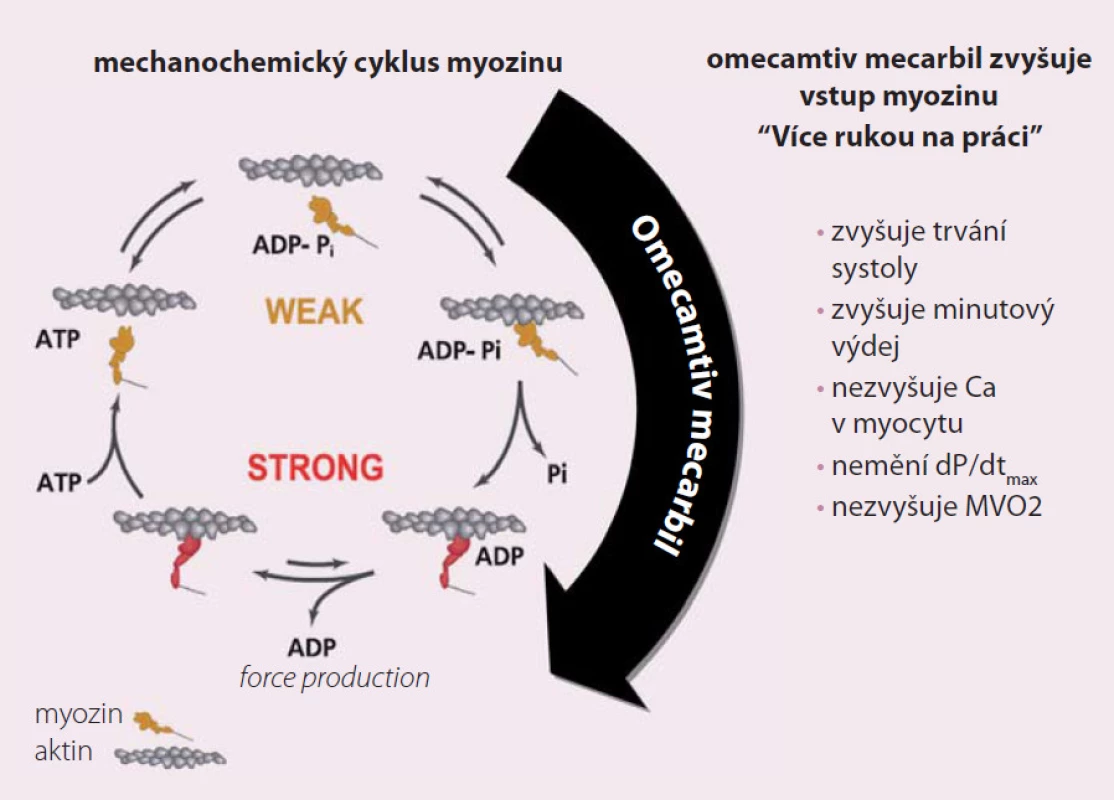
Srdeční myocyty se kontrahují pomocí mostů mezi myofilamenty actinem a myozinem. Chemická energie z ATP je přeměněna na mechanickou, což umožňuje myozinu se pevně navázat na actin a způsobit kontrakci (obr. 1). Omecamtiv specificky aktivuje ATPázu a zlepšuje využití energie. Zvyšuje taktéž množství uvolněného fosfátu. Celkový efekt omecamtivu mecarbilu je prodloužení systolického ejekčního času a zvýšení srdečního výdeje. Toto způsobuje snížení tepové frekvence, zatímco spotřeba kyslíku myokardem není ovlivněna. Zvýšení srdečního výdeje je nezávislé na hladině intracelulárního vápníku a nezpůsobuje zvýšenou spotřebu energie či kyslíku. Celkovým výsledkem je efektivnější kontrakce.
Omecamtiv mecarbil byl testován v klinické studii ATOMIC ‑ AHF (Acute Treatment with Omecamtiv Mecarbil to Increase Contractility in Acute Heart Failure), což byla studie fáze II, ve které primární cíl – změna dušnosti – nedosáhl statistického významu. Ve studii byly tři kohorty, ti nemocní, kteří měli nejvyšší dávku, měli významně lepší změnu dušnosti než nemocní na placebu (graf 4).

Studie tedy měla význam především pro určení optimální dávky léku. Studie nebyla naplánována jako mortalitní a měla za úkol především popsat farmakokinetiku a toleranci léku.
ATOMIC ‑ AHF zařadila 613 nemocných se systolickou dysfunkcí, kteří byli hospitalizováni pro akutní srdeční selhání s klidovou dušností nebo dušností při minimální námaze. Studie probíhala ve 106 centrech v Severní Americe, Evropě a Austrálii a nemocní byli randomizováni na 48hod infuzi tří různých dávek omecamtivu mecarbilu (115, 230 a 310 ng/ ml) nebo na placebo. Primární cíl byla dušnost v 6., 24. a 48. hodině, sekundární cíle byly tolerance a echokardiografické změny. Změna dušnosti všech dávek nebyla statisticky změněna (p = 0,33), bylo ale pozorováno signifikantní zvýšení systolického ejekčního času (p < 0,001) i tepové frekvence (p < 0,001) bez poklesu krevního tlaku. Nebylo pozorováno zvýšení arytmií. V následném sledování byl pozorován mírně zvýšený výskyt infarktu myokardu ve skupině na aktivní léčbě (2,3 vs. 1,0 %). Další klinický program známý pod akronymem COSMIC ‑ HF probíhá.
prof. MUDr. Jindřich Špinar, CSc.,FESC
www.fnbrno.cz
jspinar@fnbrno.cz
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2015 Číslo 2
-
Všechny články tohoto čísla
- Skórovací systémy a predikce kardiovaskulárního rizika
- Náhlá srdeční smrt
- Skórovací systémy preventivní kardiologie
- Skórovací systémy u pacientů s akutním koronárním syndromem
- Skórovací systémy u fibrilace síní
- Skórovací systémy u tromboembolické nemoci
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Role echokardiografie v hodnocení aortální stenózy a mitrální regurgitace
- Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Skórovací systémy před kardiochirurgickou operací
- Nové léky pro akutní srdeční selhání
- Primární hyperaldosteronizmus – nejčastější forma sekundární hypertenze
- Cushingův syndrom a kardiovaskulární riziko
- Saturace jodem v České republice a ve světě – nedostatky a perspektivy
- Akutní stavy v tyreologii
- Diferenciální diagnostika hyponatremie
- Endokrinologie stárnutí – krátký přehled
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Skórovací systémy u tromboembolické nemoci
- Diferenciální diagnostika hyponatremie
- Akutní stavy v tyreologii
