Současné možnosti optimalizace nastavení biventrikulární stimulace k maximálnímu využití resynchronizační léčby
Biventricular pacing set-up optimization to maximize cardiac resynchronization benefit – current options
Cardiac resynchronization therapy (CRT) improves the quality of life and/ or haemodynamic parameters only in 2/ 3 of heart failure patients with a biventricular pacemaker implanted. In the rest of these patients (non‑responders), further refinement of pacing parameters is provided. This atrioventricular delay (AVD) and ventriculoventricular delay (VVD) optimization may help to improve cardiac performance in some of them. Echocardiography is widely used to assess the effect of AVD and VVD programming. The diastolic filling pattern, the length of the diastole, stroke volume/ cardiac output, ejection fraction, LV dP/ dT and LV contraction synchrony by tissue Doppler or speckle tracking are the most frequent criteria used for optimization. Whilst all these variables are proved to demonstrate an instant effect of AVD/ VVD optimization in selected groups of CRT patients, neither a randomized study nor a meta‑analysis showed any long‑term benefit in the CRT population. This article describes the theoretical concept of optimization, certain methodological problems and unresolved issues in CRT optimization and evidence in literature already published. Optimization options are summarized in current guidelines but an individual approach is recommended in non‑responders.
Keywords:
cardiac resynchronization therapy – atrioventricular delay – ventriculoventricular delay – echocardiography – optimization
Autoři:
D. Marek
Působiště autorů:
I. interní klinika – kardiologická FN Olomouc
Vyšlo v časopise:
Kardiol Rev Int Med 2014, 16(2): 95-101
Kategorie:
Kardiologická revue
Souhrn
Srdeční resynchronizační terapie (CRT) zlepšuje kvalitu života a/ nebo hemodynamické parametry jen u dvou třetin pacientů s biventrikulárním kardiostimulátorem naimplantovaným pro srdeční selhání. U ostatních pacientů (nonrespondérů) se provádí další jemnější programace kardiostimulačních parametrů. Tato optimalizace atrio ventrikulárního a ventrikulo ‑ ventrikulárního zpoždění (AVD a VVD) může zlepšit výkon srdce u části z nich. Efekt AVD a VVD programace se nejčastěji hodnotí pomocí echokardiografických veličin (charakter plnění levé komory, délka diastolické fáze, tepový objem/ srdeční výdej, ejekční frakce, LV dP/ dT, synchronie kontrakce levé komory pomocí tissue Doppler nebo speckle trackingu). Zatímco všechny tyto parametry prokázaly bezprostřední efekt AVD/ VVD optimalizace ve vybraných souborech CRT pacientů, dlouhodobý benefit optimalizace se nepodařilo prokázat randomizovanými studiemi ani metaanalýzou. Článek popisuje současný teoretický koncept optimalizace, metodologické problémy a nevyřešené otázky a dostupnou důkazní literaturu. Možnosti optimalizace jsou shrnuty v současných odborných guidelines, doporučuje se však individuální přístup.
Klíčová slova:
srdeční resynchronizační terapie – atrio ventrikulární zpoždění – ventrikulo ‑ ventrikulární zpoždění – echokardiografie – optimalizace
Úvod
Na resynchronizační léčbu (CRT) odpovídá příznivě klinicky a/ nebo hemodynamicky jen část pacientů indikovaných k CRT (cca dvě třetiny). Predikovat respondéry před implantací se zatím spolehlivě nedaří pomocí žádných ukazatelů. Problematika nonrespondérů je široká a je pojednána v jiné práci. Příčin může být více. Nicméně například v Mullensově analýze 75 nonrespondérů CRT bylo identifikováno suboptimální nastavení atrio ventrikulárního zpoždění ve 47 % a ventrikulo ‑ ventrikulárního v 16 % [1]. Již od počátku jsou vyvíjeny snahy ovlivnit časování hemodynamických dějů řízených kardiostimulací tak, aby efekt synchronizace byl co největší. V nejširším slova smyslu jde při optimalizaci nastavení CRT přístroje do nejvhodnějšího modu atrioventrikulární (AV) a inter ‑ / intra ‑ ventrikulární synchronie. Nastavení dynamického atrio ventrikulárního delay/ zpoždění (AVD) v parametrech pacemakeru je samozřejmostí za podmínky dosažení pokud možno 100% biventrikulární (BIV) stimulace. Nastavování AVD je praxí již z doby jednoduchých dvoudutinových stimulátorů. Změna nejen AVD, ale i ventrikulo ‑ ventrikulárního zpoždění (VVD) ovlivňuje hemodynamické parametry (plnění levé komory – LV, stroke volume, dP/ dT a další), jejichž změnu je možno dokumentovat invazivně nebo neinvazivně [2 – 7]. Z klasického konceptu BIV stimulace totiž vyplývá, že zkrácení doby aktivace komor bude mít za následek také lepší synchronizaci stahu mechanicky. Cílem implantátora je tedy již při zavedení elektrod do pravé a levé komory dosáhnout takové polohy elektrod, aby šíře výsledného QRS komplexu při BIV stimulaci byla co nejmenší. Orientovat se lze buď podle šíře a vektoru QRS komplexu při implantaci a po implantaci, nebo také podle hemodynamických veličin. Nastavení BIV stimulace podle echokardiografických parametrů bylo použito nejen v originálním výzkumu, ale i v pozdějších velkých studiích s BIV stimulací: Ritterova metoda v MIRACLE (Multicenter InSync Randomized Clinical Evaluation) [8], iterativní nastavení diastoly v CARE ‑ HF (Cardiac Resynchronization ‑ Heart Failure) [9]. K monitoraci asynchronie, resp. efektu synchronizace, lze použít i jiné zobrazovací metody – magnetickou rezonanci [10], ale z praktického hlediska je nejjednodušší echo. Další možností, jak optimalizovat stroj, je využít k nastavení přímo vnitřních algoritmů přístroje [11 – 13]. V zásadě optimalizujeme především AVD, poté případně VVD. Optimalizace CRT má nejen bezprostřední efekt, ale teoreticky může napomáhat i reverzní remodelaci srdečních oddílů, především levé komory, v dlouhodobějším pohledu. Návrat sinusového rytmu po CRT dovoluje optimalizovat AVD i u pacientů s předchozí „permanentní“ FS. Pravděpodobnější je to u menších síní a po ablaci atrioventrikulárního uzlu [14]. Navíc konverze na sinusový rytmus způsobí větší pokles tlaku v plicnici [15].
Echokardiografie při optimalizaci CRT
Bezprostřední vliv variability časování kontrakce síně a komory, levé a pravé komory, případně jednotlivých segmentů levé komory, se nejčastěji sleduje echokardiograficky. Echokardiografie je totiž metoda, která je neinvazivní, opakovatelná, lze ji provádět přímo u lůžka pacienta a především změny hemodynamiky vidíme prakticky on‑line. Kalkulace nám tak umožní programaci intervalů a okamžitý výběr vhodného nastavení.
Nastavení AVD
Vliv změny AV intervalu na trvání diastoly, plnění levé komory a potažmo na srdeční výdej u pacientů s AV blokádou a implantovaným dvoudutinovým stimulátorem lze demonstrovat snadno (obr. 1A–1E). Za optimální hemodynamický model u zdravého srdce se považuje relativně krátké trvání systoly s rychlým nárůstem tlaku následované delší diastolou. U pacientů se srdečním selháním a zvýšenými plnicími tlaky (případně tachykardií) mohou být hemodynamické parametry odlišné, a pokud přibude ještě artificiální aktivace komory (případně síně), plnicí podmínky levé komory zdaleka nemusejí být optimální.

Zkracování AVD vede k prodloužení diastoly, což by mělo zajistit optimální plnění levé komory, a tedy také srdeční výdej. Přílišné zkrácení AV intervalu však znamená, že mezi pasivním plněním komory a aktivním příspěvkem síně (pokud je ovšem kontraktilní funkce síně zachována) je příliš dlouhá pauza. To může vést k middiastolické regurgitaci na mitrální/trikuspidální chlopni a ztrátě plnicího tlaku. V extrémním případě je síňový příspěvek (vlna A) prakticky zrušen již začínající systolou komory („truncated - osekané“ A). Naopak prodloužení atrioventrikulárního vedení znamená pozdější kontrakci komory po kontrakci síně, a tudíž i zpoždění začátku příští diastoly (vlny E) vzhledem k následující kontrakci síně (A). Interval E+A se tedy zkrátí, což není hemodynamicky výhodné, vlny E+A splývají dohromady a může se objevit telediastolická regurgitace (obr. 2A a 2B). Příliš dlouhé AV zpoždění tedy také vede k tomu, že levá komora může mít menší preload. Vlna E i vlna A by měly být u optimálního AVD jasně vykreslené a oddělené. U srdečního selhání se zvýšeným plnicím tlakem LK se však zpravidla považuje za projev optimalizace také to, pokud se z restrikčního typu plnění stane inverzní typ (E < A). Metoda empirického stanovování optimální podoby diastolického plnění se nazývá metoda iterativní. Sofistikovanější je Ritterova metoda, která počítá s intervaly nejkratšího a nejdelšího AVD, které vedou k uplatnění komorové stimulace – ta však je velmi pracná a byla validována jen u klasických DDD stimulátorů [16].


Pokud se podaří zachytit tok v plicních žilách, pak je zmenšení reverzního toku po atriální kontrakci příznivým znamením snížení plnicího tlaku levé komory [17].
Echokardiograficky můžeme tedy snadno měřit délku diastoly a sledovat plnění komory, kruciálním ukazatelem efektivity je však nakonec srdeční výdej (resp. stroke volume). Nejjednodušším způsobem (a nejpraktičtějším) je jistě měření rychlostně časového integrálu ve výtokovém traktu levé komory (obr. 1) (případně ejekčního času či vrcholové rychlosti). Jinou možností je měření tepových objemů 2D echokardiografií (Simpsonova metoda), případně dnes 3D echokardiografií (s automatickým stanovením volumu). Každá z těchto metod má svá úskalí (nestejná poloha dopplerovského vzorkovacího objemu ve výtokovém traktu, špatná delineace endokardu, špatné projekce aj.).
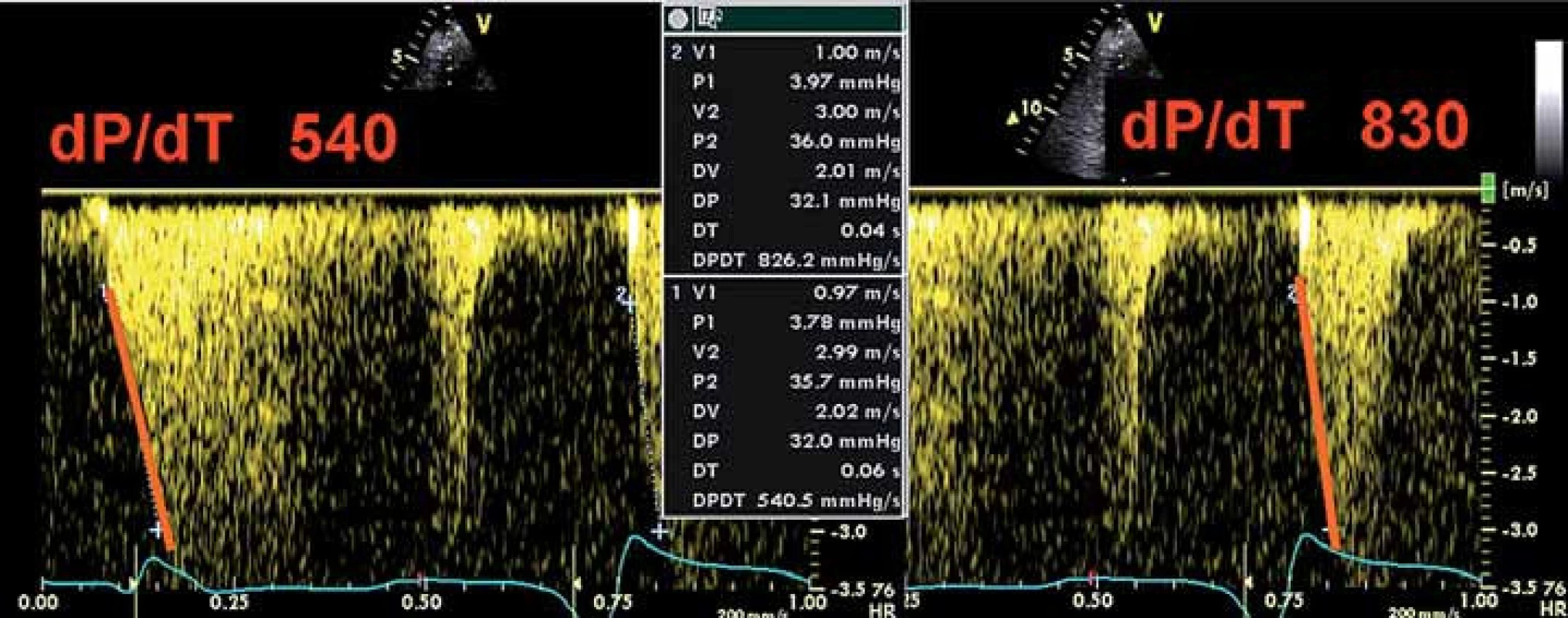
Kromě charakteru mitrálního plnění, přítomnosti/ nepřítomnosti systolické nebo diastolické regurgitace a měření tepového objemu můžeme měřit také levokomorové dP/ dT (tedy nárůst tlaku za jednotku času) na jetu mitrální regurgitace CW Dopplerem (stejně jako u programace VVD) (obr. 3).
Nastavení VDD
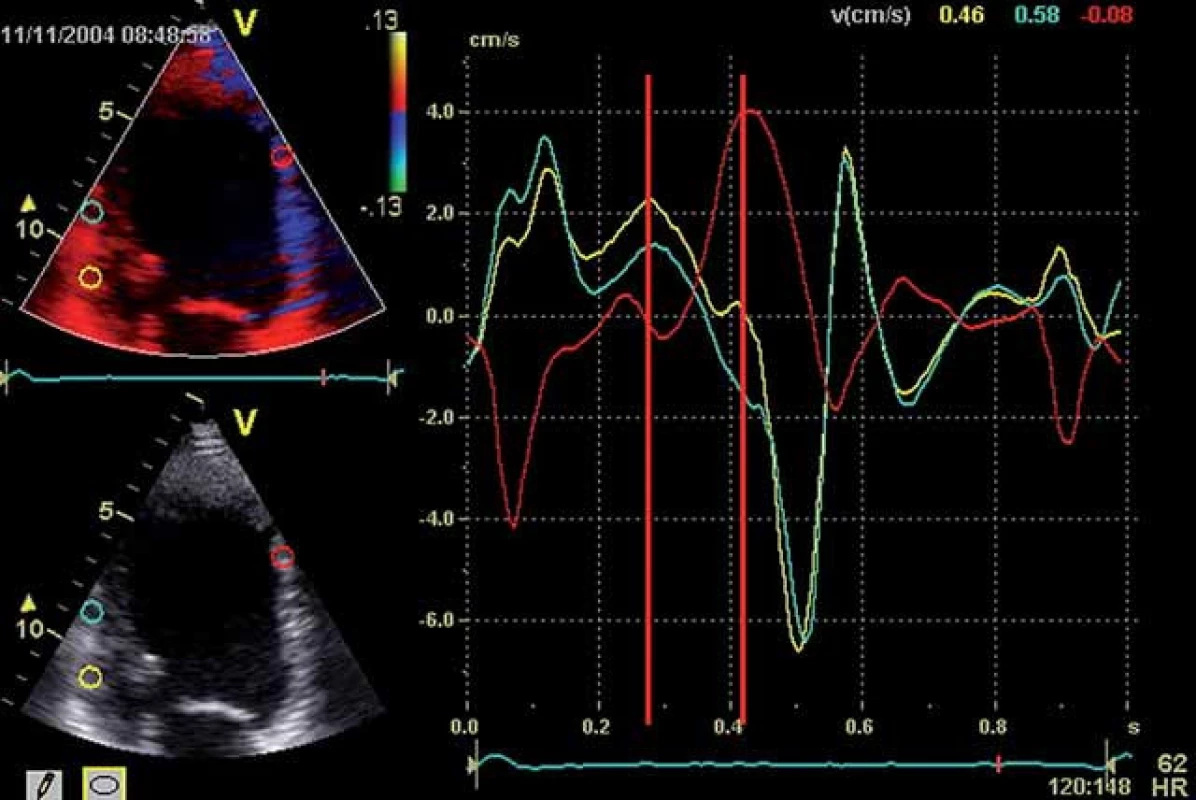
Optimalizace VV delay může vést k synchronizaci komorového stahu, ke zlepšení srdečního výdeje a zmenšení mitrální regurgitace [18]. S tím koresponduje fakt, že BIV stimulace má svůj efekt i u pacientů s trvalou fibrilací síní (mustic trial), kde AVD samozřejmě nastavovat nelze. Synchronii kontrakce, resp. zlepšení synchronie po CRT lze dokumentovat různými metodami. V minulých letech se spoléhalo na PW tkáňový Doppler z různých segmentů levé komory (většinou bazálních) coby ukazatel intra ‑ ventrikulární asynchronie [6,18] (obr. 4), případně rozdíl v časování ejekce levé a pravé komory (inter ‑ ventrikulární delay – obr. 5A, 5B). Dnes je modalitou užívanou k průkazu asynchronie dvoudimenzionální strain (speckle tracking echo – STE) (obr. 6), do popředí se dostává také 3D echokardiografie (obr. 7A – 7C). Cílem VV optimalizace tak může být buď taková úprava předstihu stimulace levé (méně často pravé) komory – offset, aby se kontrakce kosmeticky synchronizovala, anebo se zaměřit na stejné ukazatele jako při optimalizaci AVD – tedy zlepšení charakteru plnění nebo výdeje, případně dP/ dT (obr. 3).




Metodologické problémy optimalizace
Problematika optimalizace CRT je však spojena s mnoha koncepčními problémy, které nejsou zcela jednoznačně vyřešeny.
Například: Má se optimalizovat pacing při klidném výdechu (což je jednodušší, dává konzistentnější výsledky) anebo při dýchání (což je blíže reálnému životu)?
Optimalizaci provádíme většinou vleže, ale podmínky preloadu se mění po posazení a po postavení; není pro pacienta důležitější, že v poloze vsedě a vestoje tráví většinu svého aktivního života? A co v zátěži?
Dále víme, že zásah do časování srdeční revoluce může změnit charakter následujících srdečních cyklů, ale regulační mechanizmy vegetativního systému na náš zásah v několika minutách zareagují a hemodynamika se přeladí. V praxi, například při programaci AVD, můžeme čekat několik desítek sekund před dalším stupněm; pokud bychom s každým přenastavením AVD čekali několik minut, stane se jen optimalizace AVD více než hodinovou záležitostí, nemluvě o následné VVD optimalizaci. Pokud uvážíme, že vegetativní nervy reagují v minutách či desítkách minut, pak hormonální změny na úrovni ledvin (RAAS) změní hemodynamické parametry řádově po mnoha hodinách, spíše dnech. Bylo by tedy logické provést optimalizaci opakovaně s odstupem delších časových intervalů. To některá pracoviště skutečně dělají. Opakovaná optimalizace po šesti měsících viditelně upravila hemodynamiku např. v dánské studii [19]. Ale kolikrát a v jakých intervalech máme optimalizovat? Jiným problematickým momentem je, že upravíme‑li AVD a následně VVD, může změna VVD ovlivnit zpětně dynamiku stahu natolik, že je nutná nová úprava AVD. A co udělá nová další úprava VVD? Na tyto otázky neexistuje odpověď podložená solidní evidencí. Není také zcela jasné, zda je trvalý atriální pacing výhodnější. Jisté je, že AVD při síňovém pacingu je třeba nastavit delší, než když je síň snímaná (o čas intra ‑ atriální a inter ‑ atriální kondukce). Akce při atriálním pacingu vedla v experimentu k vyššímu dP/ dT, ale stroke volume byl menší [20]. Pacienti s vyšším procentem síňové stimulace jsou častěji respondéry CRT [21], ale atriální overdrive nesnížil incidenci fibrilace v MASCOT trial [22]. Nicméně vzhledem k tomu, že inter ‑ atriální a atrio ventrikulární vedení je u stimulované síňové akce jiné než při spontánní depolarizaci, je vzhledem k nastavované optimalizaci pravděpodobně výhodnější ponechat buď maximálně spontánní akci (základní frekvenci – tedy dolní frekvenční limit – nastavit nízko), anebo kompletně stimulovanou akci síně (základní frekvenci spíše nastavit výš), nicméně i tento přístup je jen intuitivní.
Optimalizace CRT a EBM
Výše uvedené teoretické koncepty byly založeny na přímých pozorováních a na analýzách selektovaných souborů, které mohly podléhat výběrové bias a většinou hodnotily krátkodobý efekt programace a tzv. měkká data. Zásadní otázkou je, zda jsme schopni na základě tvrdších dat „evidence based medicine“ (mortalita, počet kardiovaskulárních příhod, případně hospitalizace aj.) vypracovat strategii optimalizace CRT, která je univerzálně platná alespoň pro naprostou většinu pacientů s CRT. Metaanalýza dvanácti velkých studií s optimalizací CRT zahrnovala celkem 4 356 pacientů, kdy čtyři studie hodnotily přínos AVD optimalizace, pět studií přínos VVD optimalizace a tři studie kombinovanou optimalizaci AVD a VVD. V osmi studiích byla provedena optimalizace pouze 1× (v rozsahu 1 – 3 měsíců po implantaci), ve čtyřech protokolech byla optimalizace zahrnuta vícekrát. Metaanalýza prokázala, že efekt AVD a/ nebo VVD optimalizace je neutrální. Stejný výsledek byl patrný i v případě, že se vzaly v úvahu pouze randomizované studie. Z optimalizace neprofitovaly ani podskupiny pacientů s pouhou AVD nebo pouhou VVD optimalizací [23]. Bohužel se tedy zdá, že jednotný postup optimalizace, který by zajistil lepší výsledky CRT a zvýšil počet respondérů, uplatnit nelze.
Většina pracovišť se v diskuzích (především ovšem neformálních) shoduje v tom, že rutinní optimalizaci buď neprovádějí vůbec, nebo nastavují jen AVD, případně se snaží o optimalizaci alespoň u nonrespondérů. Pokud se arytmolog chce přidržet oficiálních platných doporučení, pak návrh algoritmu optimalizace je shrnut v současných evropských guidelines [24]. Na našem pracovišti uplatňujeme rovněž individuální přístup. Při implantaci BIV stimulace fixujeme pravokomorovou elektrodu do midsepta, pro levokomorovou, pokud je to technicky možné, vybereme takové umístění elektrody a takovou konfiguraci stimulace (vektor stimulačního impulzu), aby QRS komplex BIV stimulace byl co nejužší. U respondérů – repondenci hodnotíme po šesti měsících – ponecháváme nastavení AVD 130/ 110 ms (paced/ sensed) a simultánní stimulaci levé a pravé komory. U nonrespondérů s vytitrovanou medikamentózní terapií pak provedeme optimalizaci AVD (iterativně hodnotíme diastolické plnění a ověřujeme nárůst stroke volume pulzním Dopplerem v LVOT). V případě zjevné asynchronie komorové kontrakce (ať už je dokumentována jakkoli) nebo při inter ‑ ventrikulárním zpoždění ejekce nad 40 – 60 ms pak optimalizujeme VDD s užitím speckle trackingu, případně tkáňové dopplerometrie. Posuzujeme i uzávěr mitrální chlopně, resp. mitrální regurgitaci a LV dP/ dT. Žádný z těchto parametrů by neměl být výrazně nepříznivý. I při individuálním přístupu ale dle našich zkušeností nelze od optimalizace očekávat zázraky. Lze však na to pohlížet i tak, že i „nezhoršování“ stavu při BIV stimulaci můžeme svým způsobem považovat za efekt CRT.
Závěr
CRT je efektní zhruba u dvou třetin pacientů, kteří podstoupí implantaci BIV stimulace. Optimalizace atrio ventrikulárního a ventrikulo ‑ ventrikulárního zpoždění je intelektuálně, manuálně a časově náročná procedura založená především na echokardiografickém monitoringu. Současný konsenzus je, že ačkoli dílčí data dokumentují hemodynamický přínos změny AV nebo VV zpoždění, neexistuje jednotný postup optimalizace, který by zaručil lepší respondenci pacientů na CRT. Je to založeno na praktických zkušenostech a metaanalýzách publikovaných studií. Platí jistá odborná doporučení, nicméně jednotlivá pracoviště vypracovala své vlastní algoritmy, které aplikují spíše u jednotlivců – především nonrespondérů.
Doručeno do redakce 27. 3. 2014
Přijato po recenzi 10. 4. 2014
doc. MUDr. Dan Marek, Ph.D.
www.fnol.cz
dan.marek@fnol.cz
Zdroje
1. Mullens W, Grimm RA, Verga T et al. Insights from a cardiac resynchronization optimization clinic as part of a heart failure disease management program. J Am Coll Cardiol 2009; 53 : 765 – 773. doi: 10.1016/ j.jacc.2008.11.024.
2. Bertini M, Delgado V, Bax JJ et al. Why, how and when do we need to optimize the setting of cardiac resynchronization therapy? Europace 2009; 11 (Suppl 5): v46 – v57. doi: 10.1093/ europace/ eup275.
3. Bax JJ, Abraham T, Barold SS et al. Cardiac resynchronization therapy: Part 2 – issues during and after device implantation and unresolved questions. J Am Coll Cardiol 2005; 46 : 2168 – 2182.
4. Auricchio A, Ding J, Spinelli JC et al. Cardiac resynchronization therapy restores optimal atrioventricular mechanical timing in heart failure patients with ventricular conduction delay. J Am Coll Cardiol 2002; 39 : 1163 – 1169.
5. Taha N, Zhang J, Ranjan R et al. Biventricular Pacemaker Optimization Guided by Comprehensive Echocardiography ‑ Preliminary Observations Regarding the Effects on Systolic and Diastolic Ventricular Function and Third Heart Sound. J Am Soc Echocardiogr 2010; 23 : 857 – 866. doi: 10.1016/ j.echo.2010.04.022.
6. Sogaard P, Egeblad H, Pedersen AK et al. Sequential versus simultaneous biventricular resynchronization for severe heart failure: evaluation by tissue Doppler imaging. Circulation 2002; 106 : 2078 – 2084.
7. Meluzín J, Novák M, Müllerová J et al. A fast and simple echocardiographic method of determination of the optimal atrioventricular delay in patients after biventricular stimulation. Pacing Clin Electrophysiol 2004; 27 : 58 – 64.
8. Abraham WT, Fisher WG, Smith AL et al. Cardiac resynchronization in chronic heart failure. N Engl J Med 2002; 346 : 1845 – 1853.
9. Cleland JG, Daubert JC, Erdmann E et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352 : 1539 – 1549.
10. Ellims AH, Pfluger H, Elsik M et al. Utility of cardiac magnetic resonance imaging, echocardiography and electrocardiography for the prediction of clinical response and long‑term survival following cardiac resynchronisation therapy. Int J Cardiovasc Imaging 2013; 29 : 1303 – 1311. doi: 10.1007/ s10554 – 013 – 0215 – 9.
11. Ellenbogen KA, Gold MR, Meyer TE et al. Primary results from the SmartDelay determined AV optimization: a comparison to other AV delay methods used in cardiac resynchronization therapy (SMART ‑ AV) trial: a randomized trial comparing empirical, echocardiography ‑ guided, and algorithmic atrioventricular delay programming in cardiac resynchronization therapy. Circulation 2010; 122 : 2660 – 2668. doi: 10.1161/ CIRCULATIONAHA.110.992552.
12. Ritter P, Delnoy PP, Padeletti L et al. A randomized pilot study of optimization of cardiac resynchronization therapy in sinus rhythm patients using a peak endocardial acceleration sensor vs. standard methods. Europace 2012; 14 : 1324 – 1333. doi: 10.1093/ europace/ eus059.
13. Bristow MR, Saxon LA, Boehmer J et al. Cardiac ‑ resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004; 350 : 2140 – 2150.
14. Gasparini M, Steinberg JS, Arshad A et al. Resumption of sinus rhythm in patients with heart failure and permanent atrial fibrillation undergoing cardiac resynchronization therapy: a longitudinal observational study. Eur Heart J 2010; 31 : 976 – 983. doi: 10.1093/ eurheartj/ ehp572.
15. Hauck M, Bauer A, Voss F et al. Effect of cardiac resynchronization therapy on conversion of persistent atrial fibrillation to sinus rhythm. Clin Res Cardiol 2009; 98 : 189 – 194. doi: 10.1007/ s00392 - 008 - 0740 - z.
16. Ritter P, Padeletti L, Gillio ‑ Meina L et al. Determination of the optimal atrioventricular delay in DDD pacing. Comparison between echo and peak endocardial acceleration measurements. Europace 1999; 1 : 126 – 130.
17. Rafie R, Naqvi TZ. Echocardiography ‑ guided biventricular pacemaker optimization: role of echo Doppler in hemodynamic assessment and improvement. Expert Rev Cardiovasc Ther 2012; 10 : 859 – 874. doi: 10.1586/ erc.12.68.
18. Bordachar P, Lafitte S, Reuter S et al. Echocardiographic parameters of ventricular dyssynchrony validation in patients with heart failure using sequential biventricular pacing. J Am Coll Cardiol 2004; 44 : 2157 – 2165.
19. Risum N, Sogaard P, Hansen TF et al. Comparison of Dyssynchrony Parameters for VV ‑ Optimization in CRT Patients. Pacing Clin Electrophysiol 2013; 36 : 1382 – 1390. doi: 10.1111/ pace.12203.
20. Gold MR, Niazi I, Giudici M et al. Acute hemodynamic effects of atrial pacing with cardiac resynchronization therapy. J Cardiovasc Electrophysiol 2009; 20 : 894 – 900. doi: 10.1111/ j.1540 - 8167.2009.01460.x.
21. Kamath GS, Cotiga D, Koneru JN et al. The utility of 12 – lead Holter monitoring in patients with permanent atrial fibrillation for the identification of nonresponders after cardiac resynchronization therapy. J Am Coll Cardiol 2009; 53 : 1050 – 1055. doi: 10.1016/ j.jacc.2008.12.022.
22. Padeletti L, Muto C, Maounis T et al. Atrial fibrillation in recipients of cardiac resynchronization therapy device: 1‑year results of the randomized MASCOT trial. Am Heart J 2008; 156 : 520 – 526. doi: 10.1016/ j.ahj.2008.04.013.
23. Auger D, Hoke U, Bax JJ et al. Effect of atrioventricular and ventriculoventricular delay optimization on clinical and echocardiographic outcomes of patients treated with cardiac resynchronization therapy: a meta‑analysis. Am Heart J 2013; 166 : 20 – 29. doi: 10.1016/ j.ahj.2013.03.021.
24. Brignole M, Auricchio A, Baron ‑ Esquivias G et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013; 34 : 2281 – 2329. doi: 10.1093/ eurheartj/ eht150.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2014 Číslo 2
-
Všechny články tohoto čísla
- Možnosti sledování stavu oběhu a vliv dálkové monitorace na srdeční selhání
- Problematika nonrespondérů resynchronizační léčby
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Observační studie pacientů léčených lerkanidipinem v podmínkách běžné klinické praxe v České republice
- Stabilita a jednoduchost ovládly Washington
- Ischemická choroba srdeční u nemocných s diabetes mellitus 1. typu
- Výsledky velkých kardiologicko‑diabetologických studií posledních let (EXAMINE, ORIGIN, SAVOR)
- Nové možnosti farmakoterapie diabetu
- Principy terapie bazálním inzulinem u diabetu 2. typu
- Selfmonitoring jako prevence komplikací diabetu
- Centrálně působící antihypertenziva – rilmenidin
- Into the Heart of Stroke
- Výroční sjezd ČKS v Brně
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Současnost a budoucnost léčby srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
- Současné možnosti optimalizace nastavení biventrikulární stimulace k maximálnímu využití resynchronizační léčby
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Centrálně působící antihypertenziva – rilmenidin
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu







