Ischemická choroba srdeční a onemocnění ledvin
Coronary artery disease and kidney disease
The patient with chronic kidney disease (CKD) and coronary artery disease (CAD) presents special challenges. CKD ranks among the risk factors for the development, the course and the success of the treatment of CAD and on the other hand cardiovascular disease is the major cause of morbidity and mortality of the patients with CKD. This report reviews the scope of the challenge concerning the pathophysiology of this disease, clinical presentation, diagnosis and treatment of these patients.
Keywords
coronary artery disease – chronic kidney disease – diagnosis - treatment
Autoři:
MUDr. David Zemánek
Působiště autorů:
Kardiologická klinika FN Motol a 2. LF UK Praha
Vyšlo v časopise:
Kardiol Rev Int Med 2005, 7(4): 191-194
Kategorie:
Redakční článek
Souhrn
Mezi ischemickou chorobou srdeční a chronickou renální insuficiencí je významná vzájemná vazba. Na jedné straně patří renální insuficience k rizikovým faktorům vzniku, průběhu a také úspěchu léčby, a na druhé straně jsou kardiovaskulární choroby a především ICHS nejčastější příčinou mortality u nemocných s CHRI. V tomto přehledovém článku jsou shrnuty současné poznatky týkají se patofyziologie onemocnění, klinických projevů, diagnózy a léčby těchto nemocných.
Klíčová slova
ischemická choroba srdeční – chronická renální insuficience – diagnóza - léčba
Úvod
Mezi ischemickou chorobou srdeční (ICHS) a chronickou renální insuficiencí (CHRI) je významná vzájemná vazba. CHRI je rizikový faktor vzniku, průběhu a také úspěchu léčby ICHS, a zároveň na druhé straně jsou kardiovaskulární choroby a především ICHS nejčastější příčinou mortality u nemocných s CHRI. Tento těsný vzájemný vztah je proto centrem interdisciplinárního zájmu kardiologů i nefrologů. V poslední době byla publikována řada článků a doporučení týkajících se péče o tyto nemocné. Předmětem tohoto sdělení je shrnutí současných poznatků z oblasti patofyziologie, klinických projevů, diagnózy a způsobů léčby u nemocných s onemocněním ledvin.
Základní poznatky
Chronická renální insuficience a selhání je celosvětově významný zdravotní problém vzhledem k vzrůstající prevalenci a incidenci související se stárnutím populace, a také pro vysoké finanční náklady na péči o tyto nemocné a jejich velmi špatnou prognózu. Zatímco v roce 1998 bylo v Spojených státech amerických 320 000 pacientů léčených pomocí dialýzy nebo transplantace ledviny, předpokládá se, že v roce 2010 to už bude 650 000 [1]. Podobný vývoj se dá očekávat také v České republice.
Prevalence ICHS u pacientů s CHRI je vysoká a je hlavní příčinou morbidity a mortality těchto nemocných. U pacientů léčených dialýzou (hemodialýzou i peritoneální dialýzou) je prevalence ICHS 40 % a roční mortalita je 9 %. Pacienti léčení transplantací mají nižší prevalenci ICHS (15 %) [2], ale to je dáno částečně tím, že se jedná o mladší a selektované nemocné.
Pro názornost si je třeba uvědomit, že pacient léčený dialýzou má asi 5krát vyšší riziko úmrtí na kardiovaskulární choroby než jeho stejně starý vrstevník se stejnými rizikovými faktory bez onemocnění ledvin. I pacient po transplantaci ledviny má toto riziko vyšší přibližně 2krát (graf 1) [1].

Patofyziologie a rizikové faktory
Z několika srovnávacích studií, které byly provedeny u nemocných s CHRI, se zdá, že u těchto nemocných jsou klasické framinghamské rizikové faktory nedostatečné, aby vysvětlily vysokou prevalenci ICHS. Vysvětlení je možné dvěma způsoby. První je, že existují „uremické“ rizikové faktory, které nejsou zahrnuty mezi klasickými. Druhé spočívá v tom, že klasické rizikové faktory mají kvalitativně a kvantitativně jiné působení než u běžné populace.
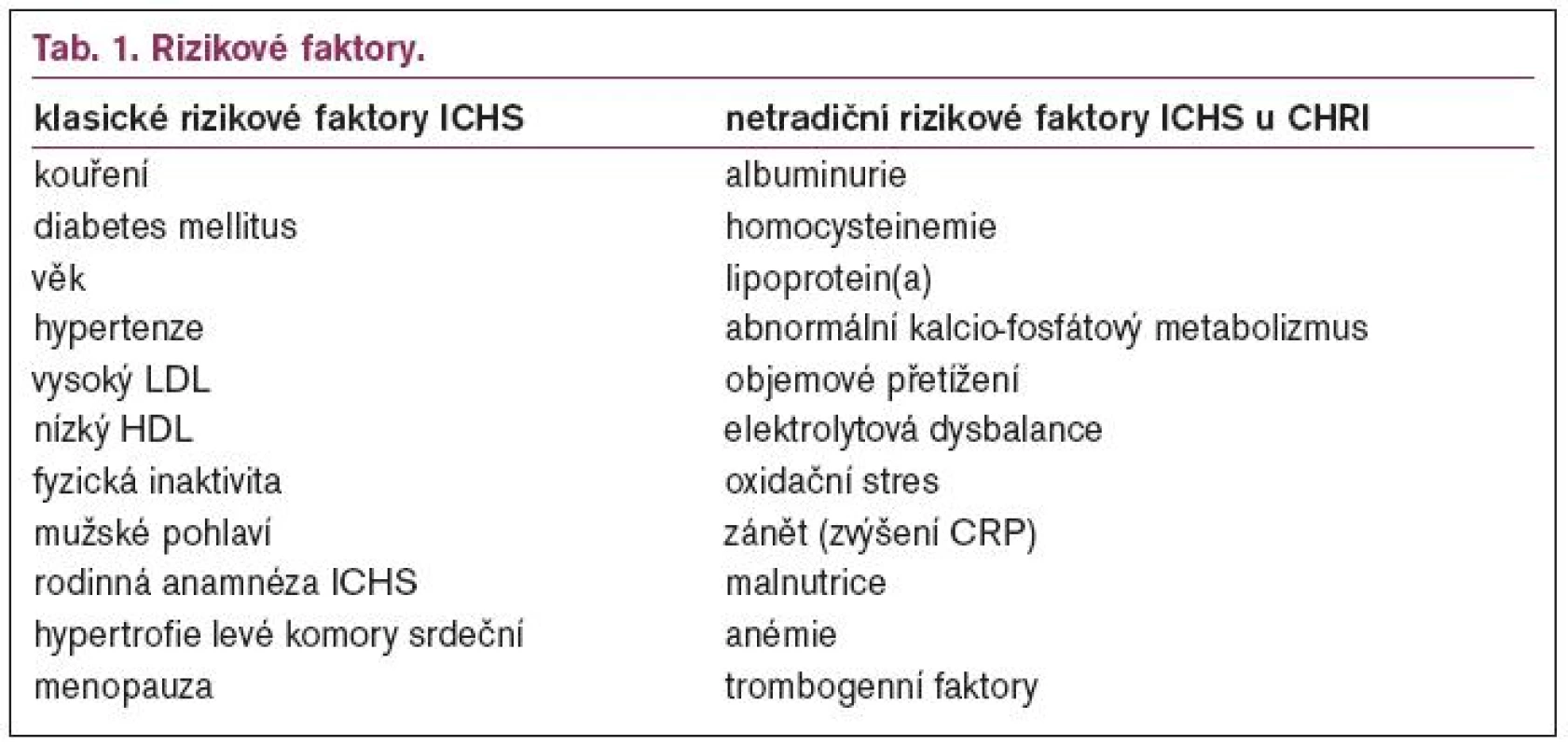
Většina autorů se nyní kloní spíše k tomu, že vedle klasických rizikových faktorů existují také tzv. netradiční („uremické“). Přehled všech rizikových faktorů je uveden v tab. 1. Některé netradiční faktory, jako např. hyperhomocysteinemie, oxidační stres, dyslipidemie a zvýšené zánětlivé markety jsou spojeny s procesem aterosklerózy. Jiné, jako abnormální kalcio-fosforový metabolizmus, jsou spojeny s remodelací cévní stěny, další jako anemie s rizikem vývoje kardiomyopatie.
Samotný proces aterosklerotického postižení u pitevních nálezů má některé odlišnosti. Bylo nalezeno významnější ztluštění medie a menší diametr cév ve srovnání s věkem a pohlavím přiměřenou populací. Také aterosklerotické pláty byly významně častěji kalcifikované [3].
V následující části jsou probrány nejvýznamnější rizikové faktory ICHS a jejich vztah k renální insuficienci.
Diabetes mellitus. Vztah mezi diabetem a ICHS je všeobecně znám. Diabetická nefropatie je v USA asi ve 40 % případů příčinou renálního selhání. U nás je sice toto číslo mírně nižší, ale přesto tvoří nezanedbatelnou část pacientů s CHRI.
Arteriální hypertenze je přítomna asi u 60-100 % pacientů s onemocněním ledvin. Její prevalence závisí na etiologii a tíži renálního postižení.
Hyperlipidemie je také přítomna v CHRI ve vyšší prevalenci než u běžné populace. Má svá specifika spočívající ve zvýšené hladině triacylglycerolů, lipoproteinů o velmi nízké a střední hustotě a snížené hladině lipoproteinů o vysoké hustotě. Celkový cholesterol se nachází zvýšený asi u 30 % pacientů s CHRI bez nefrotického syndromu a asi u 90 % s nefrotickým syndromem. Na druhé straně nízká hladina cholesterolu (stejně jako albuminu) u pacientů v pravidelném dialyzačním léčení je nezávislým prediktorem mortality (známka malnutrice).
Metabolizmus kalcia a fosforu je u pacientů s CHRI významně postižen a zahrnuje hypokalcemii, hyperfosfatemii a sekundární hyperparatyreózu. Hyperfosfatemie je nezávislý rizikový faktor kardiovaskulární mortality a také náhlé smrti [4]. Přes nižší hladinu vápníku je celkový kalcio-fosfátový součin vysoký, a to vede k zvýšené tvorbě kardiovaskulárních kalcifikací.
Hyperhomocysteinemie patří také mezi potvrzené rizikové faktory u pacientů s CHRI. Jeho hladinu ovlivňuje snížená renální clearance homocysteinu a deficit folátů a dalších vitaminů u pacientů v dialyzační léčbě. Hyperhomocysteinemie se podílí na endoteliální dysfunkci, zvyšuje proliferaci hladkých svalových vláken, agregaci trombocytů, ovlivňuje aktivaci koagulačních faktorů (V,X,XII) a tkáňového aktivátoru plazminogenu. Celkově tedy působí protrombogenně.
Imunosuprese, ať už v období po transplatanci ledvin nebo při léčbě základního renálního onemocnění, je také významným rizikovým faktorem. Kortikosteroidy vedou k inzulinové rezistenci a poruše metabolizmu lipidů. Cyklosporin A vede k hypertenzi a zvyšuje hladinu liporoteinů o nízké hustotě.
Zánět a oxidační stres. Úloha zánětu a oxidačního stresu u ICHS je v současné době předmětem zkoumání. U pacientů s CHRI je významně vyšší hladina marketů systémové zánětlivé odpovědi a oxidačního stresu a tato hladina koreluje s úrovní renální funkce [5].
Klinické projevy a diagnostické metody
Velkým problémem u nemocných s CHRI je mutilace klasických klinických příznaků. Zatímco typická stenokardie může být způsobena nejen ICHS, ale i anemií, dekompenzovanou hypertenzí a současnou přítomností hypertrofie levé komory srdeční, jsou u většiny nemocných naopak příznaky maskovány jejich malou fyzickou výkonností a přidruženými chorobami. Předpokládá se, že prevalence asymptomatické formy ICHS je 20-40 % u pacientů s renálním selháním. Dalším specifikem je potom manifestace kardiálního onemocnění během hemodialýzy, kdy se symptomy ICHS velmi špatně rozeznávají od jejích komplikací (hypotenze, dušnost, stenokardie, …).
Neinvazivní diagnostika. Na EKG často pozorujeme různé nespecifické změny s rozšířením QRS a změnami ST-úseku a vlny T dané hypertrofií levé komory srdeční, objemovým přetížením a elektrolytovou dysbalancí. Echokardiografické vyšetření má zásadní význam k poznání struktury a mechanické funkce srdce a mělo by být provedeno u všech nemocných. Stejný problém jako u klinické symptomatologie je typický i pro nejběžnější zátěžový test – bicyklovou ergometrii. Problémem je nízká senzitivita a specificita daná klidovými abnormalitami EKG a častým nedosažením diagnostické zátěže. Pro lepší senzitivitu a specificitu proto doporučujeme provedení zátěžové dobutaminové echokardiografie nebo dipyridamolové scintigrafie.
Invazivní diagnostika. Vzhledem k již popsané horší specificitě a senzitivitě běžných zátěžových testů a zároveň vysoké prevalenci ICHS je někdy jedinou možností k diagnóze invazivní angiografické vyšetření věnčitých tepen (selektivní koronarografie – SKG), která je považována za „zlatý standard“. Renální insuficience je nezávislým rizikovým faktorem morbidity a mortality při provedení SKG. Vyšší riziko krvácení je způsobeno řadou faktorů, jako např. rigiditou stěny velkých tepen, trombocytopenií a trombocytopatií a různými koagulopatiemi. Další specifický problém je kontrastní nefropatie. Ta je probrána ve vlastní kapitole na konci článku.
Laboratorní diagnostika. Metodou volby k laboratorní diagnostice akutních forem ICHS jsou srdeční troponiny. Kreatinkináza a její myokardiální frakce (CK-MB) není specifická a nedoporučuje se. Ale i troponiny (především T) jsou u dialyzovaných nemocných často zvýšeny bez vazby na ICHS a jsou spojeny s hypertrofií srdce, objemovým přetížením a srdeční fibrózou. Troponin T se potom jeví jako prediktor dlouhodobé celkové i kardiální mortality [6]. K diagnostice akutních forem ICHS se jeví jako nejlepší troponin I.
Léčba
Farmakologická léčba. Z řady studií a různých registrů vyplývá, že nemocní s CHRI jsou méně často než jejich vrstevníci léčeni optimální léčbou. Důvodem je často polymorbidita těchto nemocných, která vede k obavě z vážných nežádoucích účinků těchto léků. Další příčinou je vyřazení nemocných s CHRI z většiny velkých randomizovaných lékových studií, a tím absence „evidence based medicine“.
Antiagregační a antikoagulační léčba se většinou řídí standardními doporučeními s několika výjimkami. Kyselina acetylosalicylová je doporučena, i když chybí doklady o jejím efektu a bezpečnosti speciálně u pacientů s CHRI. Thienopyridiny také nemají podobná data, ale předpokládáme u nim podobný efekt a také bezpečnost. Nefrakcionovaný heparin je upřednostňován před nízkomolekulárními hepariny z důvodů jejich akumulace při snížené funkci ledvin a nedostatku údajů. Naopak bivalirudin se podle jedné metaanalýzy jeví jako minimálně stejně účinný jako nefrakcionovaný heparin s menším množstvím krvácivých komplikací [7]. Mezi inhibitory IIb/IIIa receptory jsou omezené podklady pro bezpečné použití tirofibanu u akutních koronárních syndromů bez ST-elevací u lehké a střední renální insuficience, u lehké CHRI také pro eptifibatid a retrospektivní data pro použití abciximabu u pacientů s perkutánní katetrizační intervencí (PCI).
ACE inhibitory mají prokázaný efekt na mortalitu u pacientů s akutním infarktem myokardu (AIM) v dialyzační léčbě podobně jako u běžné populace. Také v rámci sekundární prevence je prokázána jejich účinnost. Při analýze studie HOPE byl dokonce pozorován u pacientů s CHRI větší efekt na pokles celkové i kardiovaskulární mortality [8]. Mají také prokázaný renoprotektivní efekt u diabetu 1. a 2. typu a také u nediabetické nefropatie. Jsou proto lékem volby u hypertenze. Sartany mají prokázaný renoprotektivní efekt nezávislý na úrovni redukce hypertenze, ale kardioprotektivní efekt nebyl prokázán, a tak dáváme přednost ACE-inhibitorům.
Betablokátory mají u pacientů s CHRI stejný efekt jako u běžné populace. Také statiny jsou u pacientů s CHRI doporučovány jako u ostatních pacientů. U nemocných po transplantaci ledviny léčených cyklosporinem A nebo takrolimem je třeba dávat pozor na interakci na cytochromu P450. Za bezpečné jsou považovány pravastatin a fluvastatin, u ostatních je třeba sledovat hladinu kreatinkinázy a začínat spíše s nižšími dávkami.
Při léčbě hypertenze jsou doporučené hodnoty tlaku 130/80 mm Hg, v případě proteinurie větší než 1g/24 h pak 125/75 mm Hg. U pacientů léčených hemodialýzou má hodnota optimálního tlaku tvar křivky „J“, kdy nejen hypertenze, ale i hodnoty systolického tlaku nižšího než 110 mm Hg jsou spojeny s vyšší mortalitou.
Ke správné farmakologické léčbě patří také korekce hematokritu pomocí erytropoetinu. Úprava anémie vede nejen k redukci anginy pectoris, hypertrofie levé komory a zlepšuje zátěžovou toleranci, ale v rozmezí hodnot hematokritu mezi 33 a 36 % snižuje kardiovaskulární mortalitu [9]. Naopak korekce k normálním hodnotám vede dokonce ke zvýšení mortality a výskytů infarktů myokardu [10].
Ke snížení hyperhomocysteinemie je u pacientů se střední a těžkou CHRI doporučována léčba foláty (5 g/den), transkobalaminem (0,4 mg/den) a pyridoxinem (50 mg/den), které vedou k normalizaci hodnoty homocysteinu s výjimkou nemocných léčených dialýzou. Tato léčba je doporučována, i když stále nemáme doklad o pozitivním efektu.
Léčba hyperfosfatemie a sekundárního hyperparatyreoidizmu je součástí léčby každého dobře léčeného nemocného s CHRI a měla by obsahovat nízkofosforovou dietu společně s vazači fosfátů a aktivním metabolitem vitaminu D.
Úloha antioxidačních látek u pacientů s CHRI je doposud nejasná. Je možné, že zvýšená hladina markerů oxidačního stresu může na rozdíl od běžné populace předznamenávat efekt antioxidačních látek. V jedné studii měla léčba vitaminem E u dialyzovaných pacientů efekt na redukci kombinovaného cíle zahrnujícího výskyt infarktů myokardu, nestabilní AP, ischemické mozkové příhody a periferního cévního onemocnění [11], v jiných nebyl tento efekt potvrzen. Podobné údaje jsou zatím i pro léčbu N-acetylcysteinem. Vzhledem k přetrvávající skepsi k účinnosti této léčby u ICHS není tato léčba do doby jednoznačných výsledků doporučována.
Revaskularizační léčba – perkutánní katetrizační intervence (PCI). Malé studie prokázaly u pacientů s CHRI nižší procedurální úspěšnost prosté angioplastiky (56 % až 96 %) s vysokým stupněm restenózy (60 % až 80 %) [12]. Lepší výsledky byly dosaženy s implantací stentu (úspěšnost větší než 90 %, restenóza 31-36 %) [13]. Požití „drug eluting“ stentů vede k další redukci restenózy, ale zatím nejsou k dispozici údaje o zlepšení přežívání [14]. Na druhé straně existují ale také práce, které nepotvrzují vyšší riziko restenózy u těchto nemocných [15]. Renální insuficience je na druhé straně významným rizikovým faktorem, který zvyšuje mortalitu jak v akutním, tak v dlouhodobém průběhu po PCI, a to jak u elektivních výkonů, tak i u akutních koronárních syndromů. Toto riziko se významně zvyšuje s přítomností diabetu. V multivariatní analýze pacientů s AIM se ukázala CHRI jako nejsilnější rizikový faktor ze sledovaných parametrů s RR 5,7 pro mortalitu u pacientů léčených přímou PCI [16], ale také obecně u všech AIM (graf 2). V menší studii vyšlo dokonce podání trombolýzy jako lepší než přímá PCI u pacientů s ST elevací. Tyto výsledky by však potřebovaly další potvrzení, a tak v našich podmínkách rutinního provádění přímé PCI není potřeba tuto strategii měnit.

Chirurgická revaskularizace (CABG) u pacientů léčených dialýzou je zatížena vysokou perioperační a časnou pooperační mortalitou, která dosahuje i v zavedených centrech 3-4krát vyšších hodnot (7-10 %) než u běžné populace a je v souladu s naším pozorováním [17]. Zvýšení mortality a prodloužení doby hospitalizace je pozorováno již u malého poklesu renální funkce. Preferovaným způsobem je používání arteriálního mamárního graftu. Stejně jako u PCI je také po CABG pozorováno významně horší dlouhodobé přežívání. Dlouhodobé výsledky, které byly pozorovány ve studii Bypass Angioplasty Revascularization Investigation (BARI), ukazují vyšší riziko celkové (RR 2,2) i kardiální mortality (RR 2,8) u pacientů s CHRI [18].
Studie srovnávající PCI a CABG u pacientů v dialyzačním léčení jsou poměrně malé a nerandomizované. Při srovnání prosté angioplastiky stojí na jedné straně vyšší periprocedurální mortalita u CABG a lepší dlouhodobé přežívání a absence symptomů. Předběžné výsledky srovnávající použití stentů jsou přibližně stejné. V menší nerandomizované studii u pacientů s poklesem renální funkce (GF pod 60 ml/s) s akutním koronárním syndromem vychází pro PCI lepší přežívání ve srovnání s CABG i medikamentózní léčbou [19]. V jiné studii retrospektivně srovnávající elektivní i akutní pacienty s renální insuficiencí a selháním vychází naopak lépe chirurgická léčba než PCI a medikamentózní léčba [20], ale i ta byla u dialyzovaných nemocných lepší než farmakologická léčba. Z uvedeného vyplývá, že v dnešní době nelze jednoznačně preferovat žádný způsob revaskularizace před jiným a rozhodnutí musí být uděláno podle individuálních potřeb pacienta.
Specifické otázky
Kontrastní nefropatie je problém, který je úzce spojen s ICHS a renálním onemocněním. Jedná se o neoligoanurické postižení renální funkce, které následuje v přímé souvislosti s aplikací kontrastní látky při radiodiagnostickém vyšetření (v daném případě především SKG). Je definována jako vzestup kreatininu o 0,5 mg/dl během 48 hodin po aplikaci kontrastní látky anebo jeho vzestup o 25 %.
Její incidence se vyskytuje v rozličném rozmezí mezi 5-50 % v různých souborech. Používání moderních neionických kontrastních látek (iodixanol) vede k její menší incidenci, i když tato data nejsou jednoznačná. Její incidence závisí na množství a typu kontrastní látky, vstupní úrovni renální funkce, hydrataci, věku nemocného, přítomnosti diabetu a současném používáním nefrotoxických léků. Její přítomnost významně ovlivňuje periprocedurální mortalitu a morbiditu.
Za nejlepší prevenci je považována stále dostatečná hydratace. Farmakologicky byla neúspěšně zkoušena řada látek, jako například dopamin, manitol, furosemid, blokátory vápníkových kanálů a další. Zprvu nadějné výsledky fenoldopamu nebyly později potvrzeny. V současné době existují jednoznačné doklady pouze pro preventivní užití N-acetylcysteinu v dávce 600 mg 2krát denně den před a v den aplikace kontrastní látky [21].
Vyšetřování před transplantací ledviny. Kardiovaskulární příčiny tvoří asi 35-50 % všech příčin úmrtí u pacientů po transplantaci ledviny [22]. Důvody k provádění screeningu jsou v zásadě 2:
- zjištění rizika vlastního chirurgického výkonu
- určení dlouhodobé přežívání po transplantaci.
Rozhodnutí o vlastním algoritmu patří vzhledem k absenci větších dat do pravomocí každého jednotlivého centra a je ovlivněno lokálními potřebami (množství dárcovských orgánů, délka čekací listiny). Americká doporučení zahrnují provedení SKG bez předchozích zátěžových testů u symptomatických nemocných a u diabetiků s evidencí ICHS. U pacientů s rizikovými faktory a asymptomatickými formami ICHS doporučují nejprve provedení zátěžového testu a v případě jeho pozitivity provedení SKG [23].
Závěr
Tento přehled shrnuje současné znalosti o vztahu mezi ICHS a renálním onemocněním. Poukazuje na vysokou prevalenci ICHS u pacientů s CHRI a zároveň na špatnou prognózu nemocných s ICHS, kteří mají sníženou funkci ledvin. Snaží se poukázat na odlišnosti, které jsou u této skupiny nemocných, a na důsledky z toho plynoucí v naší diagnostické a terapeutické rozvaze. Je zřejmé, že bude potřeba ještě dalších poznatků, abychom mohli být plně spokojeni, ale je důležité si uvědomit, že i současná léčba dokáže těmto nemocným pozitivně ovlivnit život.
MUDr. David Zemánek (1972)
Promoval na Fakultě všeobecného lékařství UK v Praze (1996). Složil atestaci z vnitřního lékařství 1. stupně (2000) a atestaci z kardiologie (2004). Po absolvování studia pracoval na Klinice nefrologie IKEM (1996–1998) a zabýval kardiovaskulárními komplikacemi u pacientů s renální insuficiencí a po transplantaci ledvin. Poté pracoval tamtéž na Klinice kardiologie (1998–2003) a v této době se podílel mimo jiné na vypracování algoritmu k vyšetření pacientů před transplantací ledviny. V současné době pracuje na Kardiologické klinice FN Motol na oddělení invazivní kardiologie. Je autorem a spoluautorem 4 zahraničních článků, autorem 4 zahraničních sdělení a autorem 10 domácích článků a sdělení.
Zdroje
1. Sarnak MJ, Levey AS, Schoolwerth AC et al. Kidney disease as a risk factor for development of cardiovascular disease. Circulation 2003; 108 : 2154-2169.
2. Foley RN, Parfrey PS, Sarnak MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am J Kidney Dis 1998; 32: S112-119.
3. Schwarz U, Buzello M, Ritz E et al. Morphology of coronary atherosclerotic lesions in patients with end-stage renal failure. Nephrol Dial Transplant 2000; 15 : 218-220.
4. Ganesh SK, Stack AG, Levin NW et al. Association of elevated serum phosphate, calcium x phosphate product, and parathyroid hormone with cardiac mortality risk in chronic hemodialysis patients. J Am Soc Nephrol 2001; 12 : 2131-2138.
5. Shlipak MG, Fried LF, Crump C et al. Elevations of inflammatory and procoagulant biomarkers in elderly persons with renal insufficiency. Circulation 2003; 107 : 87-92.
6. De Filippi C, Wasserman S, Rosanio S et al. Cardiac troponin T and C-reactive protein for predicting prognosis, coronary atherosclerosis, and cardiomyopathy in patient undergoing long-term hemodialysis. JAMA 2003; 290 : 353-359.
7. Chew DP, Bhatt DL, Kimball W et al. Bivalirudin provides increasing benefit with decreasing renal function: a meta-analysis of randomized trials. Am J Cardiol 2003; 92 : 919-923.
8. Mann JFE, Gerstein JC, Pogue J et al. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial. Ann Intern Med 2001; 134 : 629-636.
9. Ma JZ, Ebben J, Xia H, Collins AJ. Hematocrit level and associated mortality in hemodialysis patients. J Am Soc Nephrol 1999; 10 : 610-619.
10. Besarab A, Bolton WK, Browne JK et al. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Engl J Med 1998; 339 : 584-590.
11. Boaz M, Smetana S, Weinstein T et al. Secondary prevention with antioxidants of cardiovascular disease in end stage renal disease (SPACE): randomized placebo-controlled trial. Lancet 2000; 356 : 1213-1218.
12. Schoebel FC, Gradaus F, Ivens K et al. Restenosis after elective coronary balloon angioplasty in patient with end stage renal disease: a case control study using quantitative coronary angiography. Heart 1997; 78 : 337-342.
13. Le Feuvre C, Dambrin G, Helft G et al. Clinical outcome following coronary angioplasty in dialysis patients: a case control study in the era of coronary stenting. Heart 2001; 85 : 556-560.
14. Lemos PA, Chourmouzios AA, Heye A et al. Impact of baseline renal function on mortality after percutaneous coronary intervention with sirolimus-eluting stents or bare metal stents. Am J Cardiol 2005; 95 : 167-172.
15. Best PJ, Berger PB, Barry DR et al. Impact of mild or moderate chronic kidney disease on frequency of restenosis. J Am Coll Cardiol 2004; 44 : 1786-1791.
16. Sadeghi HM, Stone GW, Grines CL et al. Impact of renal insufficiency in patient undergoing primary angioplasty for acute myocardial infarction. Circulation 2003; 108 : 2769-2775.
17. Zemánek D, Málek I, Pirk J. Střednědobé výsledky dialyzovaných nemocných pacientů po chirurugické revaskularizaci myokardu. Cor Vasa 2002; 44: S137.
18. Szczech LA, Best PJ, Crowley E et al. for the Bypass Angioplasty Revascularization Investigation (BARI) Investigators. Outcome of patients with chronic renal insufficiency in BARI. Circulation 2002; 105 : 2253-2258.
19. Keeley EC, Kadakia R, Soman S, Borzak S, McCullough PA. Analysis of long-term survival after revascularization in patient with chronic kidney disease presenting with acute coronary syndromes. Am J Cardiol 2003; 92 : 509-514.
20. Hemmelgarn BR, Southern D, Culleton BF et al. Survival after coronary revascularization among patient with kidney disease. Circulation 2004; 110 : 1890-1895.
21. Birck R, Krzossok S, Markowetz F et al. Acetylcysteine for prevention of contrast nephropathy: meta-analysis. Lancet 2003; 362 : 598-603.
22. Dimeny EM. Cardiovascular disease after renal transplantation. Kidney Int 2002; 6: S78-84.
23. Kasiske BL, Ramos EL, Gaston RS et al. The evaluation of renal transplant candidates: clinical practice guidelines. J Am Soc Nephrol 1995; 6 : 1-34.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2005 Číslo 4
-
Všechny články tohoto čísla
- Srdce v obrazech lidových rčení IV.
- Akutní infarkt myokardu při okluzi kmene levé věnčité tepny: zkušenosti z počátku 3. tisíciletí
- Rehabilitace po infarktu myokardu (III)
- Ischemická choroba srdeční a onemocnění ledvin
- Losartan v klinických studiích
- BENEDICT – Bergamo Nephrologic Diabetic Complications Trial
- Klinické studie ukončené, přednesené nebo publikované v poslední době
- 8th Annual Scientific Meeting of International Society for Minimally Invasive Cardiac Surgery (1. 6.–4. 6. 2005, USA, New York)
- 15. evropský meeting o hypertenzi
- Plicní hypertenze a cor pulmonale
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Akutní infarkt myokardu při okluzi kmene levé věnčité tepny: zkušenosti z počátku 3. tisíciletí
- Plicní hypertenze a cor pulmonale
- Losartan v klinických studiích
- Rehabilitace po infarktu myokardu (III)