Endovaskulární léčba ischemické cévní mozkové příhody
Endovascular treatment of cerebrovascular accident
Cerebrovascular accident (CVA) is one of the leading causes of patient morbidity, mortality and disability, especially in developed countries. Ischaemic CVA (iCVA) constitutes 80–85% of all CVA, the most common cause being an acute occlusion of cerebral artery, proved in more than 70% of patients within the first few hours after the onset of symptoms. An early cerebral artery recanalisation leads to reduced mortality and increased chance of patients’ self-sufficiency within 3 months after the stroke. Apart from pharmacological approaches to iCVA treatment (i.e. systemic, local, or combined administration of thrombolytics), endovascular techniques and methods are currently used. These methods have been undergoing a dynamic development during the last decade, and extensive clinical randomised trials prove their clear positive impact on the early reperfusion of the occluded cerebral artery, and, consequently, on a better prognosis for iCVA patients. The article describes individual endovascular instruments and the results of studies that demonstrated safety and efficacy of individual mechanical instruments proved by the ever-increasing proportion of successful recanalisations and relatively low risk of both periprocedural and postprocedural complications. Nowadays (since 2015) systemic thrombolysis combined with mechanical thrombectomy represents the method of choice for the treatment of major cerebral arterial occlusions within 4.5 hours after the onset of clinical symptoms, while mechanical thrombectomy alone with stent-retrievers is the standard treatment of acute symptomatic cerebral artery occlusion within 6 hours after the iCVA event.
Keywords:
ischaemic stroke – mechanical thrombectomy – stent-retrievers
Autoři:
J. Kozák 1,2; R. Kozáková 2; D. Kučera 1,3
Působiště autorů:
Vaskulární centrum, Vítkovická nemocnice a. s., Ostrava
1; Fakulta zdravotních věd, UP v Olomouci
2; II. interní klinika kardiologie a angiologie 1. LF UK a VFN v Praze
3
Vyšlo v časopise:
Kardiol Rev Int Med 2016, 18(3): 151-156
Souhrn
Cévní mozkové příhody (CMP) patří k nejčastějším příčinám morbidity, mortality a invalidity pacientů především v rozvinutých zemích. Ischemická CMP (iCMP) tvoří 80–85 % všech CMP a její nejčastější příčinou je akutní uzávěr mozkové tepny, který lze prokázat u více než 70 % pacientů v prvních hodinách od začátku příznaků. Co nejčasnější rekanalizace mozkové tepny je spojena se snížením mortality a s vyšší šancí na dosažení soběstačnosti pacientů po třech měsících od iktu. V současné době se v léčbě iCMP mimo farmakologických metod (systémového, lokálního, event. kombinovaného podání trombolytika) uplatňují především endovaskulární techniky a metody, které během posledních deseti let prošly dynamickým vývojem a na základě velkých klinických randomizovaných studií mají jednoznačně pozitivní vliv na včasné zprůchodnění uzavřené mozkové tepny a s tím související lepší prognózu pacientů po iCMP. V práci jsou ve stručnosti popsána jednotlivá endovaskulární instrumentária a výsledky studií, které prokázaly bezpečnost a účinnost jednotlivých mechanických instrumentárií s neustále se zvyšujícím procentem úspěšných rekanalizací a relativně nízkým rizikem jak periprocedurálních, tak postprocedurálních komplikací. V současnosti (od roku 2015) je kombinovaná systémová trombolýza s mechanickou trombektomií léčbou volby uzávěru velkých mozkových tepen do prvních 4,5 hod od vzniku klinických příznaků a samotná mechanická trombektomie s použitím stent-retrieverů je standardní terapií akutního symptomatického uzávěru mozkové tepny do 6 hod od vzniku iCMP.
Klíčová slova:
ischemická cévní mozková příhoda – mechanická trombektomie – stent-retrievery
Úvod
Cévní mozkové příhody (CMP) patří k nejčastějším příčinám morbidity, mortality a invalidity pacientů především v rozvinutých zemích. Ischemická CMP (iCMP) tvoří 80–85 % všech CMP a její nejčastější příčinou je akutní uzávěr mozkové tepny, který lze prokázat u více než 70 % pacientů v prvních hodinách od začátku příznaků [1,2]. Mortalita se pohybuje v rozmezí 20–30 % a u většiny pacientů zůstávají po prodělaném ischemickém iktu trvalé následky, které způsobují závažné omezení nebo trvalou invaliditu. Mozkový infarkt vzniká na podkladě uzávěru mozkové tepny zásobující krví příslušnou část mozkové tkáně. Nejčastěji se jedná o uzávěr arteria cerebri media (ACM) – 30–35 % všech iCMP, méně často dochází k okluzi krční tepny – arteria carotis interna (ACI). Uzávěr a. vertebralis (AV) – incidence 5–6 % všech iCMP může mít pro pacienta fatální průběh, kdy mortalita dosahuje téměř 100 % [3]. K nejdůležitějším prognostickým faktorům u pacientů s iCMP patří kromě lokalizace uzávěru mozkové tepny a stavu kolaterálního řečiště především čas do dosažení opětovné rekanalizace tepny. Časná rekanalizace v prvních 6 hod od vzniku příznaků je spojena s vyšší šancí na dosažení soběstačnosti pacienta po třech měsících a snížení mortality, přičemž s prodloužením doby do rekanalizace tepny tato šance klesá [4].
Diagnostika
V diagnosticko-terapeutickém algoritmu u pacientů s akutně vzniklou CMP hraje hlavní roli rychlost. Velký podíl na včasném „přesunu“ pacienta s CMP do zdravotnického zařízení má laická veřejnost, kde je důležité rozeznání pěti náhlých varovných příznaků (náhlá slabost končetin, náhlá porucha řeči, náhlá ztráta zraku, náhlá porucha rovnováhy a náhlá velká bolest hlavy). Stejně tak kampaň FAST (Face Arm Speech Time) vede k jednoduchému návodu, jak zacházet s nemocnými s akutní CMP. Pro stanovení diagnózy iCMP a vyloučení jiných příčin akutní neurologické symptomatologie je nutné urgentní zobrazení mozku. Včasná diagnostika je nezbytným předpokladem úspěšné terapie. K základním zobrazovacím metodám patří počítačová tomografie (computed tomography – CT) mozku. Nativní (nekontrastní) CT mozku je nezbytné pro vyloučení intrakraniálního krvácení, případně dalších patologií (tumor, absces) [5]. Z nativního vyšetření lze taktéž někdy diagnostikovat hyperdenzní změny v oblasti průběhu střední mozkové tepny (dense artery sign) a především hodnotit ASPECT score (Alberta Score Program Early CT Score) [6]. K zobrazení uzávěru, stenózy či jiné patologie krčních a mozkových tepen je také využíváno ultrazvukové vyšetření. K zobrazení intra- i extrakraniálního cévního řečiště je využívána CT angiografie a k hodnocení mozkové perfuze se využívá CT perfuzní vyšetření mozku, které díky detekci průtoku kontrastní látky mozkem umožňuje kvantitativní hodnocení mozkové perfuze pomocí několika parametrů: cerebral blood flow (CBF), cerebral blood volume (CBV), mean transit time (MTT) a time-to-peak (TTP), a to ve formě barevných map. Tyto mapy umožňují odlišit zónu ischemického polostínu (penumbra) od jádra infarktu, kde je již přítomna nekróza.
Magnetická rezonance (MR) je na rozdíl od CT schopná zobrazit pomocí difuzí vážených obrazů (DWI) velmi časné ischemické změny mozkové tkáně, a to již několik minut po vzniku mozkové ischemie. Na základě výsledků zobrazovacích modalit, zhodnocení klinického stavu pacienta NIHSS (National Institute of Health Stroke Scale), biochemických a hematologických vyšetření (především hladina glukózy) je indikována digitální subtrakční angiografie (DSA) s následnou mechanickou rekanalizací [7].
Léčba iCMP
V současné době je standardní léčbou akutní iCMP intravenózní trombolýza (IVT) do 4,5 hod od začátku prvních příznaků (třída I, úroveň A – dle European Stroke Organization) pomocí rekombinantního tkáňového aktivátoru plazminogenu (rt-PA). Výjimku představuje uzávěr a. basilaris, kdy je možno IVT podat i po 4,5 hod [8]. Doporučené dávkování rt-PA (Actilyse®) je 0,9 mg/kg tělesné váhy s maximem 90 mg. 10 % dávky se podává bolusově a zbylých 90 % dávky v následné 60min infuzi. Účinnost systémové trombolýzy rekombinantním aktivátorem tkáňového plazminogenu aplikovaným v dávce 0,9 mg/kg v hodinové infuzi v léčbě iCMP do 3 hod od vzniku příznaků bylo prokázáno v roce 1995 ve studii NINDS [9]. Studie ECASS 3 z roku 2008 prokázala účinnost této léčby i v prodlouženém časovém okně do 4,5 hod [10]. Počet soběstačných pacientů po léčbě systémovou trombolýzou však nepřesahuje 55 % [11], přičemž k selhání léčby dochází především u pacientů s uzávěrem velké mozkové tepny (T okluze vnitřní karotidy, a. basilaris) [12].
V důsledku těchto ne příliš lichotivých čísel v léčbě iCMP pomocí rt-PA je v posledním desetiletí snaha o co nejrychlejší rekanalizaci uzávěru mozkové tepny za využití endovaskulárních metod. Dle metaanalýzy z 53 klinických studií zahrnujících 2 066 pacientů bylo zjištěno, že k časné rekanalizaci dochází pouze u 24,1 % pacientů spontánně bez aplikace specifické léčby, 46,2 % u pacientů léčených IVT, 63,2 % u pacientů léčených IAT, 67,5 % u pacientů léčených kombinací IVT-IAT, avšak až 83,6 % u pacientů léčených mechanickými metodami [4]. Endovaskulární léčba akutní iCMP bývá prováděna většinou v analgosedaci. Použití celkové anestezie by mělo být vždy pečlivě posouzeno s přihlédnutím k možným nežádoucím účinkům, které zvyšují riziko mortality a komplikací po výkonu. V celkové anestezii by měli být intervenováni pacienti nespolupracující, pacienti se zhoršeným stavem vědomí (Glasgow Coma Score – GCS < 8), pacienti s respirační insuficiencí a u těžkých ischemií ve vertebrobazilárním povodí.
Mechanická trombektomie
Jednou z možností extrakce intrakraniálně uložených embolů je využití mikrolasa na vytahování cizích těles [13]. Od roku 2015 je kombinovaná systémová trombolýza s mechanickou trombektomií (MT) léčbou volby uzávěru velkých mozkových tepen do prvních 4,5 hod od vzniku klinických příznaků a samotná MT s použitím stent-retrieverů je standardní terapií akutního symptomatického uzávěru mozkové tepny do 6 hod od vzniku iCMP (obr. 1, 2). V současné době je na trhu velké množství endovaskulárních extrakčních trombembolických zařízení používaných k rekanalizaci uzávěru mozkových tepen. Většina používaných extrakčních zařízení je založena na principu zachycení a vytažení embolu z tepny, případně aspirace embolu nebo jeho fragmentace.
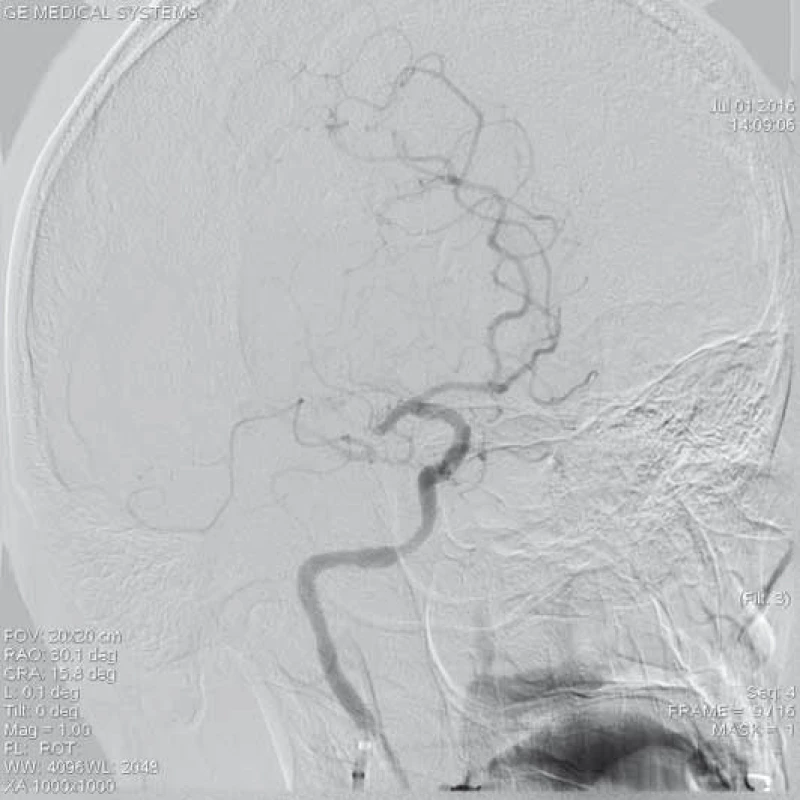
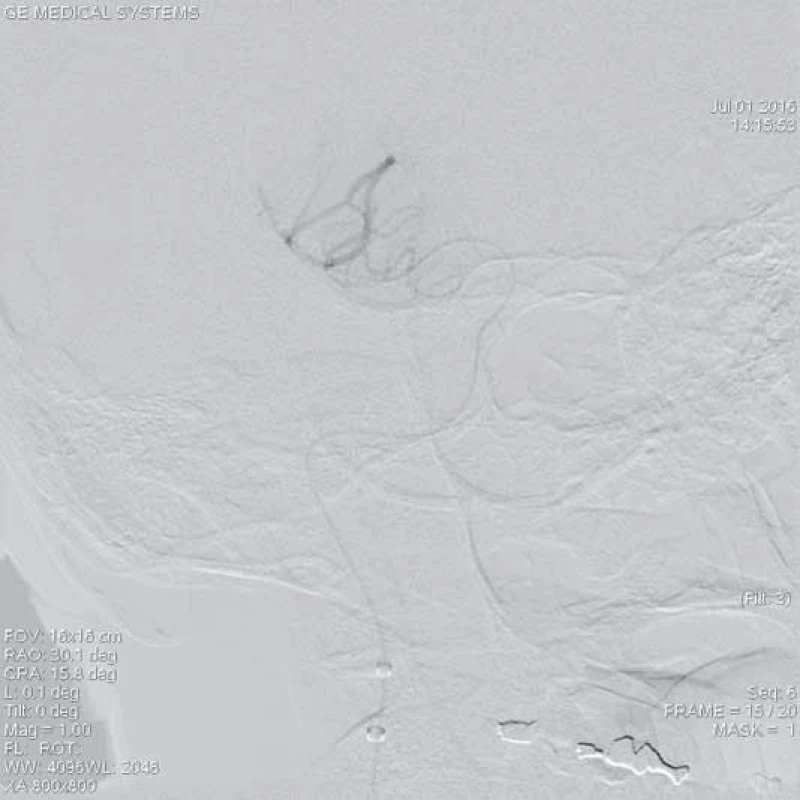
ACM – a. cerebri media, DSA – distální subtrakční angiografie,
CTA – CT angiografie, NIHSS – National Institute of Health Stroke Scale
Zařízení, které získalo v USA jako první certifikát k extrakci embolů z intrakraniálních tepen, bylo v roce 2004 spirálovité zařízení MERCI Retriever® (Concentric Medical, Mountain View, CA, USA), jež prokázalo pozitivní klinický efekt ve studiích MERCI I, II (Mechanical Embolus Removal in Cerebral Ischemia I, II) a Multi MERCI [14,15]. Dalším zařízením určeným k otevření uzavřené mozkové tepny je systém Penumbra System® (Penumbra Inc., Alameda, CA, USA). Tento systém je založen na kontinuální aspiraci trombembolu z mozkové tepny. Skládá se z reperfuzního mikrokatetru, který je napojen na aspirační pumpu vytvářející sací tlak okolo 50 mm Hg. Kromě sání se zde uplatňuje také speciální vodič (tzv. separátor) sloužící k rozmělnění trombu či embolu. Podobně jako ve studiích s MERCI Retrieverem byl i zde výsledný klinický stav pacientů s úspěšnou rekanalizací mozkové tepny signifikantně lepší [16,17]. EkoSonicTM Endovascular System (EKOS Corporation, Bothell, WA, USA) je další zařízení dříve užívané ke zprůchodnění uzávěru mozkové tepny. Princip metody spočíval v kombinaci ultrazvukového mechanického vlnění potencující lokální fibrinolýzu v trombu či embolu přes zavedený speciální mikrokatetr v místě uzávěru tepny [18].
V posledních letech získaly dominantní postavení v léčbě iCMP tzv. stent-retrievery. Jde většinou o samoexpandibilní stenty fixované k vodiči, které umožňují po umístění a rozvinutí stentu v místě uzávěru dočasný intrakraniální bypass vedoucí k okamžitému obnovení toku přes místo uzávěru tepny. Při rozvinutí stentu v místě uzávěru dojde po několika minutách (2–5 min) k protlačení embolu (trombu) do lumen stentu a následně k jeho vytažení z tepny pomocí 6–8F (French) vodicího pracovního katetru, na jehož konci je balonek. Tento balonek slouží ke krátkodobému zastavení toku v tepně při stahování stentu s embolem, čímž se snižuje riziko reembolizace z embolu. Během extrakce stent-retrieveru a insuflace obturačního balonku je zároveň aspirována krev s možnými fragmenty embolu či trombu [19].
Mezi nejčastěji používané stent-retrievery v Evropě patří bezesporu Solitaire™ Stent (Ev3, Irvine, CA, USA). Solitaire™ AB Stent je zaváděn přes 0,021“ nebo 0,027“ mikrokatetr a je dostupný v několika velikostech – průměr 3–6 mm. Unikátnost stentu Solitaire™ je v jeho dvojí funkci – jednak může fungovat jako dočasný intrakraniální bypass k okamžitému obnovení toku přes místo uzávěru tepny a následně jej lze využít k vytažení trombembolu z tepny (obr. 3–5). Ve druhém případě, pokud není možno trombembolus stáhnout, lze stent Solitaire™ odpoutat a ponechat v místě uzávěru podobně jako jiné stenty. Úspěšnost rekanalizace pomocí stentu Solitaire™ se pohybuje dle publikovaných studií v rozmezí 89–100 % [20–22].
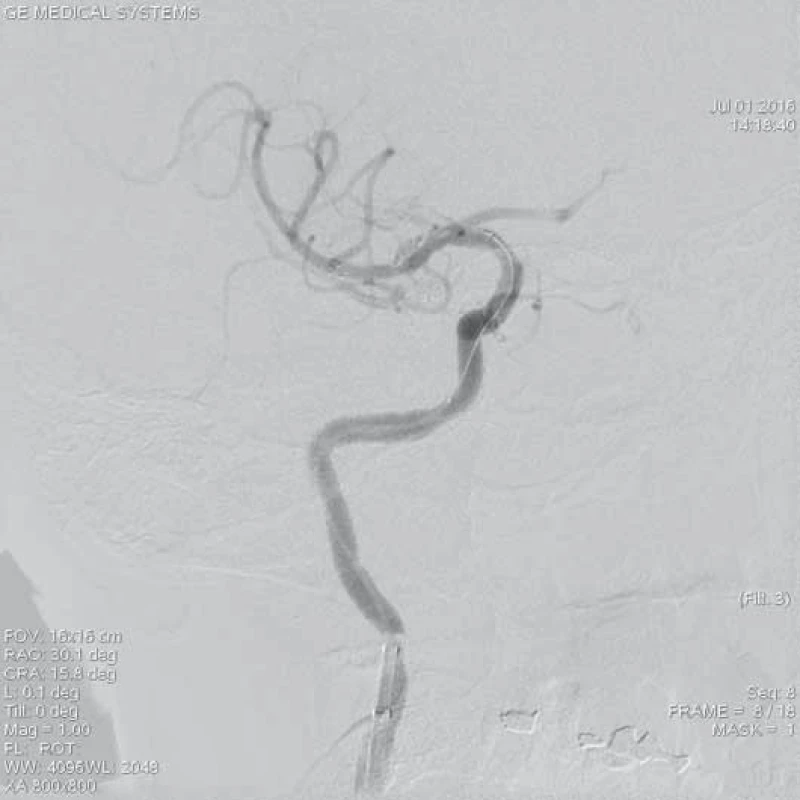
ACM – a. cerebri media, DSA – distální subtrakční angiografie, CTA – CT angiografie, NIHSS – National Institute of Health Stroke Scale
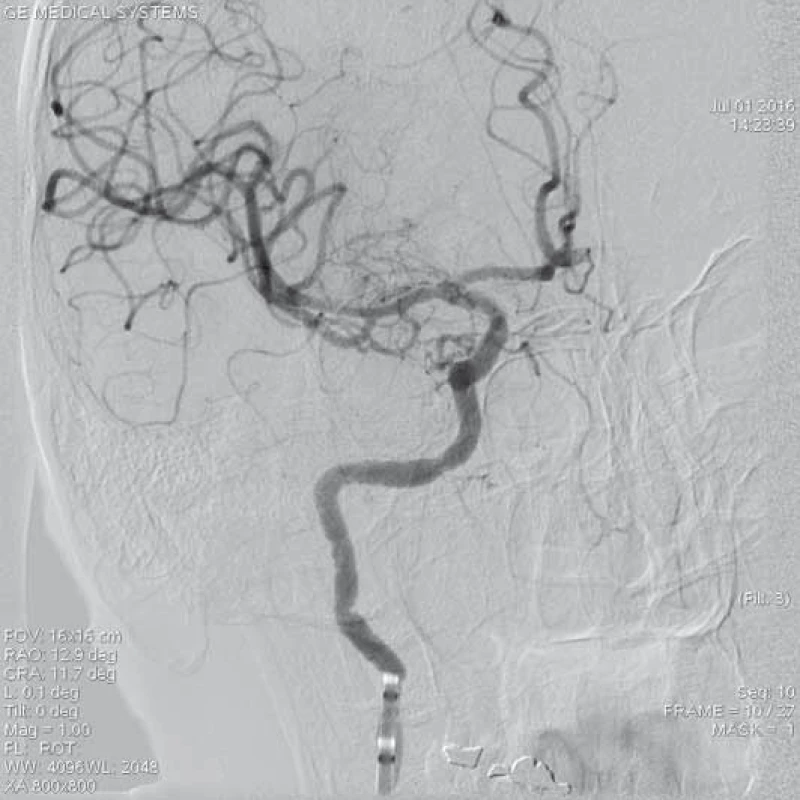
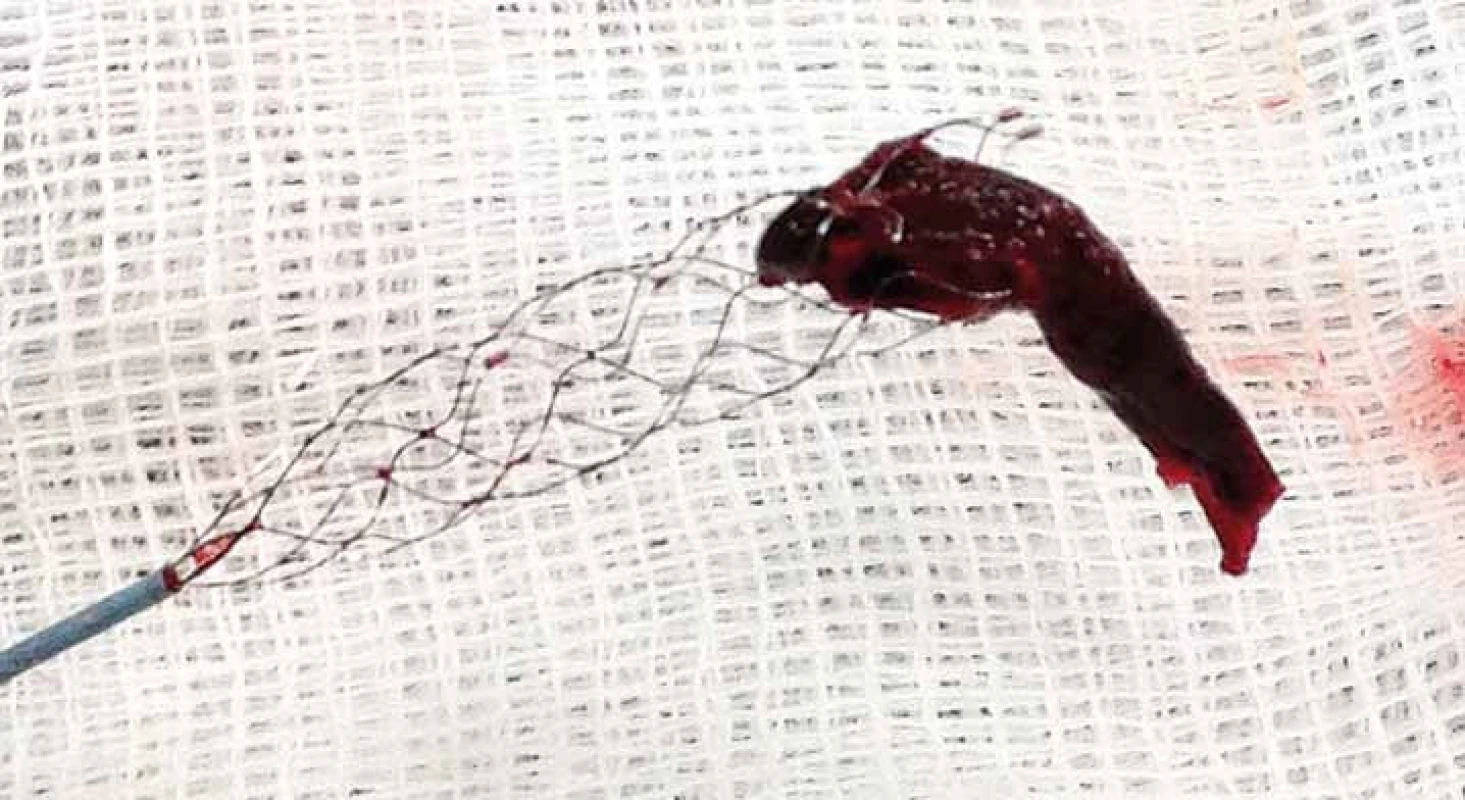
ACM – a. cerebri media
Z dalších stent-retrieverů je hojně používaný Trevo Pro® (Concentric Medical, Mountain View, CA, USA). Trevo System® je dodáván ve velikostech 4–6 mm a je zaváděn mikrokatetrem o vnitřním průměru 0,021“. Samotné zavedení a extrakce trombembolu jsou prováděny podobně jako u stentu Solitaire™. Bezpečnost a účinnost tohoto systému stejně jako stentu Solitaire™ byly testovány v randomizovaných klinických studiích TREVO 2 Clinical Trial (TREVO versus MERCI retrievers for thrombectomy REvascularization of large Vessel Occlusions) [23] a SWIFT (Solitaire With the Intention For thrombectomy) [24] srovnávajících tyto stent-retrievery s MERCI retrieverem, kde oba stent-retrievery prokázaly významně vyšší technickou úspěšnost a lepší klinické výsledky při použití těchto stentů u pacientů s akutní iCMP než při použití MERCI retrieveru. Mezi další používané stent-retrievery používané v endovaskulární léčbě iCMP patří Catch Device® (Balt Extrusion, Montmorency, Francie), což je malý nitinolový košík velikosti 4 mm. Zavádí se přes mikrokatetr s vnitřním průměrem 0,024“. Košiček je zaveden za trombus, pak se otevře a celý systém i s trombem je stažen přes 6F vodicí katetr. Dle retrospektivní studie se 40 pacienty s akutní iCMP bylo dosaženo rekanalizace TIMI 2–3 (Thrombolysis In Myocardial Ischemia) v 65 % případů. Subarachnoidální hemoraghie (SICH) se vyskytla u 18 % pacientů. Soběstačnosti po třech měsících (modifikované Rankonovo skóre (mRS) ≤ 2) dosáhlo 39 % pacientů. Soběstačnost (56,5 vs. 7,7 % pacientů) i mortalita (30,0 vs. 61,5 % pacientů) byly signifikantně lepší u pacientů s úspěšnou rekanalizací [25].
Mezi nepříliš frekventovaná extrakční zařízení v endovaskulární léčbě iCMP patřily systémy BONNET Intracranial Flow Restoration Device® (Phenox GmbH, Bochum, Německo), což je nitinolový samoexpandabilní výplet s polyamidovými filamenty, sloužící k extrakci embolu či trombu, dodáván ve velikosti 5 × 35 mm a pro tepny o rozměrech 1–3 mm byl používán k vytažení embolu speciální systém podobný kartáčku s nylonovými vlákny – Phenox Clot Retriever® (Phenox GmbH, Bochum, Německo). Tyto dvě extrakční zařízení byly nahrazeny dnes hojně užívaným extrakčním zařízením pREset Thrombectomy Device (Phenox GmbH, Bochum, Německo). pREset je laserově vyřezávaný, samoexpandibilní nitinolový systém velikosti 4 × 20 a 6 × 30 mm za použití mikrokatetru o průměru 0,021“ pro proximální okluze arteria cerebri media (ACM) a T uzávěr vniřní karotidy. Modifikovaná verze pREset LITE je dodávána ve velikostech 3 × 20 a 4 × 20 mm, je kompatibilní s mikrokatetry o průměru 0,0165“ a určena pro menší průměry tepen [26].
Z dalších stent-retrieverů používaných k endovaskulární mechanické embolektomii u pacientů léčených pro iCMP je třeba zmínit Revive (Codman), MindFrame (MindFrame Inc.), ReStore (Reverse Medical), ERIC Retrieval Device (Microvention).
V roce 2013 byly publikovány výsledky tří randomizovaných studií (IMS III, SYNTHESIS a MR RESCUE), které srovnávaly mechanickou endovaskulární léčbu uzávěru mozkové tepny s IVT [27–29]. I přesto, že primární výsledky neprokázaly superioritu endovaskulární léčby, sekundární analýzy ukázaly mnohem lepší klinický efekt pro pacienty léčené endovaskulárně včas v porovnání se samotnou IVT. Zcela nový pohled na superioritu endovaskulární léčby v léčbě iCMP v přední mozkové cirkulaci přinesly výsledky pěti randomizovaných studií v roce 2015.
V nizozemské studii MR CLEAN (Multicentric Randomized Clinical Trial of Endovascular Treatment for Acute Ischemic Stroke in Netherlands) [30] bylo 500 pacientů rozděleno do dvou skupin. V první skupině byla použita intraarteriální léčba (vč. intraarteriální trombolýzy či mechanické extrakce embolu do 6 hod od začátku příznaků) a běžná léčba (vč. IVTL). V kontrolní skupině byla použita běžná léčba (vč. IVTL). Ve skupině 233 nemocných randomizovaných pro endovaskulárni léčbu byla tato použita v 84,1 %. Mechanická embolektomie pomocí stent-retrieverů byla použita v 81,7 %. Výborné rekanalizace (TICI 2b a 3) bylo dosaženo v 58,7 % ve skupině nemocných léčených endovaskulárně. Výsledky studie hodnocené po 90 dnech od léčby prokázaly vyšší soběstačnost nemocných (mRS 0–2) ve skupině endovaskulárně léčených (32,6 %) v porovnání s 19,1 % pacientů léčených běžnou léčbou. Mezi skupinami nebyl rozdíl v mortalitě či v četnosti symptomatické intracerebrální hemoragie.
Australská studie EXTEND-IA (EXtending the time for Thrombolysis in Emergency Neurological Deficits with Intra-Arterial therapy) sledovala, zda pokročilý zobrazovací protokol, použití stent-retrieveru a včasná intervence zlepší klinické výsledky. Výsledkem studie bylo časné zlepšení (o více než 8 bodů NIHSS) ve třech dnech u 80 % pacientů léčených endovaskulárně v porovnání s kontrolní skupinou (37 %) léčenou standardními farmakologickými postupy [31]. Do studie ESCAPE (Endovascular treatment for Small Core and Anterior Circulation Proximal occlusion with Emphasis on minimizing CT to recanalization times) bylo zařazeno 316 nemocných s ukončením dalšího náboru pacientů pro jednoznačně lepší klinický výsledek endovaskulární léčby v porovnání s kontrolní skupinou, kde slušného klinického výsledku mRS 0–2 bylo dosaženo u 53 % pacientů léčených trombektomií v porovnání s 29,3 % pacientů v kontrolní skupině [32].
Podobného výsledku bylo dosaženo v další studii SWIFT PRIME (Solitaire With the Intention For Thrombectomy as PRIMary treatment for acute ischemic strokE), která byla zastavena po náboru 196 pacientů, taktéž rozdělených do dvou skupin. Výsledkem této studie bylo dosažení mRS 0–2 po 90 dnech od výkonu u 60,2 % pacientů léčených endovaskulárně v porovnání s 35,5 % nemocných léčených v kontrolní skupině [33].
Studie REVASCAT (Randomized trial of Revascularization With Solitaire FR Device Versus Best Medical Therapy in the Treatment of Acute Stroke Due to Anterior Circulation Large Vessel Occlusion Presenting Within 8 Hours of Symptom Onset) randomizovala 206 pacientů s iCMP rozdělených do dvou skupin, kde výsledkem bylo dosažení fyzické soběstačnosti (mRS 0–2) po 90 dnech od výkonu v poměru 43,7 % vs. 28,2 % ve prospěch endovaskulární léčby [34].
V porovnání se studiemi z roku 2013 využívajícími první generaci mechanických trombektomických zařízení (IMS III, SYNTHESIS a MR RESCUE) prokázalo pět randomizovaných klinických studií z roku 2015 (MR CLEAN, EXTEND-IA, ESCAPE, SWIFT PRIME a REVASCAT) jednoznačně superioritu endovaskulární léčby iCMP v porovnání s intravenózní trombolýzou za použití rekombinantního tkáňového aktivátoru plazminogenu bez signifikantně zvýšené četnosti mortality či intracerebrální hemoragie [35]. Výsledky metaanalýzy těchto studií ukazují zlepšení funkčních výsledků a dosažení vyšší míry funkční nezávislosti po 90 dnech u pacientů léčených endovaskulární terapií s převažujícím využitím druhé generace mechanických trombektomických zařízení v porovnání se systémovou trombolytickou terapií.
Ve vertebrobazilárním povodí je neléčený, akutní uzávěr spojen s téměř 100% mortalitou [3]. Intravenózní trombolýza je tedy i v zadním povodí standardní léčbou iCMP a včasná rekanalizace zde hraje zásadní roli v ovlivnění morbidity a mortality pacienta. I proto je zde jednoznačně doporučována endovaskulární rekanalizace uzávěru, i když dle metaanalýzy 45 klinických studií při iCMP v bazilárním povodí bylo zjištěno, že k prevenci jedné smrti a funkční soběstačnosti pacienta je nutno léčit tři nemocné s touto život ohrožující diagnózou [36].
Další možností rekanalizace uzávěru mozkových tepen je technika přímé aspirace trombu či embolu. Ve studii ADAPT (A Direct Aspiration, First Pass Technique) bylo porovnáváno 243 pacientů, z nichž 124 bylo léčeno aspirací a 119 pacientů ME pomocí stent-retrieveru Solitaire FR. NIHSS skóre bylo u obou skupin podobné, podobná byla i doba od punkce do rekanalizace. Technika přímé aspirace měla v porovnání s MT vyšší úspěšnost rekanalizace 82,3 vs. 68,9 % za srovnatelného počtu komplikací [37].
Závěr
Od roku 2015 je kombinovaná systémová trombolýza a v co nejkratším čase prováděná MT, event. kombinovaná s lokální intraarteriální aplikací trombolytika, léčbou volby uzávěru velkých mozkových tepen v předním i zadním povodí do prvních 4,5 hod od vzniku klinických příznaků. Tato kombinace spojuje výhody všech metod a zvyšuje šanci na rychlé dosažení rekanalizace. Z faktorů ovlivňujících klinický výsledek u pacientů s iCMP (v době zahájení terapie NIHSS skóre, věk, lokalizace a délka uzávěru tepny, přítomnost kolaterál) hraje nejvýznamnější roli především čas od vzniku příznaků do rekanalizace a dosažení vlastní rekanalizace. Z technického hlediska tedy vede k nejefektivnějšímu zlepšení rekanalizačního času a počtu dosažených rekanalizací použití MT v kombinaci s iniciální intravenózní trombolýzou.
Heslo „Čas je mozek“ je tedy klíčem k včasné rekanalizaci akutního symptomatického uzávěru mozkové tepny, které významně zvyšuje šanci na dobrý klinický výsledek a zotavení pacientů po prodělané iCMP.
Doručeno do redakce: 29. 7. 2016
Přijato po recenzi: 10. 8. 2016
MUDr. Jiří Kozák
nemocnicevitkovice.agel.cz
dr.jurka@seznam.cz
Zdroje
1. Truelsen T, Piechowski-Jóźwiak B, Bonita R et al. Stroke incidence and prevalence in Europe: a review of available data. Eur J Neurol 2006; 13: 581–598.
2. Fieschi C, Argentino C, Lenzi GL et al. Clinical and instrumental evaluation of patients with ischemic stroke within the first six hours. J Neurol Sci 1989; 91: 311–321.
3. Mattle HP, Arnold M, Lindsberg PJ et al. Basilar artery occlusion. Lancet Neurol 2011; 10: 1002–1014. doi: 10.1016/S1474-4422 (11) 70229-0.
4. Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke 2007; 38: 967–973.
5. von Kummer R, Holle R, Gizyska U et al. Interobserver agreement in assessing early CT signs of middle cerebral artery infarction. AJNR Am J Neuroradiol 1996; 17: 1743–1748.
6. Barber PA, Demchuk AM, Zhang J et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. Lancet 2000; 355: 1670–1674.
7. Jauch EC, Saver JL, Adams HP et al. Guidelines for the early management of patients with acute ischemic stroke. Stroke 2013; 44: 870–947.
8. European Stroke Organisation (ESO) Executive Committee; ESO Writing Committee. Should the time window for intravenous thrombolysis be extended? Available from: http: //www.eso-stroke.org/pdf/ESO_Guideline_Update_Jan_2009.pdf.
9. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333: 1581–1588. doi: 10.1056/NEJM19 9512143332401
10. Hacke W, Kaste M, Bluhmki E et al. ECASS 3 Investigators. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359: 1317–1329. doi: 10.1056/NEJMoa0804 656.
11. Külkens S, Hacke W. Thrombolysis with alteplase for acute ischemic stroke: review of SITS-MOST and other Phase IV studies. Expert Rev Neurother 2007; 7: 783–788.
12. Lee KY, Han SW, Kim SH et al. Early recanalization after intravenous administration of recombinant tissue plasminogen activator as assessed by pre- and post-thrombolytic angiography in acute ischemic stroke patients. Stroke 2007; 38: 192–193.
13. Krajina A, Krajíčková D, Špriňar Z et al. Mechanická perkutánní extrakce embolu při akutní cévní mozkove přihodě: kasuistika a přehled literatury. Cesk Slov Neurol 2005; 65/101: 51–57.
14. Smith WS. Safety of mechanical thrombectomy and intravenous tissue plasminogen activator in acute ischemic stroke. Results of the multi Mechanical Embolus Removal in Cerebral Ischemia (MERCI) trial part I. AJNR Am J Neuroradiol 2006; 27: 1177–1182.
15. Smith WS, Sung G, Saver J et al. Multi MERCI Investigators. Mechanical thrombectomy for acute ischemic stroke: final results of the Multi MERCI Trial. Stroke 2008; 39: 1205–1212. doi: 10.1161/STROKEAHA.107.497115.
16. Penumbra Pivotal Stroke Trial Investigators. The penumbra pivotal stroke trial: safety and effectiveness of a new generation of mechanical devices for clot removal in intracranial large vessel occlusive disease. Stroke 2009; 40: 2761–2768. doi: 10.1161/STROKEAHA.108.544957.
17. Widimský P, Kožnar B, Vaško P et al. Acute myocardial infarction and acute stroke: what are the differences? Focus on reperfusion therapy. Cor Vasa 2013; 55: e111–e116.
18. Mahon BR, Nesbit GM, Barnwell SL et al. North American clinical experience with the EKOS MicroLysUS infusion catheter for the treatment of embolic stroke. AJNR Am J Neuroradiol 2003; 24: 534–538.
19. Krajina A, Krajíčková D, Lojík M et al. Endovaskularni rekanalizace při lečba akutnich uzavěrů mozkovych tepen. Cesk Slov Neurol N 2010; 73/106: 678–684.
20. Machi P, Costalat V, Lobotesis K et al. Solitaire FR thrombectomy system: immediate results in 56 consecutive acute ischemic stroke patients. J Neurointerv Surg 2012; 4: 62–66. doi: 10.1136/jnis. 2010.004051.
21. Roth C, Papanagiotou P, Behnke S et al. Stent- -assisted mechanical recanalization for treatment of acute intracerebral artery occlusions. Stroke 2010; 41: 2559–2567. doi: 10.1161/STROKEAHA.110.592071.
22. Seifert M, Ahlbrecht A, Dohmen C et al. Combined interventional stroke therapy using intracranial stent and local intra-arterial thrombolysis (LIT). Neuroradiology 2011; 53: 273–282. doi: 10.1007/s00234-010-0719-0.
23. Nogueira RG, Lutsep HL, Gupta R et al. Trevo versus Merci retrievers for thrombectomy revascularisation of large vessel occlusions in acute ischaemic stroke (TREVO 2): a randomised trial. Lancet 2012; 380: 1231–1240. doi: 10.1016/S0140-6736 (12) 61299-9.
24. Saver JL, Jahan R, Levy EI et al. Solitaire flow restoration device versus the Merci Retriever in patients with acute ischaemic stroke (SWIFT): a randomised, parallel-group, non-inferiority trial. Lancet 2012; 380: 1241–1249. doi: 10.1016/S0140-6736 (12) 61 384-1.
25. Mourand I, Brunel H, Costalat V et al. Mechanical thrombectomy in acute ischemic stroke: catch device. AJNR Am J Neuroradiol 2011; 32: 1381–1385. doi: 10.3174/ajnr.A2563.
26. Leading Product Innovatorin Interventional Neuroradiology. Available from: www.phenox.net.
27. Broderick JP, Palesch YY, Demchuk AM et al. Endovascular therapy after intravenous rt-PA versus t-PA alone for stroke. N Engl J Med 2013; 368: 893–903. doi: 10.1056/NEJMoa1214300.
28. Kidwell SC, Jahan R, Gornbein J et al. A trial of imaging selection and endovascular treatment for ischemic stroke. N Engl J Med 2013; 368: 914–923. doi: 10.1056/NEJMoa1212793.
29. Ciccone A, Valvassori L, Nichelatti M et al. Endovascular Treatment for acute ischemic stroke. N Engl J Med 2013; 368: 904–913. doi: 10.1056/NEJMoa1213701.
30. Berkhemer OA, Fransen PS, Beumer D et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015; 372: 11–20. doi: 10.1056/NEJMoa1411587.
31. Campbell BC, Mitchell PJ, Kleinig TJ et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015; 372: 1009–1018. doi: 10.1056/NEJMoa1414792.
32. Goyal M, Demchuk AM, Menon BK et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372: 1019–1030. doi: 10.1056/NEJMoa1414905.
33. Saver JL, Goyal M, Bonafe A et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015; 372: 2285–2295. doi: 10.1056/NEJMoa1415061.
34. Jovin TG, Chamorro A, Cobo E et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med 2015; 372: 2296–2306. doi: 10.1056/NEJMoa1503780.
35. Bush CK, Kurimella D, Cross LJ et al. Endovascular treatment with stent-retriever devices for acute ischemic stroke: a meta-analysis of randomized controlled trials. PLoS One 2016; 11: e0147287. doi: 10.1371/journal.pone.0147287.
36. Kumar G, Shahripour RB, Alexandrov AV. Recanalization of acute basilar artery occlusion improves outcomes: a meta-analysis. J Neurointervent Surg 2015; 7: 868–874. doi: 10.1136/neurintsurg-2014-011418.
37. Lapergue B, Blanc R, Guedin P et al. A Direct Aspiration, First Pass Technique (ADAPT) versus stent retrievers for acute stroke therapy: an observational comparative study. AJNR Am Neuroradiol 2016. [Epub ahead of print].
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2016 Číslo 3
Nejčtenější v tomto čísle
- Betablokátory, které nejméně negativně ovlivňují kardiorespirační zdatnost u zdravých osob
- Endovaskulární léčba ileofemorální hluboké žilní trombózy
- Možnosti endovaskulární léčby akutní končetinové ischemie
- Disekce aorty typu B s těžkou viscerální a končetinovou ischemií řešená kompletní endovaskulární revaskularizací – kazuistika
