Terapie akutní ischemické cévní mozkové příhody
Therapy of acute ischemic stroke
Most of ischemic strokes are caused by acute extra- or intracranial thromboembolic lesion causing artery obstruction. It has been demonstrated that recanalization is the most important modifiable predictor of a good clinical outcome. Reperfusion strategies stated below focus on early reopening of the vessel to reestablish antegrade flow within the penumbra.
Keywords:
ischemic stroke – penumbra – recanalisation – systemic trombosis – intravenous thrombolysis – mechanical recanalisation
Autoři:
MUDr. David Goldemund
Působiště autorů:
1. neurologická klinika LF MU a FN u sv. Anny, Brno
david. goldemund@fnusa. cz
; Mezinárodní centrum klinického výzkumu (ICRC)
Vyšlo v časopise:
Kardiol Rev Int Med 2013, 15(1): 26-32
Kategorie:
Cévní mozkové příhody
Souhrn
Většina ischemických CMP vzniká na podkladě okluze krční a/nebo mozkové tepny. Opakovaně bylo prokázáno, že včasná rekanalizace je hlavním modifikovatelným prognostickým faktorem dobrého výsledného klinického stavu. Reperfuzní strategie uvedené v následujícím textu se zaměřují na dosažení časné rekanalizace a obnovení průtoku krve v oblasti penumbry (ischemického polostínu).
Klíčová slova:
ischemická cévní mozková příhoda – penumbra – rekanalizace – systémová trombolýza – intravenózní trombolýza – mechanická rekanalizace
Úvod
Cévní mozkové příhody (CMP) jsou celosvětově druhou nejčastější příčinou úmrtí. Cílem léčby CMP není pouhé snížení mortality, ale hlavně zachování soběstačnosti pacienta. K hodnocení stavu pacienta v akutním stadiu používáme škálu NIHSS (National Institute of Health Stroke Scale). Tato škála umožňuje, aby různí vyšetřující hodnotili pacienty obdobně a výsledky studií či registrů tak byly srovnatelné. Čím více bodů, tím těžší je deficit (1–4 = lehký iktus, 5–15 = středně těžký iktus, > 16 = těžký iktus). K hodnocení výsledku léčby (outcome) používáme škálu mRS (modified Rankin Scale). Za úspěšné vyléčení je považována hodnota ≤ 1, resp. ≤ 2 v závislosti na iniciální tíži neurologického deficitu. MRS standardně hodnotíme po třech měsících od příhody.
Asi 80 % všech CMP tvoří ischemické CMP (iCMP), z nichž většina (dle angiografických studií asi 80 %) vzniká na podkladě okluze mozkové tepny. Při poklesu krevního průtoku z normálních hodnot (> 50 ml/100 g tkáně/min) na hodnotu mezi 12–18 ml/100 g/min vzniká reverzibilní porucha funkce (penumbra). Neurony penumbry zůstávají vitální minuty až hodiny po okluzi tepny a celý proces je reverzibilní. Klesne-li perfuze pod 12 ml/100 g mozkové tkáně/min, následuje nekróza mozkové tkáně. Pacienti, u kterých dojde k rekanalizaci uzavřené mozkové tepny, mají dle klinických studií po třech měsících až 13krát větší šanci, že nezůstanou invalidní [1]. Rekanalizace je tak nejvýznamnějším modifikovatelným prognostickým faktorem a současně jedinou prokazatelně účinnou terapií u pacientů s akutní ischemickou CMP (iCMP). Kromě rekanalizace je známo několik dalších významných modifikovatelných i nemodifikovatelných prognostických faktorů, které výsledný stav pacienta ovlivňují.
- Čas od rozvoje příznaků k zahájení terapie (onset to treatment – OTT)
Z analýzy šesti nejvýznamnějších trombolytických studií vyplývá, že důležitým faktorem pro dobrý výsledný klinický stav je čas od rozvoje příznaků k zahájení reperfuzní terapie. Při podání trombolýzy v čase 0–90 min je šance na vyléčení dvojnásobná oproti zahájení terapie po 181. minutě (proto heslo „time is brain“) [2]. - Přítomnost okluze na MR-angiografii//CT-angiografii
Pacienti s absencí okluze na vstupním CTA/MRA mají lepší prognózu než pacienti s prokázanou okluzí tepny (OR 5,0) a mají také nižší vstupní NIHSS (medián 18 vs 7) [3]. - Věk pacienta
V multivarietní analýze studie SITS-MOST byl vyšší věk spojen s horší prognózou [4]. - Vstupní NIHSS
- Výše NIHSS koreluje s pravděpodobností okluze tepny. Vysoká pravděpodobnost okluze je při NIHSS ≥ 10. Vstupní NIHSS je současně prediktorem výsledného stavu, neboť dobrého výsledného klinického stavu (mRS 0–2) je dosaženo až u 50 % pacientů s mediánem vstupního NIHSS 10, ale jen u 10 % s mediánem NIHSS 18 [4].
- Přítomnost kolaterální mozkové cirkulace
Přítomnost dobrého kolaterálního oběhu koreluje s menším jádrem infarktu a predikuje lepší výsledný klinický stav při reperfuzní terapii [5,6]. - Přítomnost časných známek ischemie na vstupním CT
Čím dříve dojde k rozvoji časných známek, tím závažnější ischemii lze předpokládat. ASPECT skóre koreluje se vstupní hodnotou NIHSS a umožňuje predikci výsledného stavu i rizika symptomatické hemoragie. Horší výsledek lze očekávat u skóre ≤ 6, naopak ≥ 7 bodů predikuje dobrou odpověď na reperfuzní terapii (až třikrát vyšší šance na dosažení nezávislosti oproti šesti a méně bodům) [7].
Následující část podává přehled metod, kterými můžeme rekanalizace uzavřené tepny dosáhnout.
Přehled reperfuzních metod:
- intravenózní trombolýza
- endovaskulární terapie
- intraarteriální trombolýza
- mechanická rekanalizace
- stent retriever (SOLITAIRE, TREVO, BONNET)
- mechanická disrupce trombu mikrokatetrem
- proximální trombektomie (PENUMBRA, EKOS system, EPAR)
- distální trombektomie (MERCI)
- akutní PTA/STNT
- kombinované výkony
- IVT + mechanická rekanalizace/IAT
- sonotrombolýza (IVT + transkraniální ultrazvuk)
- emergentní chirurgické výkony
Základem léčby akutní iCMP je intravenózní aplikace tkáňového aktivátoru plazminogenu (tPA). Ostatní reperfuzní metody používáme jako rescue terapii při selhání intravenózní trombolýzy (IVT) nebo pokud je IVT kontraindikována.
Intravenózní trombolýza (IVT)
Studie s intravenózní TL byly hojně publikovány v posledních 18 letech, zde tedy uvádíme jen stručný přehled těch zásadních.
Studie NINDS (The National Institute of Neurological Disorders and Stroke tPA Stroke Study, 1995) s tPA v dávce 0,9 mg/kg a časovým oknem 3 hod ukázala jednoznačně lepší výsledný stav pacientů léčených tPA ve srovnání s placebem. Pacienti měli přinejmenším o 30 % větší relativní šanci, že nebudou mít žádný deficit nebo budou mít jen minimální postižení (mRS ≤ 1) [8].
Studie ECASS3 (European Cooperative Acute Stroke Study, 2008) hodnotila účinnost a bezpečnost IVT v dávce 0,9 mg/kg mezi 3 a 4,5 hod [9]. Příznivého stavu dosáhlo více pacientů léčených alteplázou než placebem (mRS 0–1, 52,4 % vs 45,2 %; odds ratio 1,34; p = 0,04). Incidence intrakraniálního krvácení byla v aktivně léčené větvi vyšší než ve skupině placebové (všechna intrakraniální krvácení – 27,0 % vs 17,6 %, p = 0,001). Výskyt symptomatických intrakraniálních krvácení byl 2,4 % vs 0,2 % (p = 0,008), mortalita se mezi oběma sledovanými skupinami signifikantně nelišila (7,7 % vs 8,4 %). Rovněž nebyl zaznamenán žádný signifikantní rozdíl ve výskytu jiných závažných nežádoucích účinků.
Výsledky studie ECASS3 poskytly jasná data o prospěšnosti a bezpečnosti trombolytické terapie až do 4,5 hod od vzniku iCMP a v lednu 2009 došlo k aktualizaci doporučení ESO i AHA/ASA. Současná indikace intravenózní trombolýzy:
- mozkový infarkt do 4,5 hod od vzniku příznaků + významný neurologický deficit v trvání > 30 min
- významným deficitem se rozumí takový, který bude pacienta handicapovat (např. homonymní hemianopsie, paréza, porucha řeči)
Díky síti iktových center (IC) s odpovídajícím technickým i personálním vybavením je trombolytická léčba v ČR dostupná pro každého potenciálního kandidáta. Jak bylo uvedeno výše, kromě rekanalizace je významným modifikovatelným prognostickým faktorem čas od vzniku příznaků CMP do zahájení léčby. Cílem organizačních opatření na nemocniční úrovni je urychlení managementu pacientů s akutní iCMP tak, aby byla trombolýza zahájena nejpozději do 60 min od příjezdu pacienta do nemocnice (door to needle time – DTN).
Na našem pracovišti byl trombolytický program zahájen v roce 1998 [10]. Byl vytvořen trombolytický protokol určený pro rychlou orientaci lékaře aplikujícího léčbu. Obsahuje mj. seznam absolutních i relativních kontraindikací, součástí je protokol vyšetření pomocí škály NIHSS (National Institute of Health Stroke Scale), dále protokol pro střední zdravotnický personál a protokol pro management tlaku krve (TK) a eventuálních krvácivých či alergických komplikací. Všichni pacienti jsou hospitalizováni na iktové jednotce, jsou provedena CT vyšetření mozku (u většiny pacientů i CT angiografie), ultrazvukové vyšetření krčních a intrakraniálních tepen a klinické a laboratorní vyšetření. Vždy je nezbytná verifikace přesné doby vzniku CMP. Zjišťujeme, kdy byl pacient naposledy viděn zdráv a u ranních iktů opakovanými dotazy ověřujeme, zda byl pacient po probuzení skutečně v pořádku (platí především pro fatické poruchy s žádnou či minimální parézou). Pečlivou pozornost je třeba věnovat zhodnocení CT a CT angiografie. Při nálezu rozsáhlých časných známek ischemie na CT je třeba znovu ověřit čas vzniku. Při splnění indikačních kritérií podáváme tPA (Actilyse©) v celkové dávce 0,9 mg/kg, 10 % aplikujeme bolusově během 1–2 min, zbytek injektomatem po dobu jedné hodiny. V průběhu TL i po ní jsou u všech pacientů sledovány vitální funkce, neurologický nález vč. NIHSS, pátráme po hemoragických komplikacích a alergické reakci (nejčastěji otok jazyka). Zásadní je pečlivá korekce krevního tlaku s cílovými hodnotami < 180/105 mmHg během trombolýzy i 24 hod po ní. Efekt terapie je možné ověřit monitorací uzavřené tepny pomocí TCCD (obr. 1). Kontrolní CT mozku je vždy provedeno s odstupem 24–36 hod, při zhoršení stavu ihned. Pokud nedošlo k hemoragickým komplikacím, nasazujeme za 24 hod od trombolýzy antiagregační terapii jakožto časnou sekundární prevenci. S ohledem na preskripční omezení nasazujeme nejčastěji Aggrenox (dvakrát 1 tbl) nebo Anopyrin v dávce 100–300 mg.
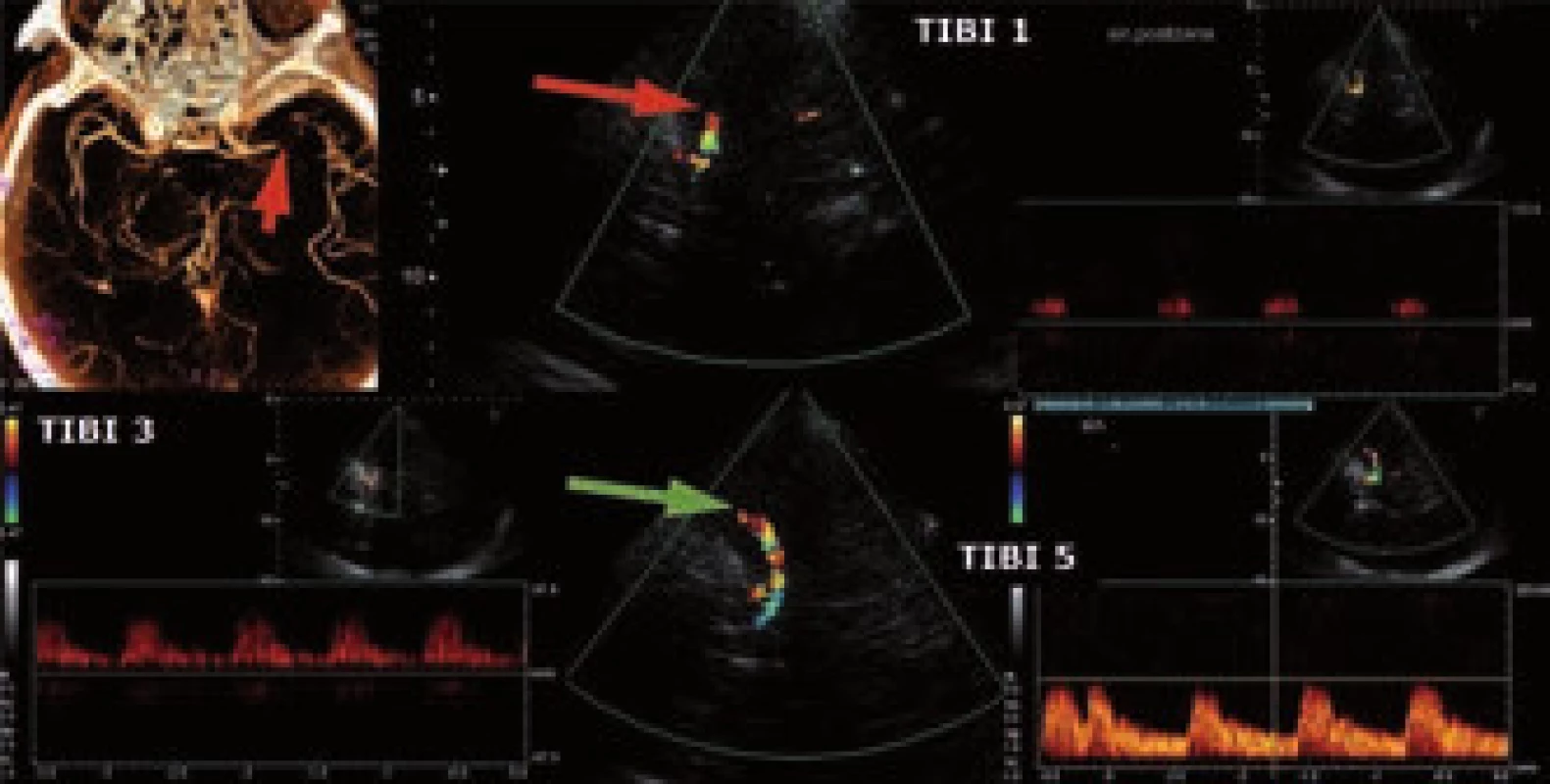
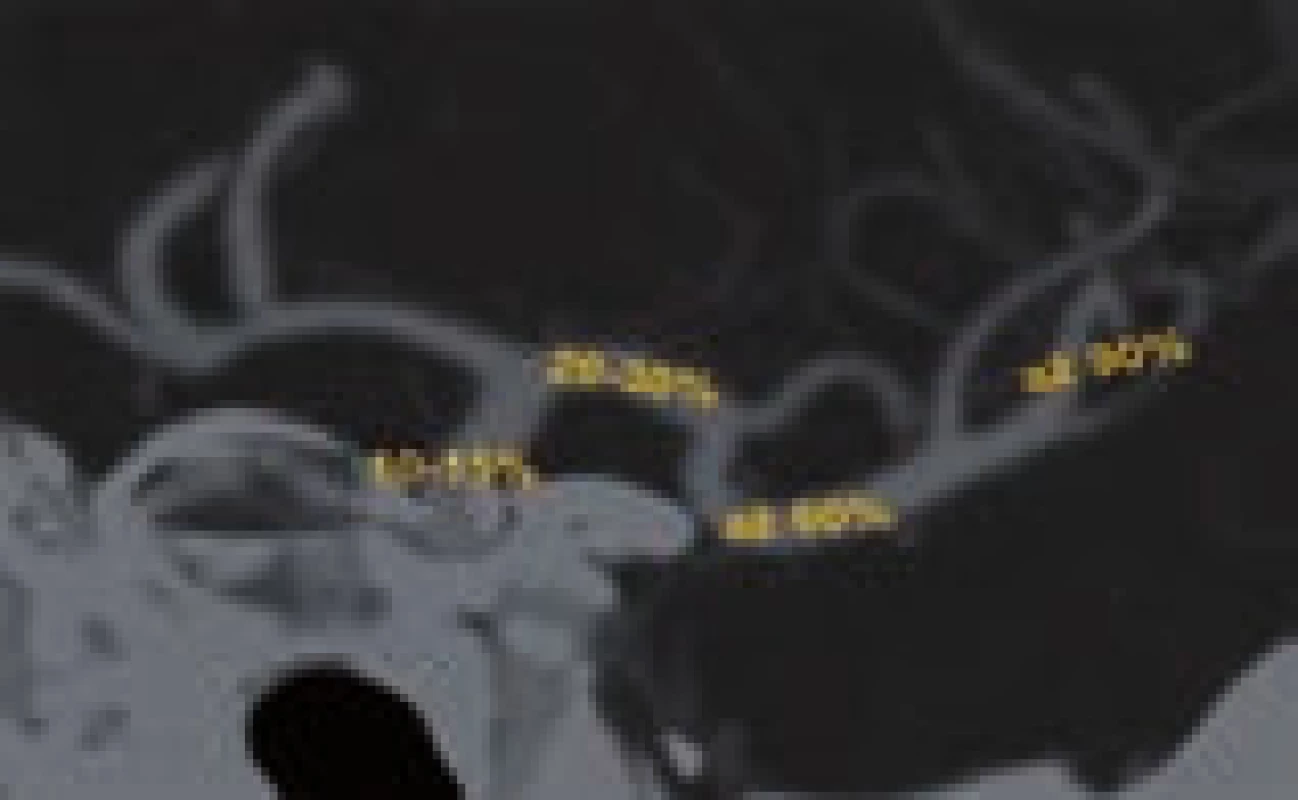
Intravenózní trombolýza je technicky jednoduchá, ale kromě limitované účinnosti na lýzu objemných trombů (kompletní rekanalizace pouze asi u 18 % pacientů s uzávěrem středním mozkové tepny do 2 hodin od podání) dovoluje díky úzkému terapeutickému oknu léčit omezenou skupinu nemocných. Pravděpodobnost rekanalizace po IVT závisí na typu uzavřené tepny (viz obr. 2). Pokud po 30 min od zahájení IVT nedojde k rekanalizaci, je třeba zvažovat tzv. rescue terapii ve formě endovaskulárního výkonu. Selhání IVT lze posoudit dle klinického stavu (NIHSS beze změny nebo pokles o < 40 %) [11] nebo na základě neurosonologického vyšetření.
Kromě alteplázy existují i novější trombolytika, která mají vyšší afinitu k fibrinu a delší poločas (desmotepláza, retepláza, tenektepláza). Očekávalo se od nich vyšší procento rekanalizací a menší riziko krvácivých komplikací. V probíhajících či již ukončených studiích je srovnávána jejich účinnost a bezpečnost s alteplázou. Velkým zklamáním v případě desmoteplázy byly výsledky studie DIAS-2 a ani ostatní preparáty se do klinické praxe zatím neprosadily. V akutní terapii je zkoušena i řada dalších látek, ať už jako monoterapie či v kombinaci s trombolytiky. Jedná se především o inhibitor trombinu argatroban [12,13] a dále protidestičkové preparáty abciximab a eptifibatide. Ani tytopreparáty nebyly schváleny k rutinnímu užití a všechny jsou vyhrazeny pouze pro účely klinických studií.
Endovaskulární výkony
Nevýhodou intervenčních zákroků je náročnost na přístrojové a personální vybavení, delší doba do zahájení terapie a možné komplikace vyplývající z vlastního endovaskulárního zákroku (distální embolizace, SAK, disekce, retroperitoneální hematom, hematom v třísle, renální selhání, alergické reakce apod.). Zprvu byla prováděna intraarteriální trombolýza, v současnosti dominují metody mechanické rekanalizace. Tyto výkony jsou indikovány společně cévním neurologem a intervenčním neuroradiologem a prováděny by měly být v komplexních cerebrovaskulárních centrech s dostatečnými zkušenostmi.
Intraarteriální a kombinovaná trombolýza (IAT)
Při intraarteriální trombolýze je trombolytikum aplikováno katetrem přímo do místa okluze. Významné studie MELT a PROACT II (tab. 1) používaly prourokinázu (r-proUK), v současné klinické praxi je na základě extrapolace výsledků studií s r-proUK používána tPA.

Je pravděpodobné, že IAT je účinnější u trombů lokalizovaných ve velkých tepnách (větší objem trombu), nicméně přímé randomizované srovnání IAT a IVT do 4,5 hod nebylo provedeno. Klinický benefit vyššího počtu rekanalizací může být u IAT neutralizován pozdějším zahájením terapie. Nebylo také potvrzeno, že by IAT představovala menší riziko IC krvácení, i když je celková dávka potřebná k rekanalizaci menší. V časovém okně do 4,5 hod má proto přednost IVT (široká dostupnost, rychlé zahájení terapie). U okluzí velkých tepen je trendem posledních let co nejrychlejší zahájení IVT („bridging therapy“) a transport pacienta na angiolinku k následné endovaskulární intervenci. Tento koncept byl studován ve studii fáze III IMS 3 (The Interventional Management of Stroke). Studie testovala standardní IVT v dávce 0,9 mg/kg oproti kombinaci IVT v dávce 0,6 mg/kg s následnou endovaskulární léčbou (IAT nebo mechanická rekanalizace). Studie byla na jaře roku 2012 předčasně zastavena pro neefektivitu kombinované terapie. Publikaci s detailní analýzou lze očekávat v letošním roce. Zajímavý bude především poměr IAT a mechanické rekanalizace a také zastoupení jednotlivých metod mechanické rekanalizace. Z intervenčních studií publikovaných v roce 2012 totiž víme, že retrievery (Solitaire, Trevo, Bonnet) mají mnohem lepší výsledky než Merci katetr. V současnosti je IAT na ústupu a přednost dostávají mechanické metody rekanalizace. V brzké době lze očekávat studie s kombinovanou terapií, kdy na standardní IVT bude navazovat mechanická rekanalizace pomocí retrieverů.
Mechanická rekanalizace
- stent retriever (SOLITAIRE, BONNET, TREVO)
- proximální trombektomie (PENUMBRA, EKOS system, EPAR)
- distální trombektomie (MERCI)
- mechanická disrupce trombu mikro-katetrem
- akutní PTA/STNT
- akutní endarterektomie
V kardiologii mechanická rekanalizace již před lety předčila metody farmakologické, v neurologii se zatím jedná o metodu doplňkovou. S výhodou lze mechanické rekanalizace využít v případě kontraindikace trombolýzy (pooperační stavy, INR > 1,7) či v případě jejího selhání. Hlavní indikací jsou okluze velkých tepen do úrovně M1-2 (viz tab. 2). Často se kombinuje více metod mechanické rekanalizace současně, výkon lze provádět po předchozí IVT a event. jej kombinovat s IAT. Opakovaně byla studiemi prokázána rychlost a vysoká efektivita v otevření tepny (úspěšnost rekanalizace nad 80 %). Co však chybí, jsou dostatečná data z randomizovaných studií o klinické prospěšnosti. S ohledem na výsledky studie IMS3 (viz výše) je doporučováno pacienty po mechanické embolektomii zařazovat do národních či mezinárodních registrů (např. SITS thrombectomy registry) s hodnocením klinického stavu po třech měsících. Jednotlivé metody jsou tedy zatím oficiálně schvalovány k odstranění trombu z tepny a nikoli k léčbě iCMP. S ohledem na výše uvedené platí, že v časovém okně do 4,5 hod má vždy přednost IVT.

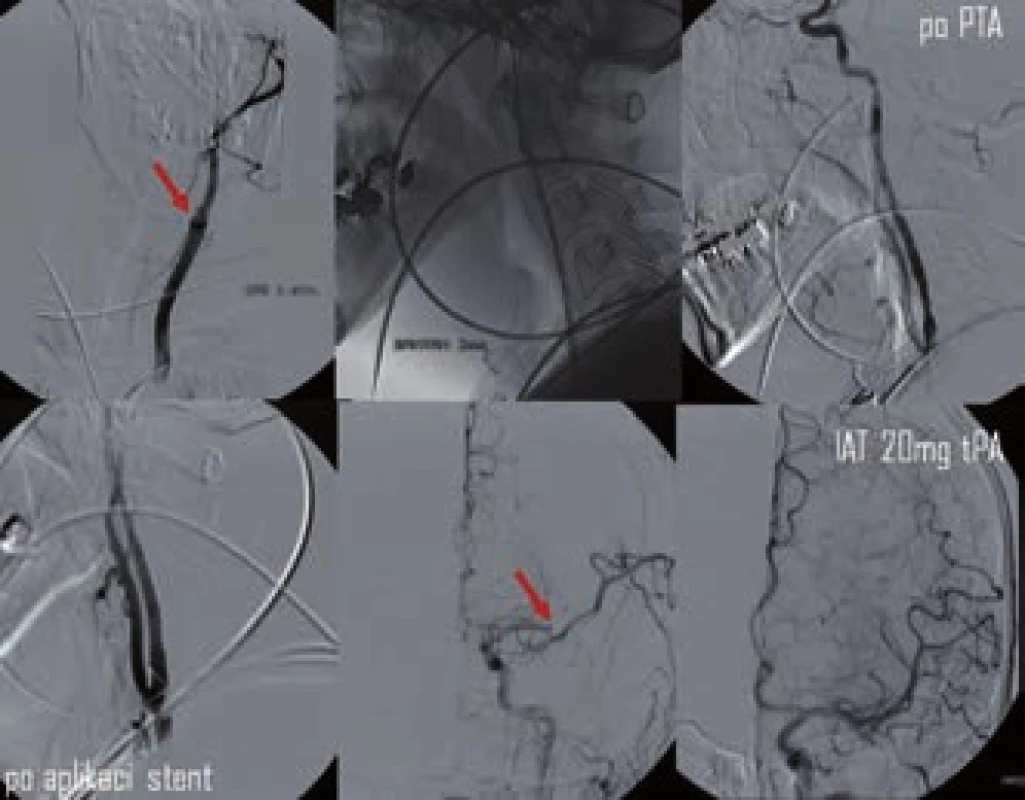
V rámci endovaskulárních výkonů je někdy potřeba řešit i akutní okluzi či těsnou stenózu a. carotis interna (obr. 3). Na rozdíl od chronických zfibrotizovaných uzávěrů lze čerstvou okluzí snadno pomocí zavaděče projít. Aplikace stentu je problematická s ohledem na nutnost duální antiagregace (po TL kontraindikované) a navíc zavádění instrumentária intrakraniálně přes stentovaný úsek může vést k lokálním komplikacím. Proto bývá v akutním stadiu často provedena jen PTA s následnou intrakraniální embolektomií. Zastentování karotidy je eventuálně provedeno s odstupem po standardní medikamentózní přípravě.
Merci katetr
Merci katetr (obr. 4) byl prvním katetrem schváleným k rekanalizaci tepny. Jedná se o speciální spirálu, kterou lze zachytit a následně stáhnout trombus nebo embolus z tepny do zavaděče. Efektivita v dosažení rekanalizace byla demonstrována ve studiích MERCI a MultiMERCI [1,16]. Jeho užití k rekanalizaci tepny připouští i zatím poslední doporučení AHA/ASA z roku 2007 [17]. U neurointervenčních radiologů nebyl tento katetr příliš v oblibě a definitivní odklon od něj budou zřejmě znamenat výsledky recentních studií TREVO-2 a SWIFT (viz dále).

Při použití retrieveru (obr. 5) je dosaženo rychlé rekanalizace přechodným rozvinutím stentu v celém rozsahu trombu (na dobu 3–10 min). Poté následuje stažení stentu i s trombem. V průběhu extrakce je doporučena proximální balónková okluze tepny a současná aspirace k dosažení retrográdního toku. V současnosti není povoleno trvalé odpoutání stentu, metodu lze ale kombinovat s lokálním podáním tPA.
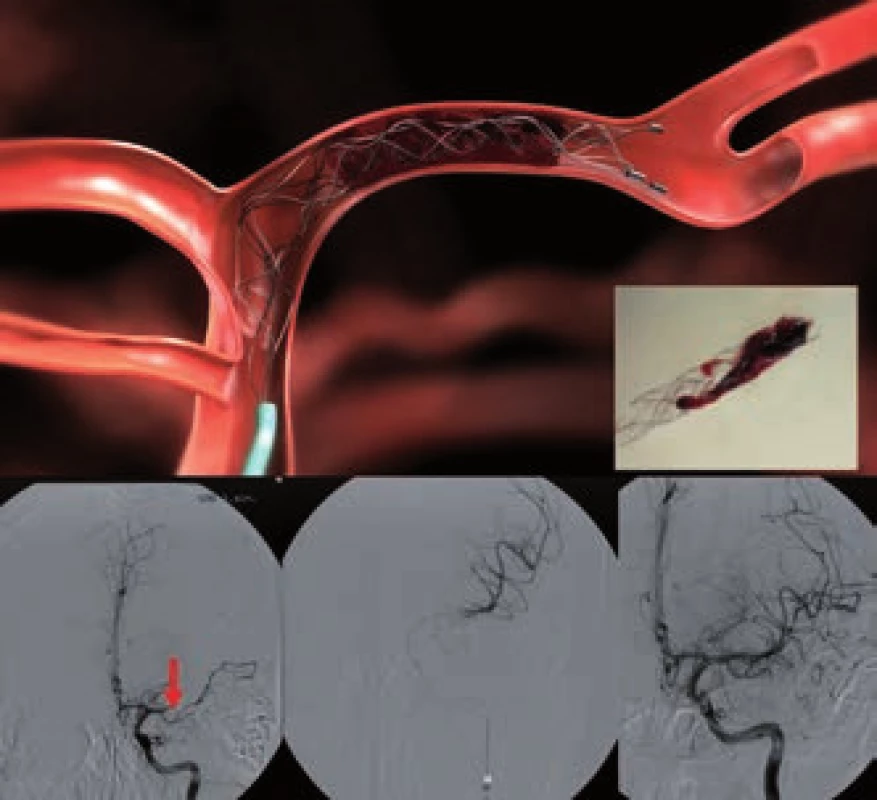
Metaanalýza šesti evropských studií zahrnovala 141 pacientů (mean NIHSS 18) s okluzí intrakraniální cévy léčených systémem Solitaire FR [18]. Rekanalizace bylo dosaženo v 86 % případů, z nich 55 % dosáhlo příznivého klinického stavu. Přímé srovnání Solitaire s Merci katetrem přinesla v roce 2012 studie SWIFT [19]. Dle ní Solitaire dosáhl lepšího výsledku ve smyslu četnosti rekanalizace, bezpečnosti i dobrého výsledného klinického stavu než Merci katetr. Stejně tak studie TREVO-2 prokázala lepší efektivitu retrieveru TREVO ve srovnání s MERCI katetrem [20].
Penumbra
Proximální trombektomie kombinuje mechanickou disrupci trombu s aspirací jeho fragmentů. Díky aspiraci lze očekávat menší riziko distální embolizace oproti mechanické disrupci běžným katetrem. Ve studii Penumbra Pivotal Stroke Trial se 125 pacienty bylo dosaženo rekanalizace (TIMI 2–3) v 82 %. Navzdory tomu ale jen 37 % pacientů s úplnou nebo částečnou rekanalizací dosáhlo dobrého výsledného stavu (mRS 0–1) [21]. FDA schválila v roce 2008 Penumbru na základě dat o rekanalizačním potenciálu metody bez jasně prokázaného klinického benefitu (podobně jako ostatní extraktory).
Akutní stentování
Data týkající se stentování u akutního mozkového infarktu jsou omezená, randomizované studie nejsou k dispozici. Bylo publikováno několik malých studií, které prokázaly vysoký rekanalizační potenciál stentingu mezi 79 až 95 %, nejsou však randomizované studie k prokázání klinického efektu. Dle AHA/ASA guidelines z roku 2007 je postup považován za experimentální. Preferovány jsou samoexpandibilní stenty, výhodou ve srovnání s jinými metodami je rychlost, s jakou je rekanalizace dosaženo. Nevýhodou stentování je:
- komprese trombu k cévní stěně → riziko okluze perforátorů
- vysoký počet restenóz (až 32 %)
- nutnost následné duální antiagregační terapie k prevenci restenózy/trombózy → zvýšené riziko krvácení
Sonotrombolýza
Ultrazvuk o vysoké frekvenci (~ 2 MHz) a nízké intenzitě vede k akceleraci enzymatických procesů vyvolaných trombolytikem (sonotrombolýza) a je možné ho aplikovat i externě pomocí komerčních transkraniálních a duplexních dopplerovských přístrojů. Efekt se vysvětluje zlepšeným průnikem trombolytika do trombu, změnou mikrostruktury trombu a zlepšenou vazbou trombolytika na fibrin [22].
Studie CLOTBUST [23] prokázala v souboru 126 pacientů statisticky signifikantně vyšší počet kompletních rekanalizací u pacientů léčených systémovou trombolýzou v kombinaci s dvouhodinovým TCD monitorováním (31 ze 63, 49 %) oproti samostatné trombolýze (19 ze 63, 30 %, p = 0,03). Byl patrný i trend k lepšímu výslednému klinickému stavu, nicméně studie neměla dostatečnou sílu a výsledky nebyly statisticky signifikantní (mRS 0 a 1 za tři měsíce bylo dosaženo ve skupině léčených tPA se současnou UZ monitorací u 42 %, ve skupině léčené pouze tPA u 29 %, p = 0,2). K symptomatickému IC krvácení došlo v každé skupině u tří pacientů (4,7 %).
Dle řady in vitro i humánních klinických studii (DEFINITI, TUCSON) použití echokontrastu během sonotrombolýzy dále zvyšuje rekanalizační potenciál sonotrombolýzy (na designu a provedení obou studií jsme se podíleli) [24,25].
Sonotrombolytické studie sice prokázaly vyšší pravděpodobnost rekanalizace oproti samotné IVT, neměly ale dostatečnou sílu k průkazu klinického benefitu, a postup je proto nadále považován za experimentální [17].
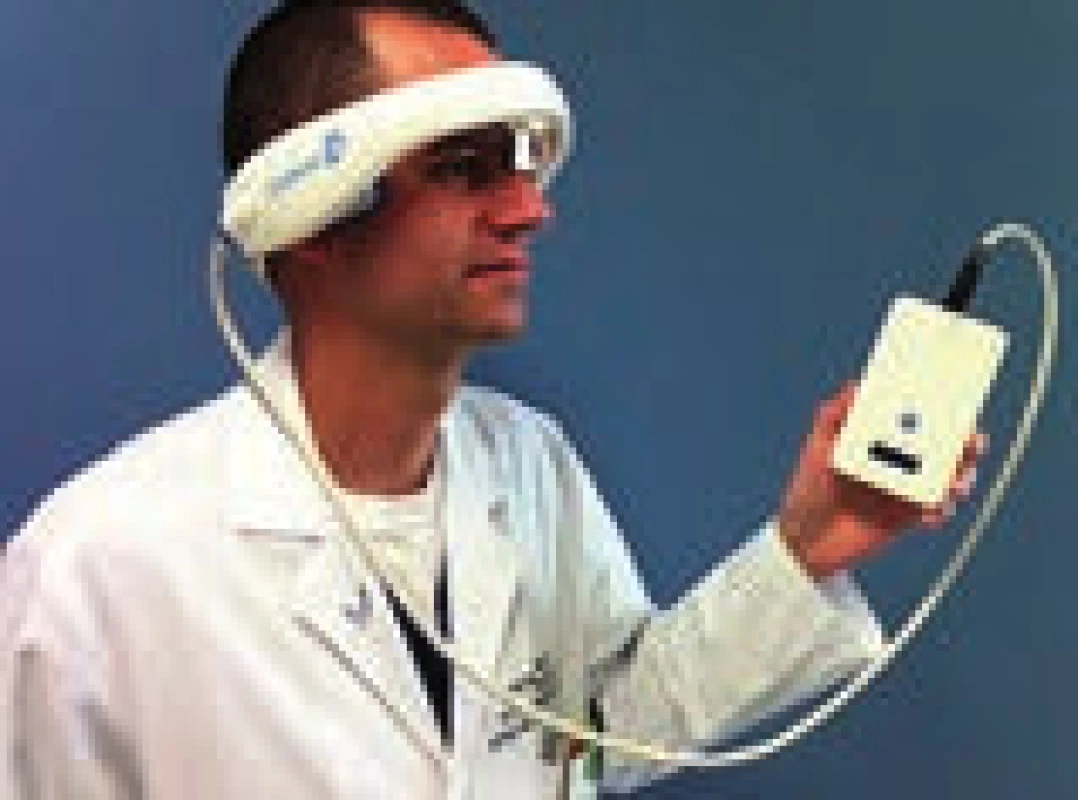
Velkou překážkou v dalším rozvoji sonotrombolýzy i v provedení velké studie, která by měla sílu prokázat předpokládaný klinický efekt, byla a je nedostupnost zkušených sonografistů. Jednou z možností, jak sonotrombolýzu uvést do běžné praxe, je vytvoření automatických přístrojů, které nevyžadují přítomnost zkušeného operátora. Pilotní studií s přístrojem CLOTBUST-ER firmy Cerevast (obr. 6) byla studie CLOTBUST-HF. Do studie bylo zařazeno 20 pacientů s proximální intrakraniální okluzí (70 % ACM, medián NIHSS 15). Všichni pacienti tolerovali dvouhodinovou insonaci přístrojem a u žádného nedošlo k rozvoji IC krvácení. Po 2 hod bylo plné rekanalizace dosaženo u osmi pacientů (40 %) a u dvou pacientů (10 %) došlo k rekanalizaci parciální. Tyto výsledky jsou velmi povzbudivé, je dosaženo minimálně dvojnásobné rekanalizace oproti samotné IVT a technické provedení je přitom rychlé a snadné. V současnosti je plánována velká multicentrická studie (~ 800 pacientů), na jejímž designu se podílelo i naše centrum a která má za úkol prokázat klinický benefit tohoto postupu.
Emergentní endarterektomie
Pro případné doporučení není k dispozici dostatek dat o efektivitě a bezpečnosti metody [17]. Při současné těsné stenóze či okluzi ACI a intrakraniální okluzi je preferováno endovaskulární ošetření karotidy pomocí PTA s navazující intrakraniální trombektomií. Emergentní CEA lze zvážit u:
- crescendo TIA nebo stroke in evolution s počátečním lehkým deficitem a malou ischemií na CT/MR, která vznikla na podkladě těsné stenózy či trombotické okluze ACI s předpokládaným hypoperfuzním mechanizmem
- akutní revize trombózy ACI po CEA
Současný stav rekanalizační léčby akutních mozkových infarktů v ČR
V souladu s národním cerebrovaskulárním programem byla vytvořena síť iktových center (IC) a na ně navazujících komplexních iktových center (KCC). Tento krok má za cíl zvýšit počet pacientů s CMP, kterým bude co nejrychleji poskytnuta účinná terapie. Iktová centra (IC) provádějí základní diagnostiku a podávají intravenózní trombolýzu. Komplexní iktová centra jsou potom schopna provést veškeré výše uvedené rekanalizační postupy. Překlad z IC do KCC, event. primární transfer pacienta do KCC je třeba zvážit v těcho případech:
- okluze velké tepny < 8 hod od vzniku příznaků prokázána pomocí CTA, MRA nebo neurosonologickým vyšetřením, přičemž je kontraindikována IVT a je významný deficit. Při intrakraniální akutní okluzi a nízkém NIHSS je vysoké riziko selhání kolaterál a progrese deficitu → vždy zvážit intervenci
- přetrvávající okluze velké tepny na konci IV trombolýzy s trvajícím významným deficitem
- většinou NIHSS ≥ 4, aktuální deficit ale nemusí být rozhodující, klinický stav může kolísat a řada pacientů s akutní okluzí nakonec zprogreduje, pokud není dosaženo rekanalizace
- okluze je verifikována UZ, CTA nebo MRA, event. ji lze předpokládat, pokud nedojde k poklesu NIHSS o > 40 %
- při předpokládaném intervenčním výkonu (okluze velké tepny, rozsáhlý trombus) je vhodné pacienta poslat již v průběhu trombolýzy
- pacienti < 60 let s rizikem maligní ischemie (dekompresní kraniektomie)
- pacienti s disekcí tepny indikovaní k intervenčnímu výkonu
Závěr a přehled terapie
Základem akutní terapie zůstává i nadále intravenózní trombolýza. Důraz je kladen na její co nejrychlejší zahájení. Jsou diskutována organizační opatření v rámci zdravotnických zařízení, která zkrátí čas od příjezdu do podání léčby (door to needle time – DTN). Ten by neměl přesáhnout 60 min a dle recentních iniciativ by měl být dokonce pod 40 min. Další kroky souvisí se zvyšováním povědomí obyvatel o příznacích CMP i nutnosti okamžitého volání 155 v případě jejich rozpoznání [11,26].
Nevýhodou široce dostupné a technicky nenáročné intravenózní trombolýzy je úzké terapeutické okno a relativně nízká účinnost. Dlouhodobě se výzkum soustřeďuje na zvýšení účinnosti trombolýzy (např. sonotrombolýza, kombinace s jinými léky) a na prodloužení terapeutického okna. Sonotrombolýza naráží na nedostatek sonografistů, což možná v budoucnu vyřeší automatické přístroje. Studie kombinující IVT s jinými léky byly zatím neúspěšné.
Endovaskulární terapie (především trombektomie) zvýšila šanci na rekanalizaci, prodloužila terapeutické okno (8 hod) a umožnila i léčbu pacientů s kontraindikací trombolýzy. Ačkoli lze očekávat postupný nárůst počtu endovaskulárních výkonů, je nutné ověřovat jejich klinický benefit. Po neúspěchu již zmiňované studie IMS3 stále chybí randomizovaná studie prokazující klinický benefit mechanické rekanalizace oproti systémové trombolýze. S úspěšností léčby souvisí i selekce vhodných pacientů. Z rutinní klinické praxe víme, že ne všichni pacienti do 8 hod jsou vhodnými kandidáty endovaskulární léčby.
Individualizace terapeutického okna za pomoci moderních zobrazovacích metod (především MR PWI a DWI) není zatím oficiálně doporučována, i když je na řadě pokrokových pracovišť využívána. Zklamáním byly negativní výsledky randomizované studie DIAS-3 s desmoteplázou podávanou pacientům do 9 hod od vzniku CMP, kteří měli prokázaný MR DWI/PWI mismatch > 20 %. Celý koncept navíc naráží na četná technická úskalí a nejednotnost protokolů zobrazení (týká se především MR a CT perfuze). Teoreticky by však tyto metody mohly pomoci selektovat pacienty vhodné k rekanalizační terapii i po 8. hod, resp. s nejasnou dobou vzniku (typicky po probuzení). Naopak by mohly vyloučit pacienty, kteří sice jsou v časovém okně, ale jejich penumbra je minimální či žádná a veškerá náročná léčba u nich nemá naději na úspěch a navíc zvyšuje riziko krvácení.
0–4,5 hod
- při splnění všeobecně známých kritérií je indikováno co nejrychlejší podání intravenózní tPA v dávce 0,9 mg/kg (10 % bolusově, zbytek v hodinové infuzi, maximální dávka 90 mg)
- nejsou důkazy o vyšší účinnosti endovaskulární léčby oproti IVT, proto do 4,5 hod má IVT vždy přednost a endovaskulární výkon lze primárně provést pouze v případě kontraindikace IVT
- při neúspěchu trombolýzy lze pokračovat endovaskulárně, preferována je mechanická rekanalizace
4,5–6 hod
- mechanická rekanalizace (Penumbra, Solitaire), event. intraarteriální trombolýza
< 8 hod
- mechanická rekanalizace (Penumbra, Solitaire, Trevo)
Update 5. 3. 2013
Po uzávěrce článku byly v průběhu ledna a února online publikovány výsledky 3 významných intervenčních studií.
Studie SYNTHESIS porovnávala účinnost intravenózní trombolýzy proti mechanické rekanalizaci v časovém okně 4,5 hod. Celkem bylo zařazeno 362 pacientů, randomizovaných 1 : 1. Primárního výstupního kritéria (mRS 0–1 za 3 měsíce) bylo dosaženo u 34,8 % pacientů léčených IV trombolýzou a u 30,4 % léčených endovaskulárně. Symptomatické krvácení se vyskytlo shodně u 6 % pacientů [27]. Studie tedy neprokázala, navzdory předpokladům, že by endovaskulární léčba byla účinnější než systémová trombolýza.
Další studie IMS 3 (The interventional management of stroke 3) srovnávala standardní IV trombolýzu proti trombolýze s nižší dávkou a následným endovaskulárním výkonem. Studie byla předčasně ukončena po zařazení 656 pacientů (randomizace 1 : 2), kdy již bylo zřejmé, že kombinovaný postup není lepší než standardní trombolýza. Primárního výstupního kritéria (mRS 0–2) bylo dosaženo u 38,7 % pacientů léčených IVT a u 40,8 % léčených kombinovaným přístupem [28].
Do studie MR rescue (Mechanical retrieval and recanalization of stroke clots using embolectomy) bylo zařazeno 118 pacientů, léčených do 8 hod od vzniku CMP. Pacienti byly rozděleni do 2 skupin dle přítomnosti či absence viabilní tkáně detekované pomocí CT/MR. V obou skupinách pak byli pacienti randomizováni ke standardní medikamentózní léčbě či endovaskulární rekanalizaci (Merci katetr a Penumbra). Endovaskulární léčba nevedla k poklesu invalidity či mortality po 3 měsících ve srovnání s konzervativní terapií, a to dokonce ani ve skupině pacientů s detekovanou viabilní tkání.
Uvedené studie potvrzují výsadní postavení intravenózní trombolýzy v léčbě akutní ischemické CMP i oprávněnost snah o zvýšení její účinnosti (zkrácení doby do podání, augmentace účinku pomocí ultrazvuku apod.).
Zdroje podpory formou grantů, přístrojového vybavení nebo léků: D. Goldemund a R. Mikulík jsou podporováni z Evropského fondu regionálního rozvoje – Projekt FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
Doručeno do redakce 18. 1. 2013
Přijato po recenzi 7. 2. 2013
MUDr. David Goldemund
Mezinárodní centrum klinického výzkumu (ICRC),
1. neurologická klinika LF MU a FN u sv. Anny, Brno
david.goldemund@fnusa.cz
Zdroje
1. Smith WS, Sung G, Starkman S et al. MERCI Trial Investigators. Safety and efficacy of mechanical embolectomy in acute ischemic stroke: results of the MERCI trial. Stroke 2005; 36: 1432–1438.
2. Hacke W, Donnan G, Fieschi C et al. ATLANTIS Trials Investigators; ECASS Trials Investigators; NINDS rt-PA Study Group Investigators. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials. Lancet 2004; 363: 768–774.
3. Derex L, Nighoghossian N, Hermier M et al. Early detection of cerebral arterial occlusion on magnetic resonance angiography: predictive value of the baseline NIHSS score and impact on neurological outcome. Cerebrovasc Dis 2002; 13: 225–229.
4. Wahlgren N, Ahmed N, Eriksson N et al. Safe Implementation of Thrombolysis in Stroke-MOnitoring STudy Investigators. Multivariable analysis of outcome predictors and adjustment of main outcome results to baseline data profile in randomized controlled trials: Safe Implementation of Thrombolysis in Stroke-MOnitoring STudy (SITS-MOST). Stroke 2008; 39: 3316–3322.
5. Kucinski T, Koch C, Eckert B et al. Collateral circulation is an independent radiological predictor of outcome after thrombolysis in acute ischaemic stroke. Neuroradiology 2003; 45: 11–8.
6. Bang OY, Saver JL, Kim SJ et al. Collateral flow predicts response to endovascular therapy for acute ischemic stroke. Stroke 2011; 42: 693–699.
7. Hill MD, Rowley HA, Adler F et al. PROACT-II Investigators. Selection of acute ischemic stroke patients for intra-arterial thrombolysis with pro-urokinase by using ASPECTS. Stroke 2003; 34: 1925–1931.
8. Tissue plasminogen activator for acute ischemic stroke. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. N Engl J Med 1995; 333: 1581–1587.
9. Hacke W, Kaste M, Bluhmki E et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359: 1317–1329.
10. Mikulík R, Dufek M. Trombolytická léčba mozkového infarktu-prospektivní sledování souboru pacientů. Čes Slov Neurol Neurochir 2002; 65/98: 328–333.
11. Mikulik R, Ribo M, Hill MD et al. CLOTBUST Investigators. Accuracy of serial National Institutes of Health Stroke Scale scores to identify artery status in acute ischemic stroke. Circulation 2007; 115: 2660–2665.
12. Barreto AD, Alexandrov AV, Lyden P et al. The argatroban and tissue-type plasminogen activator stroke study: final results of a pilot safety study. Stroke 2012; 43: 770–775.
13. Sugg RM, Pary JK, Uchino K et al. Argatroban tPA stroke study: study design and results in the first treated cohort. Arch Neurol 2006; 63: 1057–1062.
14. Furlan A, Higashida R, Wechsler L et al. Intra--arterial prourokinase for acute ischemic stroke. The PROACT II study: a randomized controlled trial. Prolyse in Acute Cerebral Thromboembolism. JAMA 1999; 282: 2003–2011.
15. Ogawa A, Mori E, Minematsu K et al. MELT Japan Study Group. Randomized trial of intraarterial infusion of urokinase within 6 hours of middle cerebral artery stroke: the middle cerebral artery embolism local fibrinolytic intervention trial (MELT) Japan. Stroke 2007; 38: 2633–2639.
16. Smith WS. Safety of mechanical thrombectomy and intravenous tissue plasminogen activator in acute ischemic stroke. Results of the multi Mechanical Embolus Removal in Cerebral Ischemia (MERCI) trial, part I. AJNR Am J Neuroradiol 2006; 27: 1177–1182.
17. Adams HP Jr, del Zoppo G, Alberts MJ et al. American Heart Association; American Stroke Association Stroke Council; Clinical Cardiology Council; Cardiovascular Radiology and Intervention Council; Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups. Guidelines for the early management of adults with ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups: the American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke 2007; 38: 1655–1711.
18. Dávalos A, Pereira VM, Chapot R et al. Solitaire Group. Retrospective multicenter study of Solitaire FR for revascularization in the treatment of acute ischemic stroke. Stroke 2012; 43: 2699–2705.
19. Saver JL, Jahan R, Levy EI et al. SWIFT Trialists. Solitaire flow restoration device versus the Merci Retriever in patients with acute ischaemic stroke (SWIFT): a randomised, parallel-group, non-inferiority trial. Lancet 2012; 380: 1241–1249.
20. Nogueira RG, Lutsep HL, Gupta R et al. TREVO 2 Trialists. Trevo versus Merci retrievers for thrombectomy revascularisation of large vessel occlusions in acute ischaemic stroke (TREVO 2): a randomised trial. Lancet 2012; 380: 1231–1240.
21. Penumbra Pivotal Stroke Trial Investigators. The penumbra pivotal stroke trial: safety and effectiveness of a new generation of mechanical devices for clot removal in intracranial large vessel occlusive disease. Stroke 2009; 40: 2761–2768.
22. Braaten JV, Goss RA, Francis CW. Ultrasound reversibly disaggregates fibrin fibers. Thromb Haemost 1997; 78: 1063–1068.
23. Alexandrov AV, Molina CA, Grotta JC et al. CLOTBUST Investigators. Ultrasound-enhanced systemic thrombolysis for acute ischemic stroke. N Engl J Med 2004; 351: 2170–2178.
24. Molina CA, Barreto AD, Tsivgoulis G et al. Transcranial ultrasound in clinical sonothrombolysis (TUCSON) trial. Ann Neurol 2009; 66: 28–38.
25. Alexandrov AV, Mikulik R, Ribo M et al. A pilot randomized clinical safety study of sonothrombolysis augmentation with ultrasound-activated perflutren-lipid microspheres for acute ischemic stroke. Stroke 2008; 39: 1464–1469.
26. Mikulik R, Bunt L, Hrdlicka D et al. Calling 911 in response to stroke: a nationwide study assessing definitive individual behavior. Stroke 2008; 39: 1844–1849.
27. Ciccone A, Valvassori L, Nichelatti M et al. SYNTHESIS Expansion Investigators. Endovascular Treatment for Acute Ischemic Stroke. N Engl J Med 2013 [Epub ahead of print].
28. Broderick JP, Palesch YY, Demchuk AM et al. Interventional Management of Stroke (IMS) III Investigators. Endovascular Therapy after Intravenous t-PA versus t-PA Alone for Stroke. N Engl J Med 2013 [Epub ahead of print].
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2013 Číslo 1
Nejčtenější v tomto čísle
- Nejdůležitější metody v diagnostice akutní cévní mozkové příhody
- Terapie akutní ischemické cévní mozkové příhody
- Primární a sekundární prevence ischemických cévních mozkových příhod
- Arytmie a cévní mozková příhoda
