Rivaroxaban – farmakologický profil
Rivaroxaban – pharmacological profile
Rivaroxaban is an oral selective, direct factor Xa inhibitor. It has well predictable pharmacodynamics and pharmacokinetics. Depending on the size of the dose, it inhibits thrombin formation after 24 hours. It does not block the existing thrombin activity and thus enables continued activation of endogenous anticoagulant factors. After oral administration it is well absorbed, its bioavailability varies between 80 and 100%. It is bound to plasma proteins in 92 to 95%, its average distribution volume is 50 litres. The main metabolising systems are cytochromes P450 3A4 and 2J2. It is excreted mainly via the kidneys; about one third of the administered amount being excreted unchanged, primarily by tubular secretion. The remaining two thirds are excreted as inactive metabolites in urine and bile. The median terminal half-life in younger individuals is 5–9 hours, and 11–13 hours in older individuals. Rivaroxaban pharmacokinetics is minimally affected by age or sex of the patient, and does not require dose adjustments in patients with extremely low or high or with mild-to-moderate renal or hepatic insufficiency.
Keywords:
rivaroxaban – anticoagulants – pharmacodynamics – pharmacokinetics
Autoři:
K. Urbánek
Působiště autorů:
Ústav farmakologie, LF UP a FN Olomouc
Vyšlo v časopise:
Kardiol Rev Int Med 2017, 19(1): 39-44
Souhrn
Rivaroxaban je perorálně podávaný selektivní přímý inhibitor faktoru Xa. Vyznačuje se dobře predikovatelnou farmakodynamikou i farmakokinetikou. V závislosti na velikosti podané dávky inhibuje tvorbu trombinu až po dobu 24 hod. Neblokuje existující trombinovou aktivitu, a tím umožňuje i nadále aktivaci endogenních antikoagulačních faktorů. Je po perorálním podání velmi dobře vstřebáván, biologická dostupnost se pohybuje mezi 80 a 100 %. Váže se z 92– 95 % na plazmatické proteiny, distribuční objem je průměrně 50 litrů. Hlavními degradujícími systémy jsou cytochromy P450 3A4 a 2J2. Vylučován je převážně ledvinami, asi 1/ 3 podaného množství se vylučuje nezměněna převážně tubulární sekrecí. Zbylé 2/ 3 se vylučují ve formě inaktivních metabolitů zhruba stejným podílem do moči a do žluče. Střední terminální poločas eliminace při perorálním podání je 5– 9 hod u mladších osob a 11– 13 hod u starších. Jeho farmakokinetika je minimálně ovlivněna věkem či pohlavím léčeného pacienta a ani extrémně nízká nebo vysoká hmotnost nevedou k nutnosti upravovat dávkování, stejně jako mírná až středně závažná renální nebo jaterní insuficience.
Klíčová slova:
rivaroxaban – antikoagulancia – farmakodynamika – farmakokinetika
V uplynulých letech bylo do klinické praxe uvedeno několik nových antikoagulancií, které se podávají perorálně a s vysokou selektivitou blokují aktivitu koagulačních faktorů přímo v plazmě. Celá tato farmakologická skupina byla proto nazvána přímá perorální antikoagulancia (direct oral anticoagulants – DOACs). Přímá perorální antikoagulancia však nejsou farmakologicky jednotnou skupinou. Tento pojem zahrnuje dvě skupiny léčiv s odlišným mechanizmem účinku:
- přímé inhibitory trombinu, jejichž jediným používaným zástupcem je dabigatran,
- přímé inhibitory aktivovaného faktoru X, kterých je již zavedena nebo testována celá řada – u nás jsou zatím registrovány rivaroxaban, apixaban a recentně i edoxaban.
Z farmakologického hlediska se jako perspektivnější jeví skupina přímých inhibitorů faktoru Xa, ve které je rivaroxaban prototypovou účinnou látkou.
Farmakodynamika
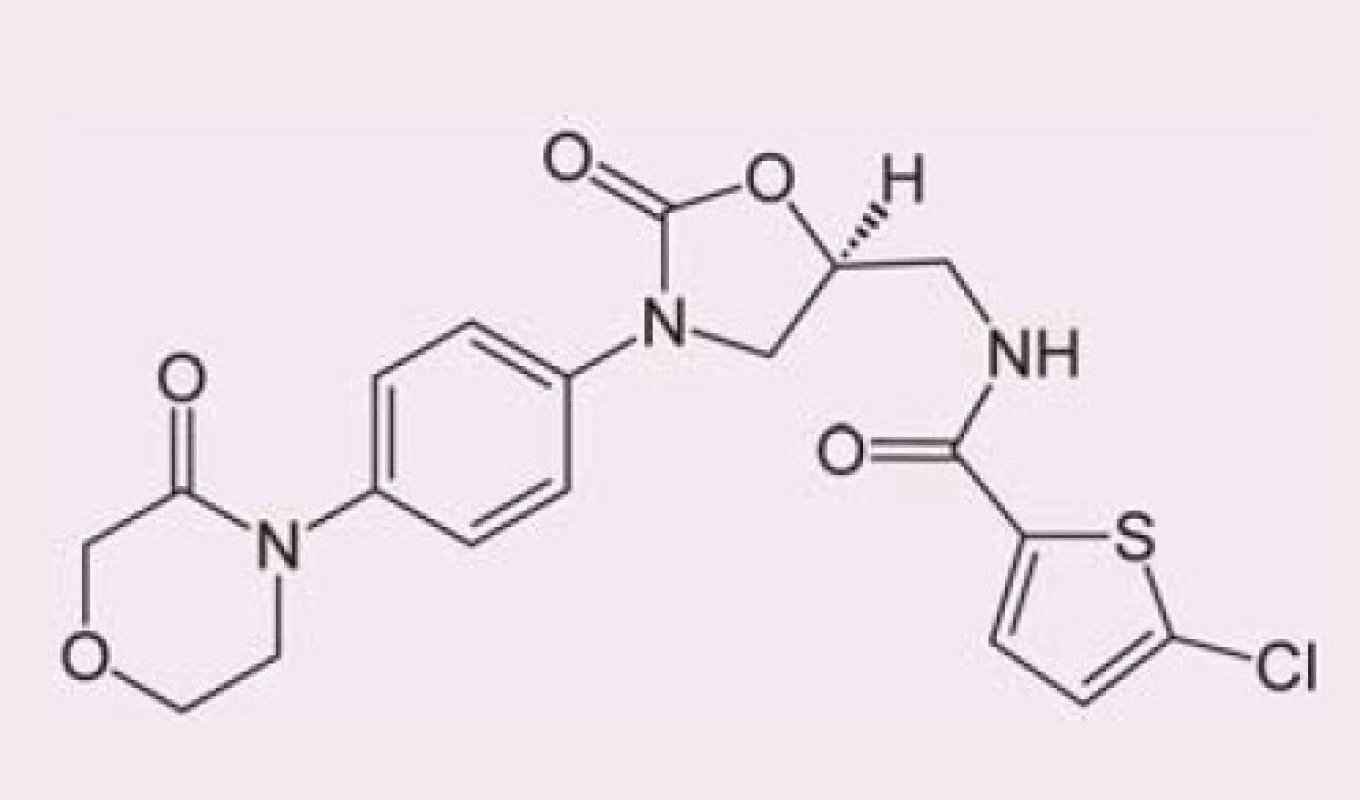
Rivaroxaban je selektivní přímý inhibitor koagulačního faktoru Xa (obr. 1). Váže se na molekulu faktoru Xa prostřednictvím interakce mezi svým oxazolidinonovým centrem a chlorothiofenovou a morfolinovou doménou faktoru Xa (obr. 2). Maximální inhibice aktivity faktoru Xa se pohybuje v rozmezí 22– 68 % a trvá při podání dávky 5 mg přibližně 12 hod. Intenzita inhibiční aktivity se přitom výrazně neliší první den léčby a po dosažení ustáleného stavu. In vitro rivaroxaban neovlivňuje aktivitu trombinu indukovanou ekarinem, což znamená, že přímo neovlivňuje existující trombin. Ve studiích in vitro rovněž neovlivňuje indukovanou agregaci trombocytů [1].
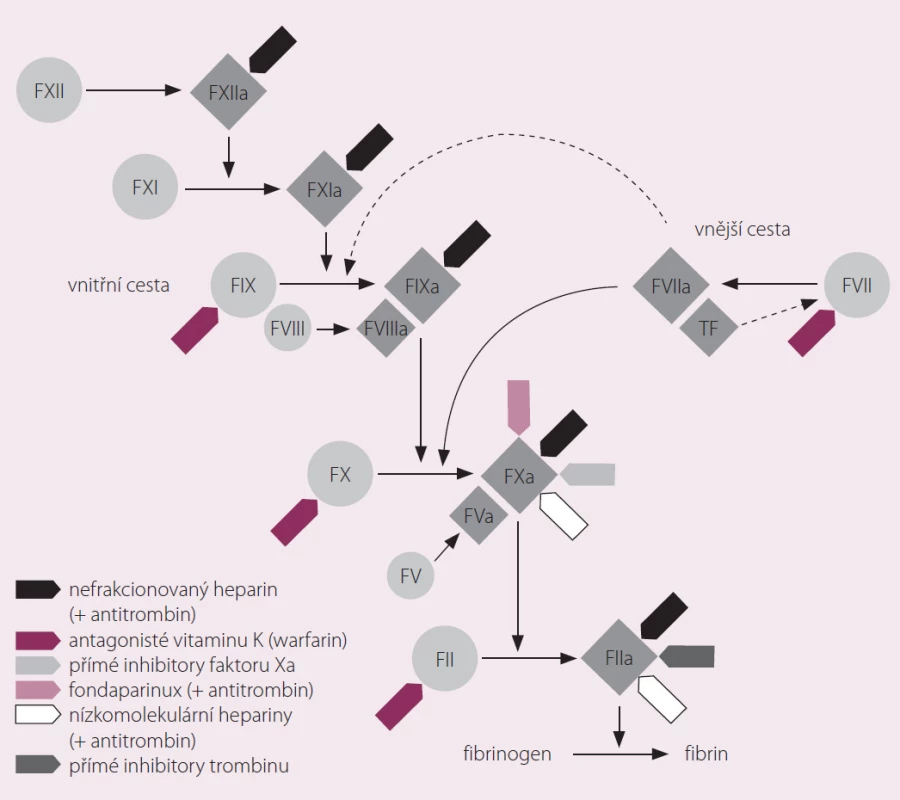
V závislosti na velikosti podané dávky rivaroxaban inhibuje tvorbu trombinu až po dobu 24 hod. Inhibice faktoru Xa brání „explozi“ tvorby trombinu a následné potenciaci generace trombinu mechanizmem pozitivní zpětné vazby. Inhibice funkce jedné molekuly faktoru Xa může předejít vzniku až 1 000 molekul trombinu. Rivaroxaban neblokuje existující trombinovou aktivitu, a tím (na rozdíl od inhibitorů trombinu) umožňuje i nadále aktivaci endogenních antikoagulačních faktorů – proteinů C a S. Tento mechanizmus účinku vede k relativně širokému terapeutickému rozmezí a zároveň k neexistenci rebound fenoménu (syndromu z vysazení). Farmakodynamika je dobře predikovatelná díky přímé závislosti účinku na dávce. Z hlediska účinku nejsou významné rozdíly mezi skupinami pacientů různého pohlaví, mezi věkovými skupinami a ani při rozdílech v hmotnosti. Rivaroxaban ovlivňuje INR i aPTT s maximem 1– 4 hod po podání [1,2], rutinní koagulační testy však nelze použít k hodnocení jeho účinnosti.
Farmakokinetika
Absorpce
Rivaroxaban je po perorálním podání velmi dobře vstřebáván, biologická dostupnost se pohybuje mezi 80 a 100 %. Maximálních plazmatických koncentrací dosahuje 2– 4 hod po podání. Absorpce dávky menší než 15 mg není významně ovlivňována potravou. Ve vyšších dávkách se biologická dostupnost postupně snižuje a absorpce je nepřímo úměrná dávce. Tento efekt se více projevuje nalačno, proto je doporučováno užívat dávky vyšší než 10 mg současně s jídlem. Při podání tablety s obsahem 20 mg účinné látky současně s potravou se zvyšuje AUC průměrně o 39 %. Stropu absorpce je dosaženo při dávce 50 mg. Současné podání ranitidinu, omeprazolu ani antacid s obsahem hydroxidů hliníku a hořčíku neovlivňuje absorpci rivaroxabanu [2,3].
Distribuce
Průměrné maximální plazmatické koncentrace po jednorázovém perorálním podání dávky 10 mg v roztoku zdravým dobrovolníkům dosahovaly 266 μg/ l [4], maximální koncentrace v ustáleném stavu při podávání 10 mg 2× denně byly průměrně 158 μg/ l. Při dávce 20 mg 1× denně při léčbě hluboké žilní trombózy dosahovaly maximální a minimální koncentrace 215 (22– 535) a 32 (6– 239) µg/ l [5]. Čas dosažení Cmax se po perorálním podání pohybuje v rozmezí 2– 4 hod. Látka se váže z 92– 95 % na plazmatické proteiny, především albumin. Distribuční objem v ustáleném stavu je průměrně 50 litrů.
Metabolizmus
V játrech jsou metabolizovány 2/ 3 podané dávky za vzniku neúčinných metabolitů, přičemž hlavními degradujícími systémy jsou cytochromy P450 3A4 a 2J2 (cca 18 a 14 % celkové clearance). Hlavními metabolickými cestami jsou oxidativní degradace morfolinonové části a hydrolýza amidových vazeb. Rivaroxaban je substrátem transportních proteinů – P-glykoproteinů (P-gp) a BCRP (breast cancer resistance protein) [6].
Exkrece
Vylučování se děje převážně ledvinami, asi 1/ 3 podaného množství se vylučuje nezměněna převážně tubulární sekrecí. Zbylé 2/ 3 se vylučují ve formě inaktivních metabolitů zhruba stejným podílem do moči a do žluče. Po intravenózním podání dávky 1 mg je střední terminální poločas eliminace 4,5 hod. Po perorálním podání dávky 20 mg je to 5– 9 hod u mladších osob a 11– 13 hod u starších vzhledem k omezení eliminace absorpcí [2,6]. Při opakovaném podávání nedochází k významnější kumulaci účinné látky v organizmu [5].
Farmakokinetika u zvláštních skupin pacientů
Fyziologické variability
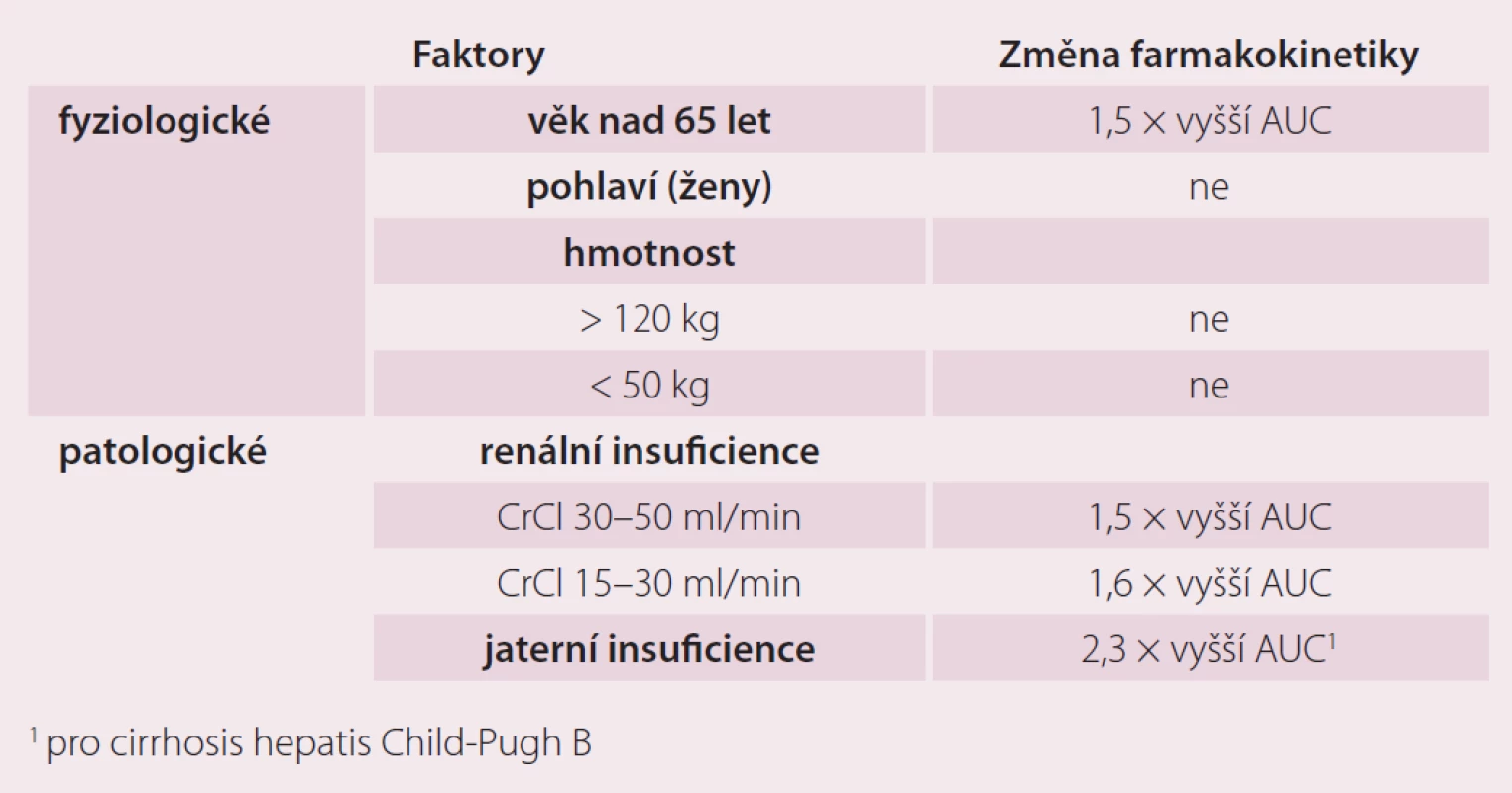
Protože antikoagulancia jsou podávána především starším pacientům, bylo nezbytné zjistit, jaký vliv má věk na farmakokinetiku a účinky nového léku, jakým je rivaroxaban. Současně byly hodnoceny i možné intersexuální rozdíly, protože v mladším věku převažují indikace pro antikoagulaci u mužů, zatímco ve vyšším věku je pravděpodobnější jejich použití u žen. Proto byla provedena placebem kontrolovaná, randomizovaná, jednoduše zaslepená farmakokinetická studie na 34 zdravých dobrovolnících rozdělených do čtyř skupin podle věku a pohlaví (muži a ženy mladší 45 let a muži a ženy starší 75 let). Zatímco pohlaví mělo zanedbatelný vliv na farmakokinetické parametry (Cmax a AUC), věk neměl vliv na dosažené Cmax, ale u osob starších 75 let byla zjištěna 1,41× větší AUC (90% CI 1,20– 1,66). Pravděpodobně to však souvisí s faktem, že ve studiích II. fáze, ze kterých vycházíme, měli starší pacienti vyšší výskyt renální insuficience, častěji šlo o ženy a měli celkově nižší tělesnou hmotnost. Celková i renální clearance korelovaly pozitivně s clearance kreatininu a negativně s věkem [7]. Toto ovlivnění farmakokinetiky však mělo jen nevýznamný farmakodynamický korelát. Renální insuficience tak byla jedinou proměnnou se středně významným vlivem na farmakodynamiku vyjádřenou v hodnotě protrombinového času, ostatní proměnné, jako je věk a pohlaví, se do variability farmakodynamické odpovědi (vyjádřené jako hodnota protrombinového času) nepromítly. V klinických studiích fáze II a III tedy nebyly upravovány dávky na základě věku či pohlaví a ani jejich výsledky neukázaly nutnost takové adjustace dávkování.
Farmakokinetikou rivaroxabanu u osob s extrémní hmotností se zabývala jednoduše zaslepená, randomizovaná a placebem kontrolovaná studie publikovaná v roce 2007 [8]. Zařazeno bylo 48 zdravých dobrovolníků rozdělených do tří skupin podle hmotnosti. Maximální plazmatické koncentrace a plochy pod křivkou rivaroxabanu nebyly změněny u subjektů s hmotností nad 120 kg, ale byly zvýšené o 24 % u osob vážících méně než 50 kg, což vedlo k nevýznamnému (15%) prodloužení protrombinového času. Vliv hmotnosti není považován za klinicky významný a dávkování rivaroxabanu se neupravuje ani u osob extrémně obézních ani u pacientů pod 50 kg tělesné hmotnosti (tab. 1).
Renální insuficience
Vliv renální insuficience na farmakokinetiku, farmakodynamiku a bezpečnost rivaroxabanu byl hodnocen ve studii publikované v roce 2010 [9]. Testovaný lék byl podán v dávce 10 mg jednorázově 32 jedincům s lehkým (50– 79 ml/ min), středně těžkým (30– 49 ml/ min) a těžkým poškozením renálních funkcí (< 30 ml/ min) nebo kontrolním subjektům s clearance kreatininu ≤ 80 ml/ min. Průměrné AUC byly zvýšené 1,44× (90 % CI 1,1– 1,9), 1,52× (90 % CI 1,2– 2,0) a 1,64× (90 % CI 1,2– 2,2) u jednotlivých stupňů renální insuficience ve srovnání s kontrolní skupinou. Ovlivnění farmakokinetiky i farmakodynamiky renální insuficiencí bylo hodnoceno jako mírné a předvídatelné.
Ve studiích III. fáze v ortopedii a léčbě žilního tromboembolizmu nebyla dávka upravována v závislosti na renálních funkcích a v analýze podskupiny pacientů s renální insuficiencí nebyl patrný rozdíl v účinnosti a bezpečnosti ve srovnání s komparátorem. Na podkladě farmakokinetického modelu bylo později pro studii ROCKET AF rozhodnuto o redukci dávky na 15 mg při clearance kreatininu pod 50 ml/ min. Po redukci dávky u této skupiny pacientů jsou farmakokinetické parametry srovnatelné se skupinou pacientů s normální renální funkcí a dávkou 20 mg. Na základě těchto dat i výsledků studií fáze III klinického hodnocení lze považovat podávání rivaroxabanu za bezpečné u pacientů s clearance kreatininu nad 30 ml/ min. Podávání pacientům s renální clearance 15– 30 ml/ min je na podkladě omezených dat povoleno, doporučuje se však opatrnost, zvláště v kombinaci s jinými faktory, které ovlivňují za jiných okolností farmakokinetické parametry pouze nevýznamně, jako je např. velmi nízká tělesná hmotnost nebo interakce se středně silnými inhibitory CYP 3A4, jako je klaritromycin nebo telitromycin. Přitom při dávkách do 15 mg denně není třeba dávkování redukovat, u vyšších dávek je redukce doporučená při clearance pod 50 ml/ min.
Jaterní insuficience
Hepatální clearance je sekundární cestou eliminace rivaroxabanu v rozsahu asi 28 %. Vliv jaterní insuficience na jeho farmakokinetiku a farmakodynamiku byl zjišťován podáním dávky 10 mg per os po 10hod lačnění pacientům s cirhózou stupně A nebo B dle Child-Pughovy klasifikace (n = 8 pro každou skupinu, 16 zdravých kontrol). Mírná jaterní insuficience neměla žádný vliv na farmakokinetické parametry ani na farmakodynamiku, u stupně B byla zjištěna mírně snížená celková clearance s nevýznamným zvětšením AUC a zvýšením Cmax [10]. Rivaroxaban lze tedy podávat u lehké hepatopatie, za kontraindikovaný se považuje u středně těžkých a těžkých jaterních insuficiencí spojených s koagulopatií.
Dávkování
Nevalvulární fibrilace síní
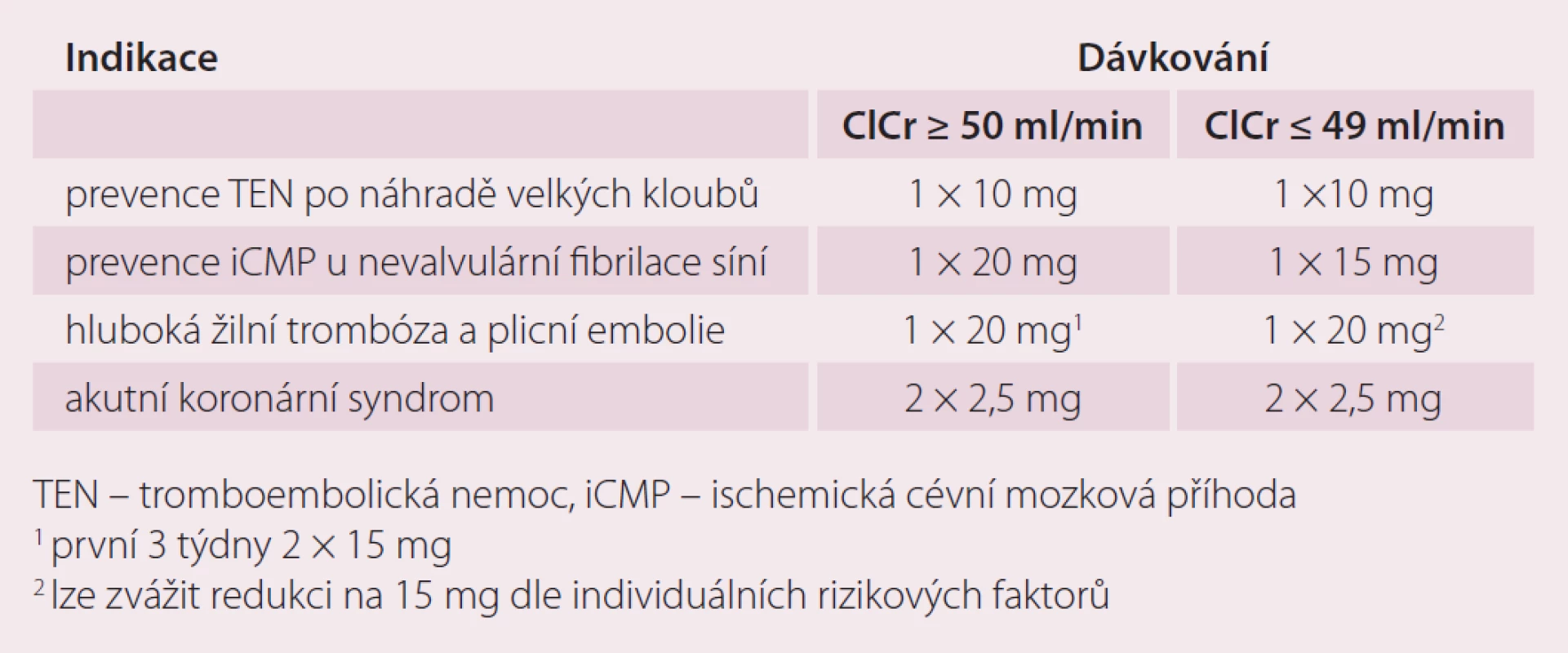
Doporučená dávka pro prevenci cévní mozkové příhody (CMP) a systémové embolizace u pacientů s nevalvulární fibrilací síní je 20 mg 1× denně. Předpokládá se trvalé podávání, pokud přínos prevence CMP a systémové embolizace převáží riziko krvácení. Dávkování u pacientů se středně závažnou (clearance kreatininu 30– 49 ml/ min) nebo závažnou (clearance kreatininu 15– 29 ml/ min) renální insuficiencí je 15 mg 1× denně (tab. 2).
Akutní koronární syndrom
K prevenci trombotických příhod u dospělých pacientů po akutním koronárním syndromu se zvýšenými hladinami srdečních biomarkerů je doporučená dávka 2,5 mg 2× denně v kombinaci 75– 100 mg aspirinu, případně i s denní dávkou 75 mg klopidogrelu nebo se standardní denní dávkou tiklopidinu. Léčbu je doporučeno zahájit co nejdříve po stabilizaci akutního koronárního syndromu (vč. revaskularizačních zákroků), ale nejdříve za 24 hod po přijetí do nemocnice a v době, kdy by normálně byla ukončena parenterální antikoagulační léčba. Rozhodnutí o prodloužení léčby nad 12 měsíců by mělo být provedeno individuálně, protože zkušenosti s léčbou trvající déle než 24 měsíců jsou omezené (tab. 2).
Prevence tromboembolické nemoci po elektivních ortopedických výkonech
Doporučená dávka pro ortopedické indikace je 10 mg 1× denně per os. První dávka se podává 6– 10 hod po operaci a dále se pokračuje co 24 hod po dobu 2 týdnů u náhrady kolenního kloubu a 5 týdnů po náhradě kloubu kyčelního. Toto dávkování je shodné pro všechny pacienty nezávisle na věku, hmotnosti či pohlaví. U renálních poruch je možno rivaroxaban použít u pacientů s renální clearance nad 15 ml/ min bez nutnosti úpravy dávky, u závažnějších poruch se jeho podávání nedoporučuje. Možné je jeho podání i u osob se středně závažnou jaterní insuficiencí až do stupně B dle Child-Pughovy klasifikace, pokud není spojena s koagulopatií (tab. 2).
Hluboká žilní trombóza a plicní embolie
V léčbě hluboké žilní trombózy (HŽT), prevenci recidivující HŽT a plicní embolie je doporučená úvodní dávka 15 mg 2× denně po dobu prvních 3 týdnů a dále 20 mg 1× denně jako udržovací léčba. Celková délka léčby je určena stejným způsobem jako u léčby jinou antikoagulační léčbou v této indikaci. Pacienti se středně závažnou nebo závažnou renální insuficiencí by měli být léčeni dávkou 15 mg 2× denně po dobu prvních 3 týdnů. Potom je doporučeno zvážit použití redukované dávky 15 mg 1× denně. V interních indikacích se nedoporučuje podávání u pacientů s clearance kreatininu menší než 15 ml/ min (tab. 2).
Účinnost podávání v jedné denní dávce
Často diskutovanou otázkou je zejména bezpečnost, ale i účinnost přípravku při podávání 1× denně. Režim dávkování byl testován ve studiích II. fáze při léčbě HŽT. Studie ODIXa-DVT [11] a EINSTEIN DVT [12] byly randomizované, dvojitě zaslepené studie II. fáze, které hodnotily bezpečnost a účinnost různých dávek a režimů rivaroxabanu u akutní hluboké žilní trombózy. Celkem bylo do obou studií zařazeno 1 156 pacientů. Ve studiích ODIXa-DVT pacienti dostávali 10, 20 nebo 30 mg 2× denně a 40 mg 1× denně. Ve studii EINSTEIN DVT byly testovány dávky 20, 30 nebo 40 mg 1× denně ve srovnání se standardní léčbou. Trvání studie bylo 12 týdnů.
AUC rivaroxabanu narůstalo v závislosti na dávce a při stejné denní dávce se nelišilo mezi podáváním 1× denně a 2× denně. Při porovnání obou dávkovacích režimů bylo Cmax při dávkování 1× denně pouze o ~20 % vyšší, což není považováno za klinicky významné. Právě významné zvýšení Cmax, které se v tomto případě nepotvrdilo, by mohlo být varovným signálem horší bezpečnosti. Minimální koncentrace byla asi o ~60 % nižší při dávkování 1× denně. Nicméně i přesto se 5.– 95. percentil hodnot při dávkování 1× nebo 2× denně z větší části překrýval [13]. Tato data naznačují, že dávkování 1× denně neznamená pro pacienty větší riziko při porovnání s dávkováním 2× denně. Ve studiích II. fáze se neprokázal významný rozdíl mezi velikostí trombu. Rozhodující jsou ovšem důkazy účinnosti a bezpečnosti, které máme k dispozici z rozsáhlých studií III. fáze. Naopak bylo opakovaně prokázáno, že adherence pacientů k léčbě se významně zvyšuje při menším počtu denních dávek [14].
Zvláštní situace
Často diskutovanou je otázka účinnosti perorálních antikoagulancií při výskytu pooperačního zvracení. Z průběhu plazmatických koncentrací ve farmakokinetických studiích [4,5] usuzujeme, že dojde-li ke zvracení později než za 2 hod po podání, není třeba dávkování upravovat. Při zvracení mezi 1. a 2. hod po podání by bylo vhodné podat následující dávku dříve (cca po 12 hod) a pouze při zvracení během 1. hodiny po podání je třeba dle stavu pacienta dávku opakovat nebo zvolit parenterální tromboprofylaxi. Ověřená data k tomuto problému však zatím nebyla publikována.
Postup při vynechání dávky závisí na tom, v jakém dávkovacím režimu je rivaroxaban užíván. Pokud je rivaroxaban užíván jednou denně, měl by pacient užít další tabletu co nejdříve a pokračovat s užíváním 1× denně následující den podle doporučení. Dávka by neměla být ve stejný den pro nahrazení vynechané dávky zdvojnásobena. Pokud dojde k vynechání dávky během té fáze léčby, kdy je přípravek podáván ve 2 denních dávkách, měl by pacient užít další tabletu co nejdříve a měl by pokračovat obvyklým dávkováním následující den.
Doporučený postup pro případ nutného chirurgického výkonu je velmi jednoduchý. Rivaroxaban se vysazuje před výkony s nízkým rizikem 24 hod a u výkonů s vysokým rizikem 48 hod před operací bez ohledu na renální funkce pacienta.
Lékové interakce
S rostoucím počtem užívaných léků roste i pravděpodobnost interagujících kombinací. Podle studie zohledňující polyfarmacii při antikoagulační léčbě fibrilace síní užívaly přibližně 2/ 3 pacientů ve studii ROCKET AF kombinaci více než pět léků a 13 % užívalo dokonce více než 10 léků. Ukázalo se, že u těchto pacientů sice není zvýšené riziko selhání léčby – riziko mrtvice a embolizmu mimo CNS (HR 1,02 pro ≥10 léků vs. 0– 4 léky), ale je významně zvýšené riziko krvácení (HR 1,47) i riziko smrti z jakékoli příčiny (HR 1,4). Nebyl významný rozdíl v účinnosti ani bezpečnosti mezi rivaroxabanem a warfarinem kromě skupiny pacientů léčených méně než pěti léky, ve které bylo signifikantně méně velkých krvácení u pacientů léčených rivaroxabanem. Tento vliv na bezpečnost ale nelze přičítat pouze polyfarmacii. Je potřeba vzít v úvahu, že kromě farmakokinetických či farmakodynamických interakcí se u pacientů užívajících více léků velmi pravděpodobně uplatňuje také vyšší věk, větší počet komorbidit a možná i horší compliance [15].
Současné užívání rivaroxabanu s jinými antikoagulancii se nedoporučuje pro zvýšené riziko krvácení. Podobně je třeba opatrnosti při současném užívání léků inhibujících agregaci trombocytů [16]. Farmakodynamické interakce existují i s dalšími léky, které obecně zvyšují riziko krvácení při antikoagulační léčbě. Jsou to především nesteroidní antiflogistika, která kromě vlivu na trombocyty poškozují i sliznici GIT, a také paracetamol, který při dlouhodobém podávání dávek vyšších než 2 g denně inhibuje tvorbu krevních koagulačních faktorů.
Léky ovlivňující aciditu žaludku jako omeprazol, ranitidin nebo antacida významně nemění absorpci rivaroxabanu [17,18]. Signifikantní farmakokinetické interakce byly popsány pouze u látek, které současně silně inhibují nebo indukují CYP3A4 a P-gp.
Nedoporučuje se proto užívat rivaroxaban současně se systémovými azolovými antimykotiky (ketokonazolem, itrakonazolem, vorikonazolem a posakonazolem) a inhibitory HIV proteáz, jako je ritonavir. Flukonazol, který je středně silný inhibitor obou systémů, však s rivaroxabanem významně neinteraguje. Klinicky nevýznamné jsou i interakce s makrolidovými antibiotiky erytromycinem a klaritromycinem [19]. Obezřetnost je však třeba věnovat pacientům, u kterých se tato samostatně nevýznamná rizika sčítají. Například ve studii srovnávající hladiny rivaroxabanu při současném podávání erytromycinu u pacientů se středně těžkou renální insuficiencí došlo ke dvojnásobnému zvýšení AUC a 1,64násobnému zvýšení Cmax rivaroxabanu [20]. Popsána je i interakce s cyklosporinem, který by se proto raději neměl současně podávat. Interakce druhého kalcineurinového inhibitoru, takrolimu, naopak zřejmě významné nejsou [21].
Co se týče induktorů obou eliminačních systémů, jako nejvýznamnější se jeví rifampicin, jehož současné podávání s rivaroxabanem nelze doporučit. Podobně se mohou chovat i některá antiepileptika (karbamazepin, fenytoin) a třezalka tečkovaná, avšak důkazů o významu těchto potenciálních interakcí zatím není dostatek.
Monitorování účinku
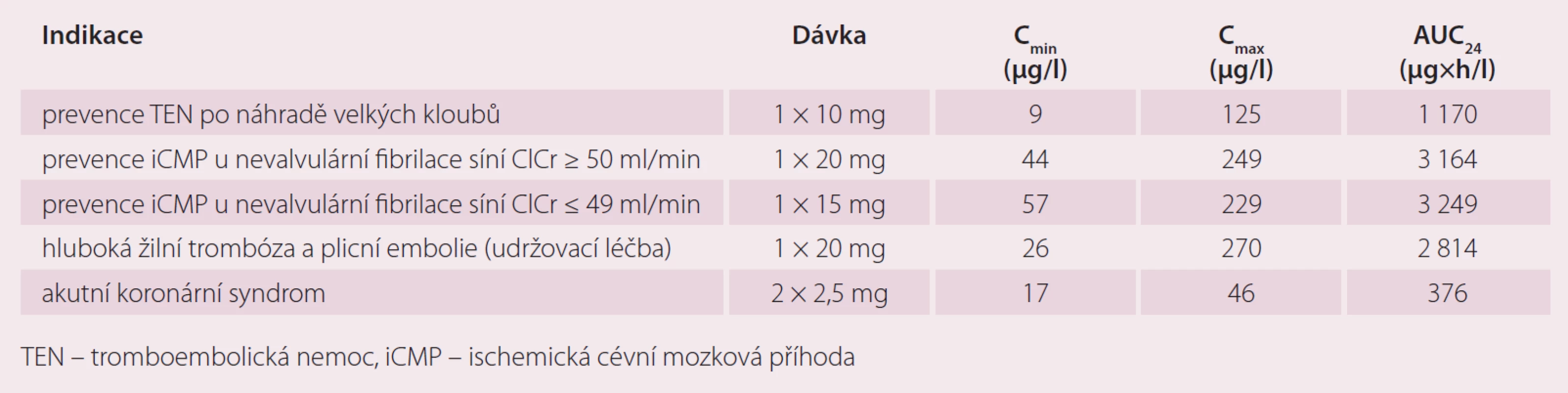
Monitorování hladin ani farmakodynamického efektu při léčbě rivaroxabanem není standardně vyžadováno. Pro výjimečné situace (předávkování, aktivní krvácení nebo neodkladné chirurgické výkony) je možné použít kalibrovaný test anti-Xa aktivity a kvalitativní odhad poskytne i protrombinový čas. Jiné koagulační testy se pro hodnocení účinku nedoporučují [16]. Průměrné plazmatické koncentrace naměřené u jednotlivých indikací jsou uvedeny v tab. 3.
Nežádoucí účinky
K častým nežádoucím účinkům (s frekvencí výskytu více než 1/ 100) patří bolesti hlavy, závratě, tachykardie, hypotenze, zvýšená hladina transamináz a pruritus. Další časté nežádoucí účinky, stejně jako u všech antikoagulancií, jsou nejrůznější krvácivé komplikace. I relativně malá slizniční krvácení jako epistaxe či hematurie mohou postupně vyústit v anémii stejně jako velká krvácení.
Ve zveřejněných výsledcích studie Xantus s 6 784 pacienty užívajícími rivaroxaban se velká krvácení vyskytla u 1,9 % pacientů, přičemž v 0,8 % případech se jednalo o krvácení do gastrointestinálního traktu a 0,4 % pacientů prodělalo intrakraniální krvácení. Pro 0,2 % pacientů bylo krvácení fatální. Nezávažná krvácení byla pozorována u 12,9 % pacientů [22]. Tyto výsledky se četností příliš neliší od výsledků původní registrační studie ROCKET AF, ve které mezi 1 475 pacienty léčenými rivaroxabanem byla celková incidence velkého i malého krvácení 14,9 %, fatální krvácení se vyskytlo u 0,4 % pacientů, tedy významně méně než u warfarinu (HR 0,5). Významně méně bylo po rivaroxabanu i intrakraniálních krvácení (HR 0,67) [23].
V registračních studiích byly pozorovány i případy poškození jater [24]. Riziko hepatotoxicity bylo také popsáno několika sériemi kazuistik a hlášených případů. Většinou se vyskytly u pacientů bezprostředně po celkové anestezii při ortopedických výkonech a nejčastěji se jednalo o nezávažná zvýšení hodnot jaterních testů, která odezněla po vysazení léku [25].
Závěr
Rivaroxaban se vyznačuje stabilní a predikovatelnou farmakokinetikou. Saturovatelná absorpce zajišťuje malé riziko předávkování, duální eliminace velmi malé riziko kumulace při ledvinových či jaterních onemocněních. Jeho farmakokinetika je minimálně ovlivněna věkem či pohlavím léčeného pacienta a ani extrémně nízká nebo vysoká hmotnost nevedou k nutnosti upravovat dávkování. Jediným případem, kdy je třeba redukce dávek, je středně závažná až závažná renální insuficience při dávkách nad 15 mg denně. Také riziko farmakokinetických lékových interakcí je velmi malé, závažná interakce s kontraindikací podání rivaroxabanu nastává pouze v případě, že je současně podané léčivo silným inhibitorem CYP3A4 a PGP, což jsou systémová antimykotika a inhibitory HIV proteáz, slabší inhibitory takový vliv na farmakologické vlastnosti rivaroxabanu nemají. Tyto vlastnosti jsou pro perorální antikoagulancia velmi výhodné a umožňují jeho rozšíření do běžné klinické praxe pro široké spektrum pacientů.
Doručeno do redakce: 6. 2. 2017
Přijato po recenzi: 15. 2. 2017
doc. MU Dr. Karel Urbánek, Ph.D.
www.fnol.cz
urbanek@fnol.cz
Zdroje
1. Piccini JP, Patel MR, Mahaffey KW et al. Rivaroxaban, an oral direct factor Xa inhibitor. Expert Opin Investig Drugs 2008; 17(6): 925– 937. doi: 10.1517/ 13543784.17.6.925.
2. Perzborn E, Roehrig S, Straub A et al. Rivaroxaban: a new oral factor Xa inhibitor. Arterioscler Thromb Vasc Biol 2010; 30(3): 376– 381. doi: 10.1161/ ATVBAHA.110.202978.
3. Gulseth MP, Michaud J, Nutescu EA. Rivaroxaban: an oral direct inhibitor of factor Xa. Am J Health Syst Pharm 2008; 65(16): 1520– 1529. doi: 10.2146/ ajhp070624.
4. Kubitza D, Becka M, Voith B et al. Safety, pharmacodynamics, and pharmacokinetics of single doses of BAY 59-7939, an oral, direct factor Xa inhibitor. Clin Pharmacol Ther 2005; 78(4): 412– 421. doi: 10.1016/ j.clpt.2005.06.011.
5. Kubitza D, Becka M, Wensing G et al. Safety, pharmacodynamics, and pharmacokinetics of BAY 59-7939 – an oral, direct Factor Xa inhibitor-after multiple dosing in healthy male subjects. Eur J Clin Pharmacol 2005; 61(12): 873– 880. doi: 10.1007/ s00228-005-0043-5.
6. Weinz C, Schwarz T, Kubitza D et al. Metabolism and excretion of rivaroxaban, an oral, direct Factor Xa inhibitor, in rats, dogs and humans. Drug Metab Dispos 2009; 37(5): 1056– 1064. doi: 10.1124/ dmd.108.025569.
7. Mueck W, Stampfuss J, Kubitza D et al. Clinical pharmacokinetic and pharmacodynamic profile of rivaroxaban. Clin Pharmacokinet 2014; 53(1): 1– 16. doi: 10.1007/ s40262-013-0100-7.
8. Kubitza D, Becka M, Zuehlsdorf M et al. Body weight has limited influence on the safety, tolerability, pharmacokinetics, or pharmacodynamics of rivaroxaban (BAY 59-7939) in healthy subjects. J Clin Pharmacol 2007; 47(2): 218– 226. doi: 10.1177/ 0091270006296058.
9. Kubitza D, Becka M, Mueck W et al. Effects of renal impairment on the pharmacokinetics, pharmacodynamics and safety of rivaroxaban, an oral, direct Factor Xa inhibitor. Br J Clin Pharmacol 2010; 70(5): 703– 712. doi: 10.1111/ j.1365-2125.2010.03753.x.
10. Kubitza D, Roth A, Becka M et al. Effect of hepatic impairment on the pharmacokinetics and pharmacodynamics of a single dose of rivaroxaban, an oral, direct Factor Xa inhibitor. Br J Clin Pharmacol 2013; 76(1): 89– 98. doi: 10.1111/ bcp.12054.
11. Agnelli G, Gallus A, Goldhaber SZ et al. Treatment of proximal deep-vein thrombosis with the oral direct Factor Xa inhibitor rivaroxaban (BAY 59-7939): the ODIXa-DVT (Oral Direct Factor Xa Inhibitor BAY 59-7939 in patients with acute symptomatic deep-vein thrombosis) study. Circulation 2007; 116(2): 180– 187. doi: 10.1161/ circulationaha.106.668020.
12. Buller HR, Lensing AW, Prins MH et al. A dose--ranging study evaluating once-daily oral administration of the Factor Xa inhibitor rivaroxaban in the treatment of patients with acute symptomatic deep vein thrombosis: the EINSTEIN-DVT dose--ranging study. Blood 2008; 112(6): 2242– 2247. doi: 10.1182/ blood-2008-05-160143.
13. Mueck W, Lensing AW, Agnelli G et al. Rivaroxaban population pharmacokinetic analyses in patients treated for acute deep-vein thrombosis and exposure simulations in patients with atrial fibrillation treated for stroke prevention. Clin Pharmacokinet 2011; 50(10): 675– 686. doi: 10.2165/ 11595320-000000000-00000.
14. Coleman CI, Roberts MS, Sobieraj DM et al. Effect of dosing frequency on chronic cardiovascular disease medication adherence. Curr Med Res Opin 2012; 28: 1– 12. doi: 10.1185/ 03007995.2012.677419.
15. Piccini JP, Hellkamp AS, Washam JB et al. Polypharmacy and the efficacy and safety of rivaroxaban versus warfarin in the prevention of stroke in patients with nonvalvular atrial fibrillation. Circulation 2016; 133(4): 352– 360. doi: 10.1161/ CIRCULATIONAHA.115.018544.
16. SPC Xarelto®. Dostupné z: http:/ / www.sukl.cz/ modules/ medication/ detail.php?kod=0500717.
17. Kubitza D, Becka M, Zuehlsdorf M et al. Effect of food, an antacid, and the H2 antagonist ranitidine on the absorption of BAY 59-7939 (rivaroxaban), an oral, direct factor Xa inhibitor, in healthy subjects. J Clin Pharmacol 2006; 46(5): 549– 558. doi: 10.1177/ 0091270006286904.
18. Moore KT, Plotnikov AN, Thyssen A et al. Effect of multiple doses of omeprazole on the pharmacokinetics, pharmacodynamics, and safety of a single dose of rivaroxaban. J Cardiovasc Pharmacol 2011; 58(6): 581– 588. doi: 10.1097/ FJC.0b013e31822f6c2b.
19. Mueck W, Kubitza D, Becka M. Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in heatlhy subjects. Br J Clin Pharmacol 2013; 79(3): 455– 466. doi: 10.1111/ bcp.12075.
20. Moore KT, Vaidyanathan S, Natarajan J et al. An open-label study to estimate the effect of steady-state erythromycin on the pharmacokinetics, pharmacodynamics, and safety of a single dose of rivaroxaban in subjects with renal impairment and normal renal function. J Clin Pharmacol 2014; 54(12): 1407– 1420. doi: 10.1002/ jcph.352.
21. Wannhoff A, Weiss KH, Stremmel W et al. Increased levels of rivaroxaban in patients after liver transplantation treated with cyclosporine A. Transplantation 2014; 98(2): e12– e13. doi: 10.1097/ TP.0000000000000223.
22. Camm AJ, Amarenco P, Haas S et al. XANTUS: a real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation Eur Heart J 2016; 37(14): 1145– 1153. doi: 10.1093/ eurheartj/ ehv466.
23. Patel MR, Mahaffey KW, Garg J et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. ROCKET AF Investigators. N Engl J Med 2011; 365(10): 883– 891. doi: 10.1056/ NEJMoa1009638.
24. Watkins PB, Desai M, Berkowitz SD et al. Evaluation of drug induced serious hepatotoxicity (eDISH): application of this data organization approach to phase III clinical trials of rivaroxaban after total hip or knee replacement surgery. Drug Saf 2011; 34(3): 243– 252. doi: 10.2165/ 11586600-000000000-00000.
25. Lambert A, Cordeanu M, Gaertner S et al. Rivaroxaban-induced liver injury: Results from a venous thromboembolism registry. Int J Cardiol 2015; 191: 265– 266. doi: 10.1016/ j.ijcard.2015.04.2.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2017 Číslo 1
Nejčtenější v tomto čísle
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Rivaroxaban – farmakologický profil
- Pozdní následky kardiotoxicity
