Kardiorenální syndrom u pacientů s akutním srdečním selháním
Cardiorenal syndrome in patients with acute heart failure
Deterioration of renal function occurs in about 30% of patients hospitalized for acute heart failure and it is associated with worse short and long-term prognosis. Precautionary measures are limited. It is necessary to reduce the application of nephrotoxic agents to a minimum. In the case of resistance to loop diuretics use of their combination with thiazide diuretics or aldosterone antagonists, or continuous infusion of furosemide at hyponatraemia with hypertonic saline is possible. Renoprotective effect of low-dose dopamine has not been demonstrated, but may lead to an increase of diuresis. In the case of renal failure early initiation of renal support (intermittent or continuous) is indicated.
Keywords:
cardiorenal syndrome – acute heart failure – renal failure
Autoři:
K. Helánová; J. Špinar; J. Jarkovský
; M. Felšöci; R. Miklík; J. Pařenica
Vyšlo v časopise:
Kardiol Rev Int Med 2012, 14(4): 240-245
Kategorie:
Kardiorenální syndrom
Souhrn
Zhoršení funkce ledvin se vyskytuje asi u 30 % pacientů hospitalizovaných pro akutní srdeční selhání a je spojeno s horší krátkodobou i dlouhodobou prognózou. Preventivní opatření jsou omezená, především je nutné snížit na minimum aplikaci nefrotoxických látek. V případě rezistence na kličková diuretika je možné využít kombinaci s thiazidovými diuretiky nebo antagonisty aldosteronu. Dále je možné využít kontinuální infuzi furosemidu, při hyponatremii podanou společně s hypertonickým roztokem chloridu sodného. Renoprotektivní efekt nízkých dávek dopaminu nebyl prokázán, nicméně může vést ke zvýšení diurézy. V případě selhání ledvin je indikováno spíše včasné zahájení podpory funkce ledvin intermitentními nebo kontinuálními hemoeliminačními metodami.
Klíčová slova:
kardiorenální syndrom – akutní srdeční selhání – selhání ledvin
Úvod
Hospitalizační mortalita pacientů s akutním srdečním selháním (ASS) se pohybuje v různých registrech v závislosti na spektru sledovaných pacientů od 4 % do 12,7 % (ALARM-HF [1], FINN-AKVA [2], EHFS I, II [3,4], ADHERE [5], AHEAD [6]). Podle českého registru AHEAD je jednoleté přežívání 65,8 % a tříleté 53 % [7]. Zhoršení renálních funkcí se vyskytuje přibližně u 30 % pacientů hospitalizovaných pro ASS a je častější u pacientů s již preexistující renální dysfunkcí. Akutní zhoršení funkce ledvin je spojeno s vyšší hospitalizační a dlouhodobou mortalitou [8–11]. Zhoršení renálních funkcí, většinou hodnocené zvýšením sérové hladiny kreatininu, může být přechodné, nicméně asi u dvou třetin pacientů dochází ke zhoršení trvalému a to je především spojeno s horší prognózou [12]. Podle výsledků registru ADHERE mělo dokonce 64 % pacientů hospitalizovaných pro akutní dekompenzaci srdečního selhání vstupní glomerulární filtraci nižší než 60 ml/min/1,73 m2 [13].
V roce 2010 byl na základě konsenzu expertů schematicky rozdělen vztah mezi srdeční a renální funkcí na 5 základních subtypů tzv. kardiorenálního syndromu. Akutní zhoršení funkce ledvin (acute kidney injury – AKI) v důsledku akutního poškození funkce srdce je charakterizováno kardiorenálním syndromem 1. typu (KRS). Je nutné poznamenat, že akutní KRS 1. typu často navazuje na preexistující poškození ledvin, které může vzniknout v důsledku chronického KRS 2. typu nebo chronického reno-kardiálního syndromu 4. typu. Po propuštění pacientů z hospitalizace se opět uplatňuje chronický KRS 2. typu [14].
Cílem tohoto článku je poukázat na možnosti časné diagnostiky, na prevenci rozvoje a možnosti léčby KRS 1. typu. Prevence rozvoje renální dysfunkce by mohla být jedním z důležitých faktorů zlepšení dlouhodobé prognózy pacientů hospitalizovaných pro ASS [15]. K rozvoji KRS 1. typu může dojít napříč všemi syndromy a etiologiemi akutního srdečního selhání, v rámci akutního koronárního syndromu nebo během kardiochirurgické operace. Chronické poškození ledvin je definováno podle klasifikace CKD [16], akutní poškození ledvin je klasifikováno podle AKIN kritérií [17,18].
Patofyziologie
Vzájemné působení mezi srdcem a ledvinami je oboustranné a je zprostředkováno sympatickým nervovým systémem (SNS), renin-angiotensin-aldosteronovým systémem (RAAS), hormonálně prostřednictvím antidiuretického hormonu (ADH), působením natriuretických peptidů a prostřednictvím imunitního systému. V rámci ASS může dojít k poškození ledvin v důsledku sníženého srdečního výdeje a hypoperfuze ledvin při nízkém středním arteriálním tlaku. Aktivace systému RAAS a SNS vede zejména vazokonstrikcí vas afferens ke snížení glomerulární filtrace, zároveň dochází k retenci sodíku a vody. Zvýšená retence sodíku a vody zvyšuje centrální žilní tlak a žilní kongesci, která se rovněž podílí na zhoršení glomerulární filtrace. Působením angiotensinu II je aktivována NADPH-oxidáza, která vede ke zvýšené produkci reaktivních forem kyslíku (reactive oxygen species – ROS). Tento zvýšený oxidační stres poškozuje srdce a ledviny. Vaskulární faktory, jako je oxid dusnatý (NO), prostaglandiny, natriuretické peptidy a endothelin rovněž modulují perfuzi ledvin nezávisle na centrální hemodynamice. Arginin vazopresin (antidiuretický hormon) má nepříznivý vliv na progresi KRS, potencuje retenci tekutin a účinek angiotensinu II a noradrenalinu. K poškození ledvin může dojít zátěží kontrastní látkou (kontrastem indukovaná nefropatie) nebo u pacientů, kteří podstupují kardiochirurgickou operaci v mimotělním oběhu. Na poškození ledvin se může podílet působení nefrotoxicky působících látek, jako jsou např. některá nefrotoxicky působící antibiotika (např. gentamicin). U části pacientů v kardiogenním šoku dojde k rozvoji septického stavu nebo systémové zánětlivé reakce (SIRS), které se rovněž mohou podílet na rozvoji renální dysfunkce. Zde se pak KRS 1. typu překrývá se sekundárním KRS 5. typu, kdy systémové onemocnění, v tomto případě sepse, vede k poškození funkce jak srdce, tak ledvin. Veškeré uvedené mechanizmy se v závislosti na etiologii srdečního poškození různou měrou podílejí na obousměrném ovlivnění funkce srdce a ledvin [19].
Diagnostika KRS a využití biomarkerů
Důležité je si uvědomit, že ačkoli existuje konsenzus o rozdělení kardiorenálního syndromu do 5 subtypů, jeho diagnostika není jednoznačně definována. Pro KRS 1. typu je založena na vzestupu sérové hladiny kreatininu během hospitalizace. Pro akutní postižení ledvin je využívána klasifikace AKIN (Acute Kidney Injury Network), kdy stadium AKIN 1 je definováno jako vzestup sérové hladiny kreatininu o 26 μmol/l nebo vzestup o 50 %–99 % oproti stabilní hodnotě kreatininu před rozvojem akutní ataky srdečního selhání nebo oligourie < 0,5 ml/kg/hod po dobu > 6 hod (tab. 1). Pokud není známá dlouhodobá referenční hodnota kreatininu během posledních 3 měsíců, využívá se v literatuře první hodnota kreatininu při přijetí nebo hladina po stabilizaci stavu [18]. Některé práce definovaly KRS 1. typu na základě vzestupu kreatininu o 25 % oproti hodnotě při přijetí nebo na základě poklesu odhadované glomerulární filtrace. Odhad glomerulární filtrace lze provést pomocí Cockcroft-Gaultovy rovnice nebo MDRD rovnice (Modification of Diet in Renal Disease equation) [19]. Ke zhodnocení poklesu glomerulární filtrace je možné využít Cystatin C, který v akutní fázi lépe odpovídá GFR než odhad glomerulární filtrace na základě MDRD rovnice či Cockroft-Gaultovy rovnice. NGAL (neutrophil gelatinase-associated lipocalin) je protein akutní fáze, který je volně filtrovatelný přes glomerulární membránu a v proximálním tubulu ledvin je reabsorbován endocytózou. NGAL detekovaný v moči je produkován zejména v distálním nefronu. Je dalším biomarkerem, který by teoreticky mohl sloužit k časnější detekci poškození ledvin. V letošním roce však byla publikována práce, která ve skupině pacientů přijatých pro ASS neprokázala, že by NGAL byl časnějším a lepším prediktorem rozvoje AKI ve srovnání s kreatininem [20]. Dalšími biomarkery, které by mohly v budoucnu sloužit k časné predikci rozvoje poškození ledvin, jsou: KIM-1 (kidney injury molecule-1), protein, který je detekovatelný v moči časně po ischemickém nebo nefrotoxickém inzultu buněk proximálního tubulu; Interleukin-18 – prozánětlivý cytokin detekovatelný v moči časně po ischemickém nebo nefrotoxickém inzultu až o 48 hod časněji, než dojde k elevaci kreatininu; N-acetyl-(D)glucosamidaza – enzym, který je při poškození buněk proximálního tubulu uvolňován do moči.

Prevence a terapie KRS
Preventivní opatření rozvoje akutního zhoršení funkce ledvin u pacientů hospitalizovaných pro akutní srdeční selhání jsou relativně omezená: 1. Obecně snaha o časnou hemodynamickou stabilizaci s dosažením dostatečné perfuze ledvin (cílový srdeční index > 2,5 l/min/m2, střední arteriální tlak MAP > 65 mmHg, saturace smíšené žilní krve > 65 % nebo systémová vaskulární rezistence 800–1 000 dyn × s × cm–5 [21]. 2. Vyhnout se podání nefrotoxických léků a látek. V případě nutnosti vyšetřit pacienta jodovou kontrastní látkou. Je nutné zajistit dostatečnou hydrataci, při intravenózní aplikaci tekutin je doporučováno podání 0,9% roztoku NaCl rychlostí 1–2 ml/kg/hod po dobu minimálně 4 hod před a 24 hod po vyšetření (v případě městnavého srdečního selhání tuto dávku redukovat). Nefrotoxické léky jako jsou biguanidy či nesteroidní antiflogistika pokud možno nepodávat 48 hod před vyšetřením. Lze zvážit podání N-acetyl-cysteinu (600 mg) nebo infuze hydrogenuhličitanu sodného, přestože jejich nefropotektivní efekt nebyl jednoznačně prokázán [22]. Minimalizovat množství podané nízko nebo izoosmolární jodové kontrastní látky. 3. Snížit na minimum riziko rozvoje infekce/sepse, která dále výrazně zvyšuje riziko rozvoje poškození ledvin. 4. Bylo prokázáno, že zvýšený centrální žilní tlak je spojený se zvýšeným rizikem rozvoje poškození ledvin, zatímco při CŽT < 8–10 mmHg je nižší riziko rozvoje AKI [23]. V případě nejasné příčiny rozvoje renální dysfunkce je vhodné provést vyšetření močového sedimentu a ultrazvukové vyšetření ledvin včetně dopplerovského vyšetření renálních artérií.
Diuretika
Kličková diuretika jsou standardně podávána pacientům s akutním srdečním selháním [24]. Některé práce spojovaly podání vysokých dávek kličkových diuretik se zhoršením funkce ledvin [25]. Recentní randomizovaná menší studie DOSE (Diuretic Optimization Strategies Evaluation trial) [26] srovnávala bolusové podání diuretik oproti 12hodinové kontinuální infuzi a zároveň srovnávala malou intravenózně aplikovanou dávku diuretik (odpovídající předchozí perorální dávce diuretik) oproti vyšší dávce (odpovídající 2,5násobku předchozí chronické dávky diuretik). Kontinuální infuze furosemidu oproti bolusové aplikaci neprokázala výhody, zatímco vysoké dávky ve srovnání s nízkými sice vedly k mírnému přechodnému zhoršení funkce ledvin, ale zároveň prokázaly významné zlepšení sekundárních end-pointů – vyšší diurézu, pokles váhy, pokles biomarkerů SS a výraznější snížení dušnosti. Po 60 dnech nebylo prokázáno zvýšené riziko klinických příhod při terapii vyššími bolusovými dávkami. Terapie kličkovými diuretiky je spojena s rizikem nežádoucích účinků, jako jsou hyponatremie, hypokalemie a hypomagnezemie. Pacienti se známkami výrazné retence tekutin by měli být léčeni kličkovými diuretiky aplikovanými intravenózně, aby se zamezilo jejich pomalému a nedostatečnému vstřebání. Jednorázové podání dávky 20–60 mg nemusí být dostatečné, potom je vhodné aplikovat intravenózně dávku furosemidu odpovídající 2–2,5násobku dávky, jakou pacient užívá v chronické medikaci.
Rezistence na diuretika
Příčinou nedostatečného účinku kličkových diuretik může být, mimo nedostatečné resorpce z trávicího traktu při pravostranné kongesci, rovněž omezená vazba furosemidu na plazmatické bílkoviny při hypoalbuminemii, porucha sekrece volné formy diuretika v proximálním tubulu (například interferencí s nesteroidními antiflogistiky), hypovolemie nebo hyponatremie. Při zhoršené odpovědi na terapii diuretiky je vhodná restrikce tekutin < 1,5–2 l tekutin/24 hod [27], je možné využít kombinaci kličkových diuretik s thiazidovými diuretiky [28,29], a nebo změnu z intermitentního podávání bolusů furosemidu na kontinuální podání [30,31] (přestože studie DOSE jednoznačný profit neprokázala). Menší studie pacientů s refrakterním srdečním selháním a hyponatremií prokázaly pozitivní efekt na zvýšení diurézy a zlepšení renálních funkcí při podání malého množství hypertonického roztoku chloridu sodného (150 ml 1,4–4,6 % NaCl) společně s furosemidem v dávce 125–250 mg ve srovnání se samotným furosemidem [32,33].
Antagonisté aldosteronu
Pacienti hospitalizovaní pro zhoršení srdečního selhání mají často nepřiměřeně vysoké hladiny mineralokortikoidů. Bylo prokázáno, že terapie antagonisty aldosteronu (spironolaktonu nebo eplerenonu) u pacientů s chronickým srdečním selháním zlepšuje symptomy a prognózu [34,35]. Ve skupině pacientů s akutním srdečním selháním dosud žádná podobná rozsáhlá studie provedena nebyla. Lze ovšem předpokládat, že většina patofyziologických mechanizmů působících při akutním srdečním selhání by mohla být antagonisty aldosteronu pozitivně ovlivněna. Antagonisté mohou snižovat arteriální vazokonstrikci a reabsorpci sodíku v ledvinném tubulu, mohou působit prevenci renální intersticiální fibrózy, glomerulosklerózy a proteinurie a zároveň vedou ke zlepšení diurézy a natriurézy. Tím přispívají k omezení rezistence na kličková diuretika a jejich nežádoucím vedlejším účinkům, jako je hypokalemie a zpětnovazebná aktivace SNS a RAAS. Podle evropských doporučení pro diagnostiku a léčbu chronického a akutního srdečního selhání [36] by měla být léčba antagonisty aldosteronu (spironolakton nebo eplerenon) zahájena co nejdříve, pokud nemá pacient hyperkalemii (> 5 mmol/l) nebo významnou renální insuficienci (eGFR < 30 ml/min/1,73m2 nebo kreatinin 221 μmol/l). Ve studii Ephesus byl rozvoj závažné hyperkalemie (≥ 6 mmol/l) častější u pacientů se vstupní odhadovanou GFR < 60 ml/min/1,73 m2, u pacientů s diabetes mellitus a při vstupní hladině draslíku > 4,3 mmol/l. Nízké dávky antagonistů aldosteronu (spironolakton 25 mg, eplerenon 25 mg) používané k léčbě akutního srdečního selhání ovlivňují minimálně krevní tlak, a proto může být terapie zahájena časně po přijetí i při relativně nízkém tlaku a dávky dále titrovány během hospitalizace. Kontrola renálních funkcí a draslíku by měla být provedena za 72 hod, za 4 týdny a poté rutinně každé 3–4 měsíce [37]. O využití intravenózního preparátu canrenoate (Aldactone 200 mg) je minimum informací z klinických studií a je využíván především u pacientů neschopných přijímat perorální medikaci či při rezistenci na standardní kličková diuretika. Jednorázové podání je spojeno s nevýznamnou elevací hladiny draslíku [38].
ACE inhibitory
Léčba ACE inhibitory (ACE-I) by měla být zahájena u pacientů s akutním srdečním selháním, včetně pacientů po akutním infarktu myokardu, co nejdříve, a to nízkou dávkou, která se postupně titruje. ACE-I by neměly být podávány u pacientů s hyperkalemií (> 5 mmol/l), renální insuficiencí (eGFR < 30 ml/min/1,73 m2 nebo kreatinin > 221 μmol/l) nebo symptomatickou popřípadě významnou asymptomatickou hypotenzí (systolický TK < 90–100 mmHg). U pacientů s akutní dekompenzací se snažíme ACE-I ponechat, pokud nedojde k hypotenzi, hyperkalemii nebo zhoršení renálních funkcí. Vzestup kreatininu o 25–30 % či kreatinin > 250 μmol/l je relativní kontraindikací pokračování v léčbě ACE-I [36]. Přechodný vzestup hladiny kreatininu při zahájení terapie ACE-I u pacientů se srdečním selháním není spojen se ztrátou benefitu, který přináší terapie ACE-I těmto pacientům [38].
Léky s pozitivně inotropním účinkem
Podání dopaminu v dávkách 2–4 μg/kg/min bývá spojováno s tzv. renoprotektivním účinkem. Dle doporučení České a Evropské kardiologické společnosti je podání dopaminu v dávce 2,5 μg/kg/min možno zvážit při trvajících známkách srdečního selhání a oligourii (< 20 ml/hod) společně s infuzí kličkového diuretika. Provedené meta-analýzy randomizovaných studií s dopaminem došly k závěru, že použití nízkých dávek dopaminu nepůsobí preventivně před rozvojem renálního poškození, neovlivňuje mortalitu, pouze mírně zvyšuje diurézu bez prevence zhoršení renálních funkcí nebo ovlivnění hladiny kreatininu [40–42]. Další pozitivně inotropní látkou s vazodilatačním účinkem je levosimendan [43]. Efekt podání levosimendanu v porovnání s dobutaminem ve skupině pacientů s těžkým srdečním selháním vyžadujících inotropní podporu sledovala menší studie, ve které jak při léčbě dobutaminem tak levosimendanem sice došlo k vzestupu diurézy, nicméně pouze ve skupině pacientů léčených levosimendanem došlo po terapii k vzestupu odhadované GFR o 45% [44]. Z výsledků retrospektivních stejně jako z velkých randomizovaných klinických studií jasně vyplývá, že léky s pozitivně inotropní účinkem, navzdory všem příznivým efektům na hemodynamiku (včetně zvýšení srdečního výdeje a redukce systémové vaskulární rezistence), nesnižují mortalitu, ba naopak mohou vést k jejímu zvýšení [45,46]. Použití inotropik by proto mělo být omezena pouze na ty stavy, ve kterých je zhoršování renálních funkcí těsně spjato s globální a renální hypoperfuzí a délka terapie by měla být vzhledem ke známým nežádoucím účinkům minimalizována. Pečlivé monitorování elektrolytů a EKG je nezbytné.
Antagonisté vazopresinu
Kromě kličkových diuretik jsou antagonisté vazopresinu jediné léky, které jsou schopné nastartovat u pacientů s ASS diurézu. Blokáda V2 receptorů zvyšuje clearance čisté vody.
Do této lékové skupiny spadá conivaptan (V1a a V2 antagonista – t.č. není v ČR k dispozici) a tolvaptan (selektivní V2 antagonista). S tolvaptanem byly zatím provedeny dvě velké klinické studie, které potvrdily jeho účinnost při dosažení poklesu hmotnosti a zlepšení hyponatremie bez postižení renálních funkcí. Nebyl ovšem prokázán příznivý efekt na mortalitu [47,48]. Terapie tolvaptanem je schválena pro léčbu euvolemické a těžké nebo symptomatické hypervolemické hyponatremie, ale ne pro specifickou terapii městnání při srdečním selhání.
Hemodialýza/ultrafiltrace
Ultrafiltrace je doporučována jako alternativní strategie k diuretické terapii u pacientů se srdečním selháním nereagujícím na diuretickou terapii [36]. Potenciální výhody ultrafiltrace zahrnují větší kontrolu nad rychlostí a objemem odstraňovaných tekutin, množstvím odstraněného sodíku a menší neurohumorální aktivaci. Randomizovaná studie však neprokázala benefit ultrafiltrace před farmakologickou terapií, pokles váhy byl po 4 dnech srovnatelný, ale ve skupině pacientů léčených ultrafiltrací byl mírně vyšší vzestup kreatininu [49]. Zahájení hemoeliminační terapie se řídí obecnými doporučeními pro akutní ledvinné selhání, je snaha zahájit terapii časněji ještě před vznikem těžkého metabolického rozvratu (tab. 2). Výběr konkrétní eliminační metody závisí na individuálním klinickém stavu pacienta, místních zkušenostech a dostupnosti metody. Intermitentní hemodialýza je preferována u hemodynamicky stabilních pacientů, kontinuální hemoeliminační metody spíše pro hemodynamicky nestabilní pacienty [50].

Realita akutního zhoršení ledvin u pacientů hospitalizovaných pro akutní srdeční selhání v České republice podle registru akutního srdečního selhání AHEAD
Registr akutního srdečního selhání AHEAD vyhodnocuje data pacientů hospitalizovaných pro ASS. Metodika a hlavní výsledky byly popsány již dříve [6], zde bychom chtěli pouze stručně ilustrovat význam akutního zhoršení funkce ledvin k prognóze pacientů s ASS. Téměř polovina pacientů měla vstupní hodnotu kreatinu nad 110 μmol/l, nejvyšší hodnoty měli pacienti v kardiogenním šoku a pacienti s chronickou ischemickou chorobou srdeční. Pacienti s akutní dekompenzací srdečního selhání měli ve srovnání s pacienty s de-novo ASS vyšší vstupní hodnoty kreatininu. Z celkového počtu mělo 27,7 % pacientů zhoršení funkce ledvin, nejvíce to bylo ve skupině pacientů v kardiogenním šoku – 43 %. Výsledky v tab. 3 dokumentují výrazný nárůst 30denní a roční mortality v závislosti na rozvoji postižení ledvin ve všech zde vyhodnocených skupinách.
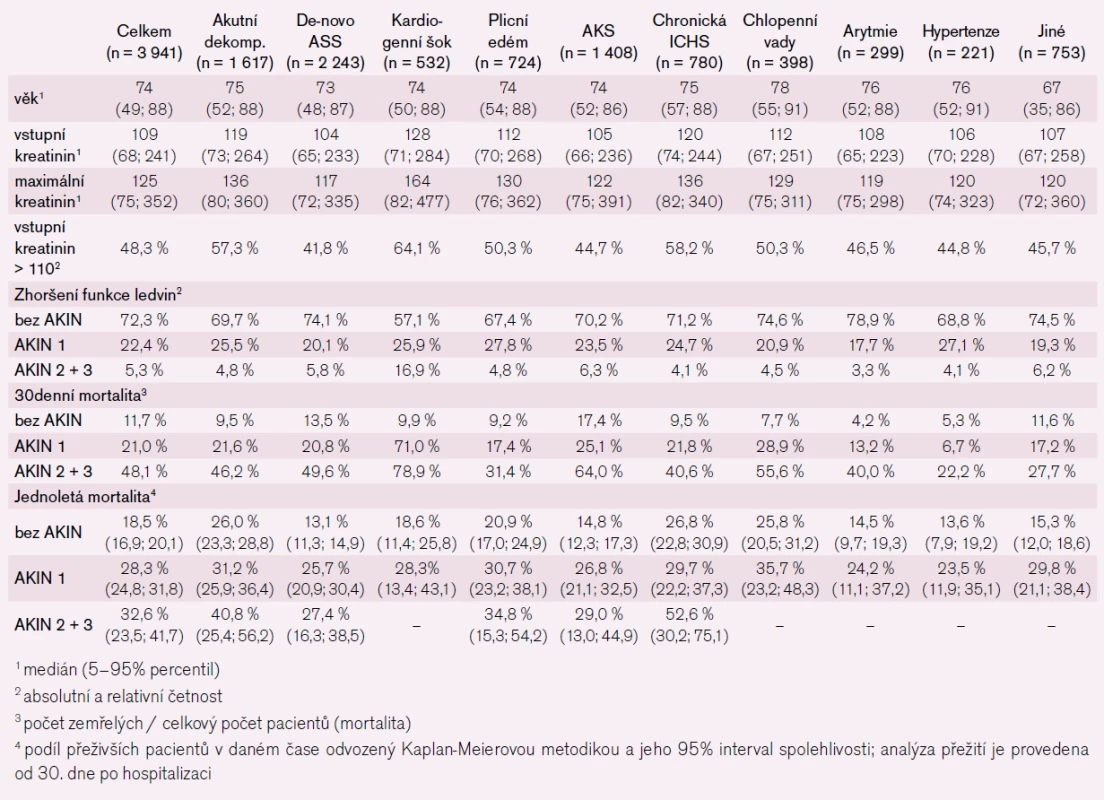
Závěr
Zhoršení funkce ledvin u pacientů hospitalizovaných pro akutní srdeční selhání je časté a je spojené s horší krátkodobou i dlouhodobou prognózou. Možnosti preventivních opatření jsou omezená, je nutné omezit na minimum aplikaci kontrastních látek a nefrotoxických léků, zajistit přiměřenou hydrataci. V případě selhání ledvin zavčas zahájit podporu funkce ledvin intermitentními nebo kontinuálními hemoeliminačními metodami.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno) a projektem European Regional Development Fund – Projekt Fakultní nemocnice u sv. Anny v Brně a ICRC (No. CZ.1.05/1.1.00/02.0123).
Doručeno do redakce 15. 11. 2012
Přijato po recenzi 10. 12. 2012
MUDr. Kateřina Helánová1,2
prof. MUDr. Jindřich Špinar, CSc., FESC1,2,3
RNDr. Jiří Jarkovský, Ph.D.4
MUDr. Marián Felšöci, Ph.D.1,3
MUDr. Roman Miklík, Ph.D.1,3
MUDr. Mgr. Jiří Pařenica, Ph.D.1,2,3
1 Interní kardiologická klinika FN Brno-Bohunice
2 LF MU v Brně
3 Mezinárodní centrum klinického výzkumu –
Klinika kardiovaskulárních onemocnění, FN U sv. Anny v Brně
4 Institut biostatistiky a analýz, Masarykovy univerzity v Brně
jiri.parenica@atlas.cz
Zdroje
1. Follath F, Yilmaz MB, Delgado JF et al. Clinical presentation, management and outcomes in the Acute Heart Failure Global Survey of Standard Treatment (ALARM-HF). Intensive Care Med 2011; 37: 619–626.
2. Siirilä-Waris K, Lassus J, Melin J et al. FINN--AKVA Study Group. Characteristics, Outcomes, and Predictors of 1-year Mortality in Patients Hospitalized for Acute Heart Failure. Eur Heart J 2006; 27: 3011–3017.
3. Nieminen M, Brutsaert D, Dickstein K et al. EuroHeart Survey Investigators; Heart Failure Association, European Society of Cardiology. EuroHeart Failure Survey II (EHFS II): a Survey on Hospitalized Acute Heart Failure Patients: Description of Population. Eur Heart J 2006; 27: 2725–2736.
4. Cleland J, Swedberg K, Follath F et al. Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. The EuroHeart Failure Survey Programme – a Survey on the Quality of Care Among Patients with Heart Failure in Europe. Part 1: Patient Characteristics and Diagnosis. Eur Heart J 2003; 24: 442–463.
5. Fonarow GC, Abraham WT, Albert NM et al. Influence of a Performance-improvement Initiative on Quality of Care for Patients Hospitalized with Heart Failure: Results of the Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients With Heart Failure (OPTIMIZE-HF). Arch Intern Med 2007; 167: 1493–1502.
6. Spinar J, Parenica J, Vitovec J et al. Baseline Characteristics and Hospital Mortality in the Acute Heart Failure Database (AHEAD) Main Registry. Crit Care 2011; 15: R291.
7. Parenica J, Spinar J, Vitovec J et al. Long-term Survival Following Acute Heart Failure: The Acute Heart Failure Database Main Registry (AHEAD Main). Eur J Internal Med [Epub ahead of print].
8. Forman DE, Butler J, Wang Y et al. Incidence, Predictors at Admission, and Impact of Worsening Renal Function Among Patients Hospitalized with Heart Failure. J Am Coll Cardiol 2004; 43: 61–67.
9. Cowie M, Komajda M, Murray-Thomas T et al. POSH Investigators. Prevalence and Impact of Worsening Renal Function in Patients Hospitalized with Decompensated Heart Failure: Results of the Prospective Outcomes Study in Heart Failure (POSH). Eur Heart J 2006; 27: 1216–1222.
10. Metra M, Nodari S, Parrinello G et al. Worsening Renal Function in Patients Hospitalised for Acute Heart Failure: Clinical Implications and Prognostic Significance. Eur J Heart Fail 2008; 10: 188–195.
11. Tomcikova D, Felsoci M, Spinar J et al. Risk of In-hospital Mortality Identified According to the Typology of Patients with Acute Heart Failure: Classification Tree Analysis on Data from the Acute Heart Failure Database-Main Registry. J Crit Care 2012, doi: 10.1016/j.jcrc.2012.09.014. [Epub ahead of print].
12. Aronson D, Burger A. The Relationship Between Transient and Persistent Worsening Renal Function and Mortality in Patients with Acute Decompensated Heart Failure. J Card Fail 2010; 16: 541–547.
13. Heywood JT, Fonarow GC, Costanzo MR et al. High Prevalence Of Renal Dysfunction And Its Impact On Outcome In 118,465 Patients Hospitalized With Acute Decompensated Heart Failure: A Report From The ADHERE Database. J Card Fail 2007; 13: 422–430.
14. Ronco C, McCullough P, Anker S et al. Acute Dialysis Quality Initiative (ADQI) consensus group. Cardio--renal Syndromes: Report from the Consensus Conference of the Acute Dialysis Quality Initiative. Eur Heart J 2010; 31: 703–711.
15. Ronco C, House AA, Haapio M et al. Cardiorenal Syndrome: Refining the Definition of a Complex Symbiosis Gone Wrong. Intensive Care Med 2008; 34: 957–962.
16. Levey AS, Eckardt KU, Tsukamoto Y et al. Definition and Classification of Chronic Kidney Disease: A Position Statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2005; 67: 2089–2100.
17. Lombardi R, Nin N, Lorente JA et al. An assessment of the Acute Kidney Injury Network creatinine-based criteria in patients submitted to mechanical ventilation. Clin J Am Soc Nephrol 2011; 6: 1547–1555.
18. Mehta RL, Kellum JA, Shah SV et al. Acute Kidney Injury Network: Report of an Initiative to Improve Outcomes in Acute Kidney Injury. Crit Care 2007; 11: R31.
19. Ismail Y, Kasmikha Z, Green H et al. Cardio-renal Syndrome Type 1: Epidemiology, Pathophysiology, and Treatment. Semin Nephrol 2012; 32: 18–25.
20. Breidthardt T, Socrates T, Drexler B et al. Plasma Neutrophil Gelatinase-associated Lipocalin for the Prediction of Acute Kidney Injury in Acute Heart Failure. Crit Care 2012; 16: R2.
21. Werdan K, Ruß M, Buerke M et al. German Cardiac Society; German Society of Intensive Care and Emergency Medicine; German Society for Thoracic and Cardiovascular Surgery; (Austrian Society of Internal and General Intensive Care Medicine; German Interdisciplinary Association of Intensive Care and Emergency Medicine; Austrian Society of Cardiology; German Society of Anaesthesiology and Intensive Care Medicine; German Society of Preventive Medicine and Rehabilitation. Cardiogenic Shock Due to Myocardial Infarction: Diagnosis, Monitoring and Treatment: a German-Austrian S3 Guideline. Dtsch Arztebl Int. 2012; 109: 343–351.
22. Pannu N, Manns B, Lee H et al. Systematic Review of the Impact of N-acetylcysteine on Contrast Nephropathy. Kidney Int 2004; 65: 1366–1374.
23. Mullens W, Abrahams Z, Francis G et al. Importance of Venous Congestion for Worsening of Renal Function in Advanced Decompensated Heart Failure. J Am Coll Cardiol 2009; 53: 589–596.
24. McMurray J, Adamopoulos S, Anker S et al. ESC Committee for Practice Guidelines. ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in Collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2012; 14: 803–869.
25. Butler J, Forman D, Abraham W et al. Relationship Between Heart Failure Treatment and Development of Worsening Renal Function Among Hospitalized Patients. Am Heart J 2004; 147: 331–338.
26. Felker GM, Lee KL, Bull DA et al. Diuretic Strategies in Patients with Acute Decompensated Heart Failure. N Engl J Med 2011; 364: 797–805.
27. Lindenfeld J, Albert N, Boehmer J et al. Heart Failure Society of America, Lindenfeld J. HFSA 2010 Comprehensive Heart Failure Practice Guideline. J Card Fail 2010; 16: e1–e194.
28. Channer K, McLean K, Lawson-Matthew P et al. Combination Diuretic Treatment in Severe Heart Failure: a Randomised Controlled Trial. Br Heart J 1994; 71: 146–150.
29. Dormans TP, Gerlag PG. Combination of High--dose Furosemide and Hydrochlorothiazide in the Treatment of Refractory Congestive Heart Failure. Eur Heart J 1996; 17: 1867–1874.
30. Amer M, Adomaityte J, Qayyum R. Continuous Infusion Versus Intermittent Bolus Furosemide in ADHF: An Updated Meta-analysis of Randomized Control Trials. J Hosp Med 2012; 7: 270–275.
31. Hawkins E, Malesker M, Hilleman D et al. A Retrospective Analysis of Intermittent Bolus Dosing Versus Continuous Infusion Dosing of Furosemide in Critical Care Patients With Diuretic Resistance. CHEST 2012; 142: 402A–402A.
32. Parrinello G, Di Pasquale P, Torres D et al. Troponin I Release After Intravenous Treatment with High Furosemide Doses Plus Hypertonic Saline Solution in Decompensated Heart Failure Trial (Tra-HSS-Fur). Am Heart J 2012; 164: 351–357.
33. Licata G, Di Pasquale P, Parrinello G et al. Effects of High-dose Furosemide and Small-volume Hypertonic Saline Solution Infusion in Comparison with a High Dose of Furosemide as Bolus in Refractory Congestive Heart Failure: Long-term Effects. Am Heart J 2003; 145: 459–466.
34. Pitt B, Zannad F, Remme J et al. The Effect of Spironolactone on Morbidity and Mortality in Patients with Severe Heart Failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341: 709–717.
35. Zannad F, McMurray JJV, Krum H et al. EMPHASIS-HF Study Group. Eplerenone in Patients with Systolic Heart Failure and Mild Symptoms. N Engl J Med 2011; 364: 11–21.
36. McMurray J, Adamopoulos S, Anker S et al. ESC Committee for Practice Guidelines. ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in Collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33: 1787–1847.
37. Zannad F, Gattis Stough W, Rossignol P et al. Mineralocorticoid Receptor Antagonists for Heart Failure with Reduced Ejection Fraction: Integrating Evidence into Clinical Practice. Eur Heart J 2012; 33: 2782–2795.
38. Ceremuzyński L, Budaj A, Michorowski A et al. Single-dose i.v. Aldactone for Congestive Heart Failure: a Preliminary Observation. Int J Clin Pharmacol Ther Toxicol 1983; 21: 417–421.
39. Testani J, Kimmel S, Dries D et al. Prognostic Importance of Early Worsening Renal Function After Initiation of Angiotensin-converting Enzyme Inhibitor Therapy in Patients with Cardiac Dysfunction. Circ Heart Fail 2011; 4: 685–691.
40. Kellum JA, Decker J. Use of Dopamine in Acute Renal Failure: a Meta-analysis. Crit Care Med 2001; 29: 1526–1531.
41. Friedrich J, Adhikari N, Herridge MS et al. Meta--analysis: Low-dose Dopamine Increases Urine Output but Does Not Prevent Renal Dysfunction or Death. Ann Intern Med 2005; 142: 510–524.
42. Giamouzis G, Butler J, Starling R et al. Impact of Dopamine Infusion on Renal Function in Hospitalized Heart Failure Patients: Results of the Dopamine in Acute Decompensated Heart Failure (DAD-HF) Trial. J Card Fail 2010; 16: 922–930.
43. Miklik R, Parenica J, Felsoci M et al. Levosimendan v léčbě akutního srdečního selhání – zkušenosti z kardiologické kliniky. Cor Vasa 2009; 51: 507–512.
44. Yilmaz M, Yalta K, Yontar C et al. Levosimendan Improves Renal Function in Patients with Acute Decompensated Heart Failure: Comparison with Dobutamine. Cardiovasc Drugs Ther 2007; 21: 431–435.
45. Abraham WT, Adams KF, Fonarow GC et al. ADHERE Scientific Advisory Committee and Investigators, ADHERE Study Group. In-hospital Mortality in Patients with Acute Decompensated Heart Failure Requiring Intravenous Vasoactive Medications: An Analysis from the Acute Decompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol 2005; 46: 57–64.
46. Klein L, Massie B, Leimberger J et al. OPTIME--CHF Investigators. Admission or Changes in Renal Function During Hospitalization for Worsening Heart Failure Predict Postdischarge Survival: Results from the Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of Chronic Heart Failure (OPTIME-CHF). Circ Heart Fail 2008; 1: 25–33.
47. Konstam MA, Gheorghiade M, Burnett JC Jr et al. Effects of Oral Tolvaptan in Patients Hospitalized for Worsening Heart Failure: The EVEREST Outcome Trial. JAMA 2007; 297: 1319–1331.
48. Gheorghiade M, Gattis W, O‘Connor C et al. Acute and Chronic Therapeutic Impact of a Vasopressin Antagonist in Congestive Heart Failure (ACTIV in CHF) Investigators. Effects of Tolvaptan, a Vasopressin Antagonist, in Patients Hospitalized with Worsening Heart Failure: a Randomized Controlled Trial. JAMA 2004; 291: 1963–1971.
49. Bart B, Goldsmith S, Lee K et al. Heart Failure Clinical Research Network. Ultrafiltration in Decompensated Heart Failure with Cardiorenal Syndrome. N Engl J Med 2012 [Epub ahead of print].
50. Lewington A, Kanagasundaram S. Clinical Practice Guidelines for Acute Kidney Injury. 2010. www.renal.org/guidelines.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2012 Číslo 4
Nejčtenější v tomto čísle
- Kardiorenální syndrom – pohled nefrologa
- Ovlivní podávání redukované formy koenzymu Q10 statinovou myopatii?
- Kardio-renálny syndróm u chronického srdcového zlyhávania – pohľad kardiológa
- Akutní selhání ledvin a kardiovaskulární komplikace
